广玉兰果实水煎液对H22荷瘤小鼠的抗肿瘤作用
李雯雯张亚茹高帆牛玉季杜钢军
河南大学药学院 药物研究所,开封475004
肝癌是恶性肿瘤的代表之一,目前也是国内外医学界较为热点的研究之一。目前临床上常采用外科手术、肝移植、经导管肝动脉化疗栓塞、射频消融、靶向治疗、化疗等措施[1],虽然从某种程度上可以缓解病情,但也会使患者机体的正常功能受损。
广玉兰果实是木兰科木兰属植物广玉兰(Magnolia grandifloraL.)的干燥果实[2]。广玉兰果实性辛温、无毒,有祛风散寒、行气止痛的功效,外感风寒、头痛、鼻塞、脘腹胀痛、呕吐、腹泻、高血压等是其主要的适应证[3]。本研究旨在探讨广玉兰果实水煎液对H22荷瘤小鼠的抗肿瘤作用。
1 试验材料
1.1 药材
制备广玉兰果实水煎液的步骤:①称取广玉兰果实100 g;②加蒸馏水使其埋没,充分浸泡30 min;③中火煎煮30 min左右,过滤,得第1次滤液;④加适量蒸馏水,中火煎煮30 min左右,过滤,得第2次滤液;⑤再加适量蒸馏水,中火煎煮30 min左右,过滤,得第3次滤液;⑥合并三次滤液继续煎煮并浓缩至200mL;⑦待药液冷却至室温,装于瓶中,标记好名称、日期,放置于-20 ℃冰箱冷冻。
1.2 实验动物
河南省医学实验动物中心提供健康的昆明小鼠(雌性,23~28 g),许可证号:SCXK(豫)2015-0002。
1.3 肿瘤细胞
河南省医学实验动物中心提供H22肝癌细胞,许可证号:SCXK(豫)2015-0002。
1.4 实验仪器
FA1004B型电子天平(广州市典锐化玻实验仪器有限公司);LDZX-75KBS 立式压力蒸汽灭菌锅(济南博鑫生物技术有限公司);EM-KC150数显游标卡尺(河东区星光扳钳工具厂);Thermo FC 型酶标仪(济南千司生物技术有限公司);超净工作台(上海博讯实验公司);SL2306 CO2细胞培养箱(美国Shellab公司);800型离心机(上海梅香仪器有限公司);微量移液器(上海佳安分析仪器厂);BCD-539WT 低温冰箱(中国海尔集团)等。
1.5 实验试剂
印度墨汁(1∶4生理盐水);生理盐水;75%(v/v)酒精;红细胞裂解液(Tris-NH4Cl);蒸馏水;0.1%(m/m)碳酸钠溶液。
2 试验方法
2.1 H22荷瘤小鼠模型的构建
将已腹腔接种7~9 d H22肝癌细胞的小鼠颈椎脱臼处死,于酒精中充分浸泡消毒;超净台无菌环境下,将乳白色腹水从小鼠腹腔中抽出;离心(1 000 r/min,5 min);上清倒掉,加红细胞裂解液(Tris-NH4Cl),间隔3 min后,二次离心(1 000 r/min,5 min);Tris倒掉,加生理盐水(灭菌),吹打细胞后,三次离心(1 000 r/min,5 min);上清倒掉,灭菌的生理盐水将细胞稀释150倍成细胞悬液;将瘤液接种于小鼠右肢腋部皮下,每只小鼠0.2mL。
2.2 实验动物分组
接瘤后,小鼠随机分为模型组、广玉兰果实组,各11只。模型组以0.2mL/10 g的剂量灌胃生理盐水;广玉兰果实组以0.2mL/10 g的剂量灌胃广玉兰果实水煎液,每天1次,连续灌胃12 d。
2.3 观察指标
测定瘤体积、瘤质量和抑瘤率。当手感受到肿瘤长出后,用游标卡尺对瘤的长径a和短径b进行测量、记录,每天1次,并计算瘤体积V(mm3),直至实验结束。颈椎脱臼处死小鼠,将瘤完整剥离、称质量,计算抑瘤率R[4]。
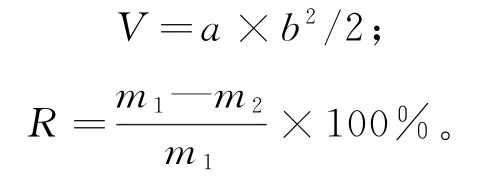
式中,m1为模型组平均瘤质量,m2为广玉兰果实组平均瘤质量。
2.4 碳粒廓清实验
实验结束当天,小鼠灌胃广玉兰果实水煎液半小时后,各组以0.1mL/10 g的剂量尾静脉注射印度墨汁(1∶4生理盐水),注射后1 min(t1)眼眶采血20μL加到2mL 0.1%(m/m)的碳酸钠溶液中,混匀,注射后10 min(t2)再次眼眶采血20μL 加到2mL 0.1%(m/m)的碳酸钠溶液中,混匀。离心(3 000 r/min,10 min)后,吸取各组上清加入96孔板中,酶标仪于620 nm 波长处测定吸光度A。采完血后,颈椎脱臼处死小鼠,将瘤、肝、脾完整剥离、称质量,计算吞噬指数K和吞噬系数α[5]。

式中,A1、A2分别为取血时间t1、t2时的吸光度,M为体质量,mli为肝脏质量,msp为脾脏质量。
2.5 网络药理学的预测过程
利用上海有机所化学专业数据库(http://www.organchem.csdb.cn)查询广玉兰的活性成分;用TCMSP 数据库(https://tcmspw.com/tcmsp.php)筛选其活性成分(设定OB≥30%、DL≥0.10);由Swiss Target Predication数据库获取广玉兰活性成分靶点;由Gene Cards(https://www.genecards.org/)数据库分别获取肝癌和巨噬细胞免疫调节的蛋白靶点;由Draw Venn Diagram(http://bioinformatics.psb.ugent.be/webtools/Venn)分别获取活性成分靶点与肝癌和巨噬细胞免疫调节的交集靶点。采用Cytoscape 3.2.1软件构建广玉兰抗肿瘤活性成分-预测靶点网络和免疫调节活性成分-预测靶点网络;由String 数据库(https://string-db.org/)分别获得交集靶点的相互作用关系;用Cytoscape 3.2.1软件分别构建抗肿瘤和免疫调节交集靶点网络(PPI);用DAVID 数据库分别对交集靶点GO注释和KEGG通路进行分析(P<0.05);由OmicShare高级气泡图获得GO 和KEGG 富集分析图;用Cytoscape 3.2.1软件的merge功能对广玉兰抗肿瘤活性成分-靶点-通路网络、免疫调节活性成分-靶点-通路网络进行构建。
2.6 统计学分析
用Graph Pad Prism 8.0.2统计学软件对实验数据进行处理,以表示实验数据,借助t检验完成组间两两比较,借助单因素方差分析完成多组间比较。P<0.05时,显示有统计学意义。
3 结果
3.1 广玉兰果实水煎液对小鼠肿瘤的影响
接瘤后第5天,小鼠腋下长出肿瘤。在第8~12 d,模型组小鼠肿瘤增长较快;与模型组比较,广玉兰果实组小鼠肿瘤增长较慢,抑瘤率为31.90%(P<0.05)。见如表1、图1。

表1 广玉兰果实水煎液对小鼠肿瘤的影响
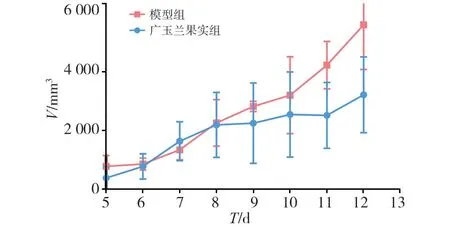
图1 瘤体积变化趋势
3.2 广玉兰果实水煎液对小鼠碳粒廓清水平的影响
模型组小鼠吞噬指数K、吞噬系数α较低,与模型组比较,广玉兰果实组小鼠吞噬指数K、吞噬系数α较高,P<0.05。见表2。

表2 广玉兰果实水煎液对小鼠碳粒廓清水平的影响
3.3 网络药理学的预测结果
广玉兰果实的活性成分共有5 种:和厚朴酚(honokiol)、厚朴酚(magnolol)、广玉兰内酯(magnograndiolide)、无梗五加苷B(acanthoside B)、β-谷甾醇(beta-sitosterol),这5 种既是抗肿瘤活性成分,也是免疫调节活性成分。广玉兰果实抗肿瘤活性成分—预测靶点网络共有202个节点,260条边,见图2。广玉兰果实抗肿瘤交集靶点网络(PPI)共有172个节点,656条边,见图3。广玉兰果实免疫调节活性成分—预测靶点网络共有202个节点,260条边,见图4。广玉兰果实免疫调节交集靶点网络(PPI)共有172个节点,659条边,见图5。
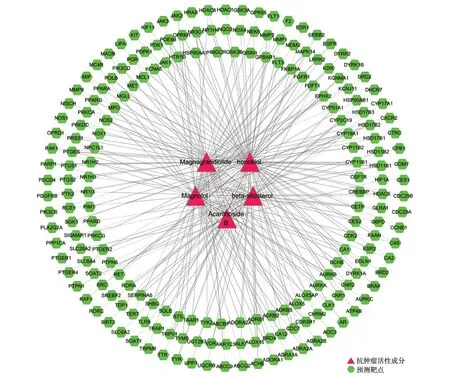
图2 广玉兰抗肿瘤活性成分-预测靶点网络
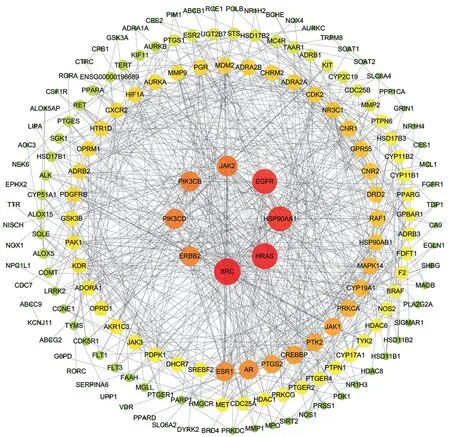
图3 广玉兰抗肿瘤交集靶点网络
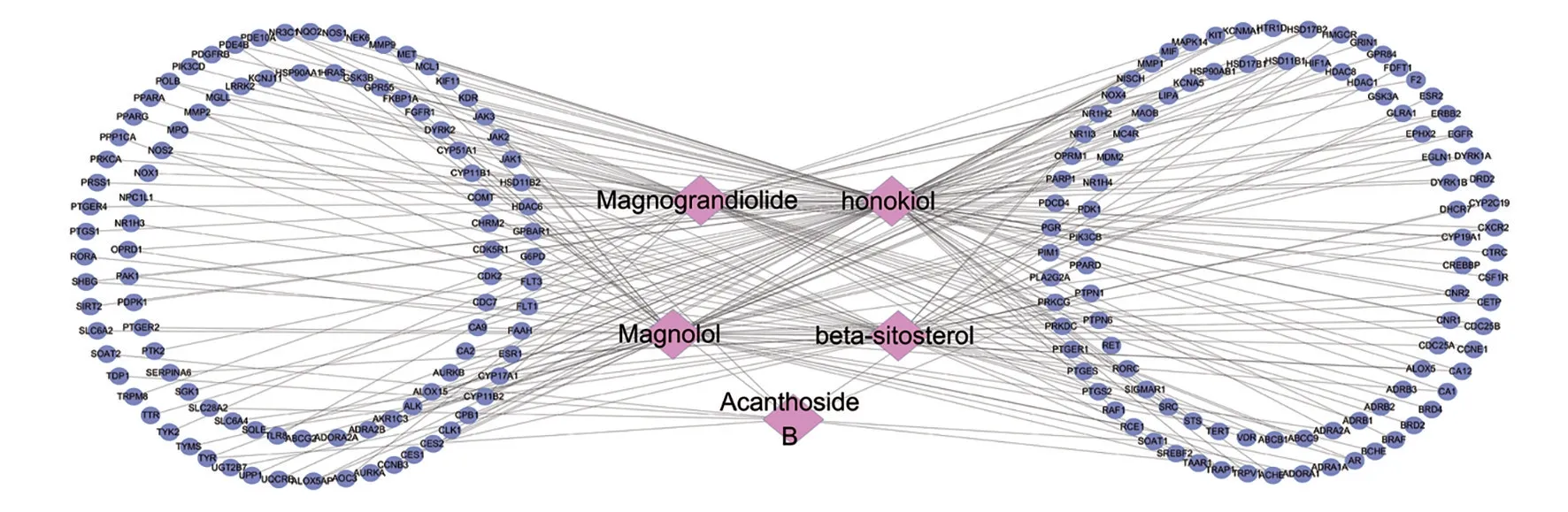
图4 广玉兰免疫调节活性成分-预测靶点网络
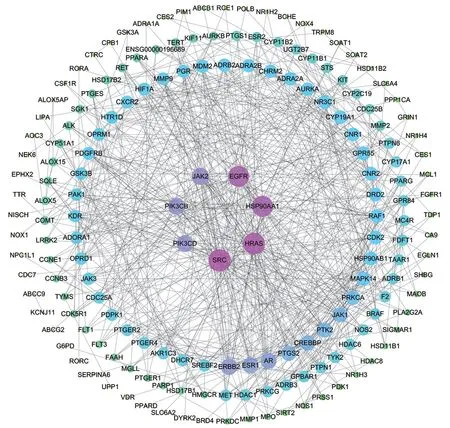
图5 广玉兰免疫调节交集靶点网络
广玉兰果实抗肿瘤GO 富集分析筛得49个生物过程(设定P<0.05,count≥9),排行前5个分别是“信号转导”“氧化还原过程”“DNA 转录的正反馈调节”“蛋白磷酸化”“蛋白自磷酸化”。广玉兰果实抗肿瘤KEGG 富集分析筛得41条信号通路(设定P<0.05,count≥9)。排行前五个分别是“癌症通路”“PI3K-Akt信号通路”“刺激神经组织配体-受体的相互作用”“癌症的蛋白多糖”“Rap1 信号通路”。
广玉兰果实免疫调节GO 富集分析筛得35个生物过程(设定P<0.05,count≥11),排行前5个分别是“信号转导”“氧化还原过程”“DNA 转录的正反馈调节”“蛋白磷酸化”“蛋白自磷酸化”。广玉兰果实免疫调节KEGG 富集分析筛得33条信号通路(设定P<0.05,count≥11),排行前5个分别是“癌症通路”“PI3K-Akt信号通路”“刺激神经组织配体-受体的相互作用”“癌症的蛋白多糖”“Rap1信号通路”。OmicShare高级气泡图对抗肿瘤和免疫调节GO 分析结果的前21项、KEGG 富集的前20项进行可视化,见图6、图7、图8。广玉兰果实抗肿瘤活性成分-靶点-通路网络共有207个节点,398条边,见图9。广玉兰果实免疫调节活性成分-靶点-通路网络共有207个节点,398条边,见图10。
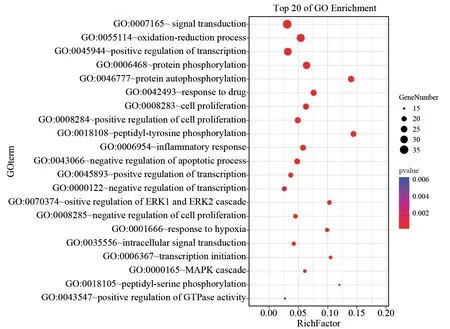
图6 广玉兰抗肿瘤和免疫调节GO 富集分析

图7 广玉兰抗肿瘤KEGG富集分析
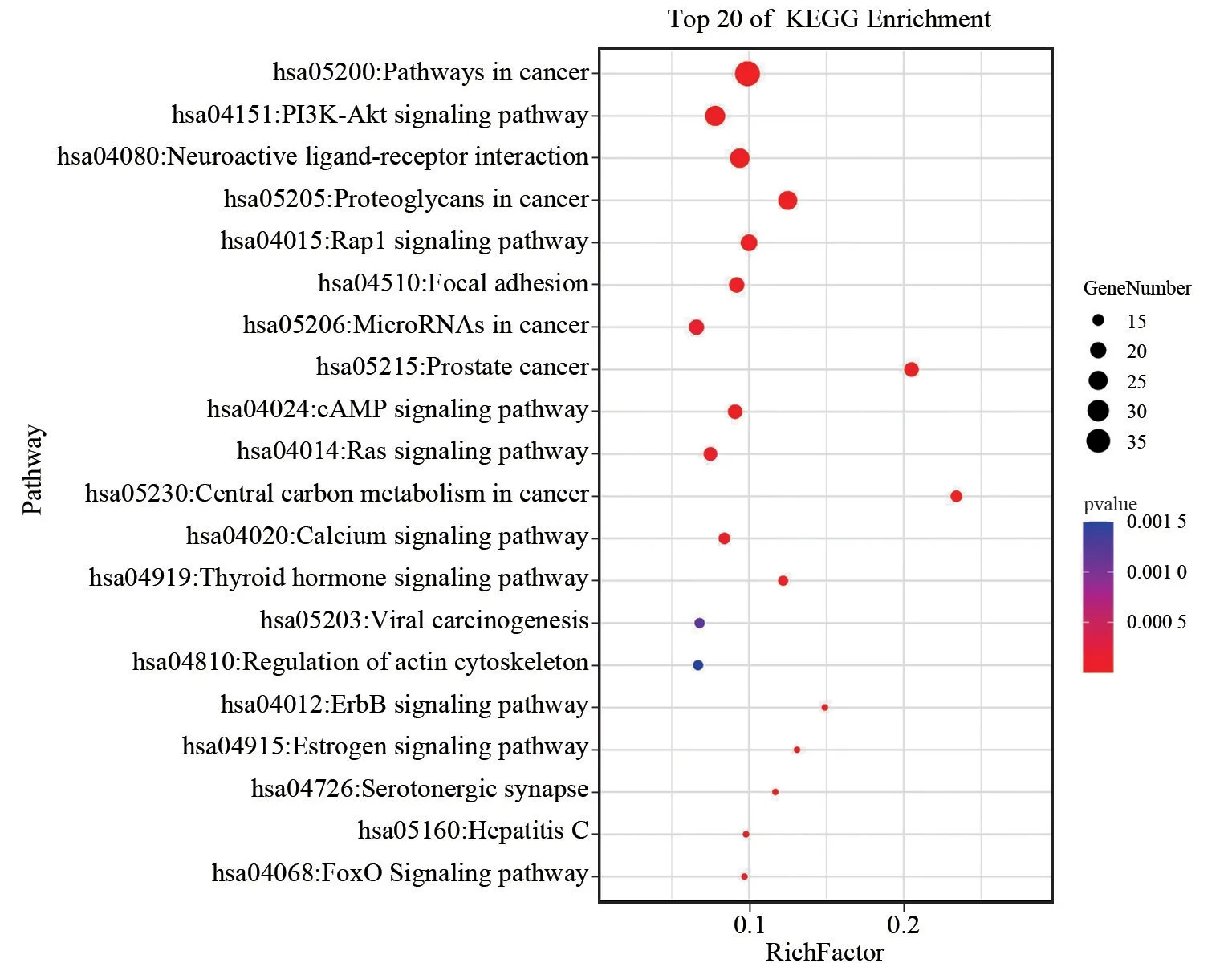
图8 广玉兰免疫调节KEGG富集分析

图9 广玉兰抗肿瘤活性成分-靶点-通路网络
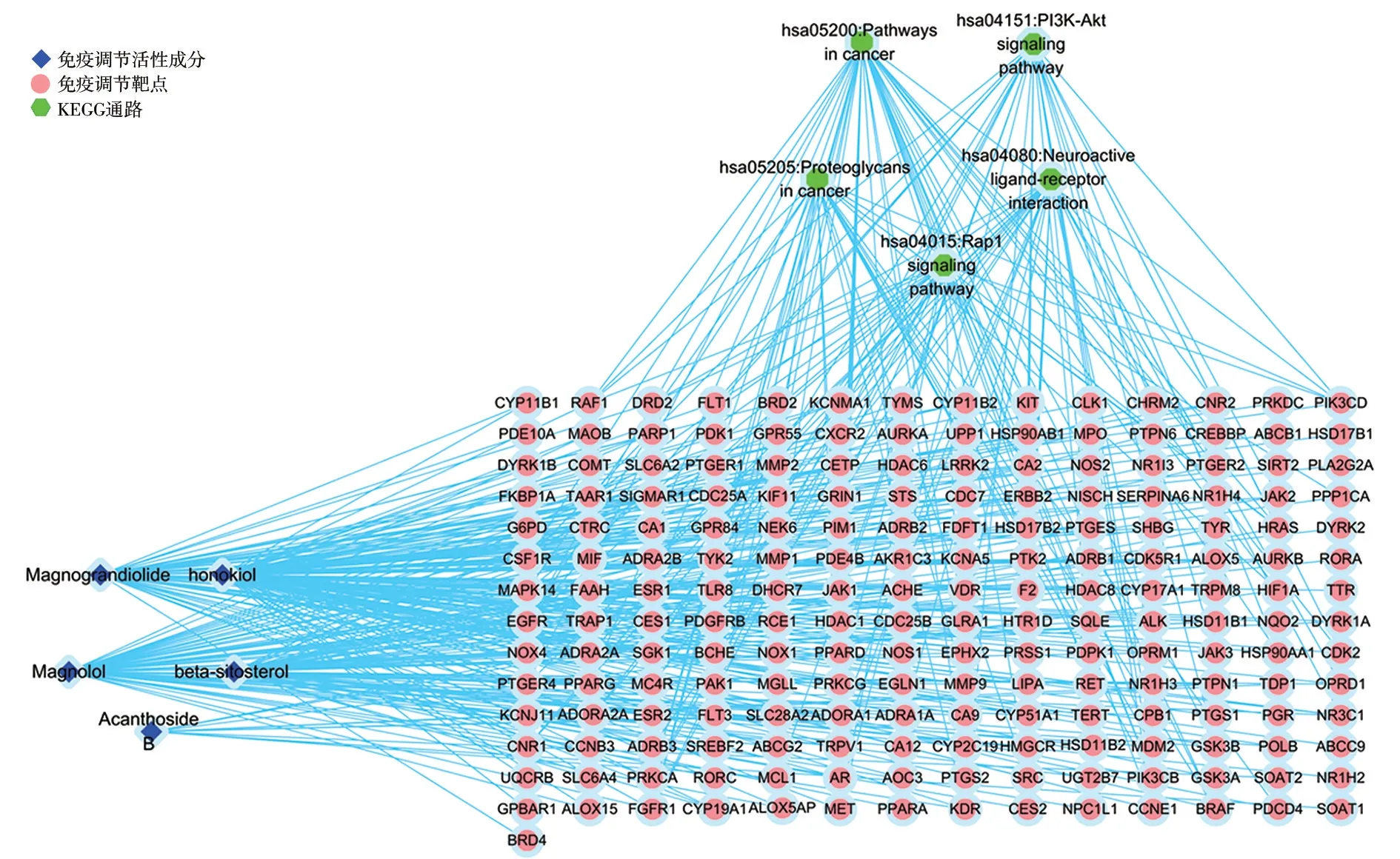
图10 广玉兰免疫调节活性成分-靶点-通路网络
4 讨论
肝癌发病率在世界癌症发病率中位居第六,死亡率在全球癌症死亡率中位居第二[6]。目前,从分子生物学水平研究肝癌的发病机制在深入进行,这可能是未来治疗肝癌的新方向,其已知的发病机制[7]如下:①原癌基因(ras基因、HBV X 基因)在化学因素、病毒因素等作用下异常激活,转变成癌基因,诱导细胞癌变。②抑癌基因(P53基因、P21基因、P16基因)突变或失活,使正常细胞转变为恶性细胞,产生癌症。③信号通路(Wnt/β-catenin信号通路、Notch信号通路、MAPK信号通路、AKT信号通路)活化异常。④生长因子(肝细胞生长因子HGF、表皮生长因子EGF、血管内皮生长因子VEGF、转化生长因子TGF)调控失衡,细胞增殖分化异常,产生癌症。上述基因、通路等与肝癌有很大联系,彻底理解它们之间的关系,有助于改善肝癌治疗效果。
中医药依据不同患者或同一患者不同时期的病情辨证论治,尤其是在肝癌患者的晚期阶段,中医药能够有效发挥其自身优势,对西医劣势进行弥补,这也获得了广大研究人员的认可[8]。
关于广玉兰果实活性成分和药理作用的研究较少,鉴于广玉兰果实来源于广玉兰,我们推测二者有相似的活性成分和作用。因此,本研究将广玉兰作为网络药理学的预测对象,可能会为未来明确广玉兰果实的成分和作用提供参考。网络药理学预测广玉兰有5种活性成分:和厚朴酚、厚朴酚、广玉兰内酯、无梗五加苷B、β-谷甾醇,这5种成分既是与抗肿瘤相关的活性成分,也是与免疫调节相关的活性成分。有研究[9]证实,以和厚朴酚、厚朴酚为代表的新木脂素类化合物具有抗肿瘤、抗病毒等多种生物学活性。无梗五加苷B 对肿瘤细胞脂滴的生成有抑制作用[10]。β-谷甾醇具有抗肿瘤和免疫调节作用[11]。广玉兰抗肿瘤和免疫调节涉及的主要信号通路:“癌症通路”“PI3K-Akt信号通路”“刺激神经组织配体-受体的相互作用”“癌症的蛋白多糖”“Rap1信号通路”。其中,刺激神经组织配体-受体的相互作用是质膜上所有与细胞内外信号通路相关的受体和配体的集合。PI3K-Akt信号通路在多种肿瘤中活化异常,与肿瘤细胞生长、增殖、代谢有很大联系[12]。Rap1信号通路在多种类型细胞中调节细胞迁移、整合蛋白介导的细胞黏附[13]。
本次实验结果如下:模型组小鼠肿瘤增长较快,瘤质量为(3.556±0.745)g;广玉兰果实组小鼠肿瘤增长较慢,瘤质量为(2.422±0.825)g,抑瘤率为31.90%(P<0.05)。表明广玉兰果实水煎液对H22荷瘤小鼠有抗肿瘤作用,提示可能与广玉兰抗肿瘤活性成分有关。
另外,模型组小鼠吞噬指数和吞噬系数较低,广玉兰果实组小鼠吞噬指数和吞噬系数较高(P<0.05),表明广玉兰果实水煎液对荷瘤小鼠巨噬细胞的吞噬功能有增强作用,提示可能与广玉兰免疫调节活性成分有关。巨噬细胞是肿瘤微环境中的免疫细胞之一,吞噬并杀灭病原菌和凋亡细胞[14],在肿瘤的每个阶段都发挥重要作用。广玉兰免疫调节活性成分靶向肿瘤微环境,通过增强巨噬细胞吞噬功能,提高免疫调节能力,发挥间接抗肿瘤作用[15]。
综上所述,广玉兰果实水煎液对H22荷瘤小鼠有抗肿瘤作用,这可能是广玉兰抗肿瘤活性成分与免疫调节活性成分协同作用的结果。

