烟草木质素结构的二维核磁共振波谱表征
高淼,蔡继宝,徐振宇,田大雨,苏加坤,张翼,杨俊*
烟草与烟气化学
烟草木质素结构的二维核磁共振波谱表征
高淼1,蔡继宝2,徐振宇2,田大雨1,苏加坤2,张翼2,杨俊1*
1中国科学技术大学烟草与健康研究中心,合肥市徽州大道1129号 230051;2江西中烟工业有限责任公司技术中心,南昌市京东大道201号 330096
【】烟草木质素对烟草品质和安全性有重要影响,为了提高烟草制品的质量,需要探究烟草木质素的化学结构及含量。利用二维异核单量子相干核磁共振技术(2D HSQC NMR)建立表征烟草木质素的方法,实现烟草木质素的结构表征及半定量分析。(1)烟草样品木质素中共发现10种主要的木质素基本单元及单元间连接键结构,27种相关结构的信号。(2)烟草样品木质素是SGH型木质素,愈创木基(G)是最主要的基本单元,含量在50.72%~73.50%范围内,紫丁香基(S)的含量在15.62%~26.51%范围内,对羟基苯基(H)的含量在5.66%~28.90%范围内;β-芳基醚单元β-O-4(A)是最主要的单元间连接键,含量在72.93%~92.97%范围内,树脂醇单元β-β(C)次之,含量在3.88%~15.81%范围内。(3)烤烟烟叶部位自上而下,紫丁香基(S)单元的含量逐渐减少,愈创木基(G)和对羟基苯基(H)单元的含量逐渐增加。梗丝和烟草薄片与烟叶相比,愈创木基(G)单元的含量较高,对羟基苯基(H)单元的含量较低,β-芳基醚单元β-O-4(A)的含量较低,树脂醇单元β-β(C)的含量较高。本研究实现了不同烟草木质素的基本单元及单元间连接键结构的定性表征和半定量分析,提出烟草木质素分子的结构示意图,为烟草木质素大分子研究提供一定的理论和技术基础。
二维核磁共振;HSQC;烟草;木质素;结构表征;定量分析
木质素是由紫丁香基(S)、愈创木基(G)和对羟基苯基(H)等基本单元组合成的一种复杂的,高度交联的网状多酚类聚合物[1-2],与纤维素、半纤维素等成分共同构成次生植物细胞壁。烟草中木质素不仅有增强烟株抗倒伏性和抵御微生物侵害等生物学功能,还对卷烟的品质有重要影响[3]。在烟叶调制和醇化阶段,烟草木质素降解产生苯甲醇、苯乙醛等一系列芳香族小分子致香成分,对烟草的吸食品质起到积极作用[4];在卷烟燃吸过程中,烟草木质素热裂解生成酚类、醛类、稠环芳烃类等有害物质,引起涩口,对烟草的吸食品质有负面作用,此外这些物质还具有促癌或致癌活性,影响烟草制品的吸食安全性[5-6]。深入研究烟草木质素的化学结构及含量,可为提高烟草制品的吸食品质和安全性提供理论和技术指导。
目前,表征木质素结构的方法包括湿化学法和仪器分析法。湿化学法是通过硫代酸解(TA)、硝基苯氧化(NBO)或衍生化后还原裂解(DFRC)等手段将木质素降解为低分子量化合物,然后经过酯化、乙酰化处理后采用色谱技术进行定性或定量分析[7-9],通过解释降解过程的数据实现了对木质素大分子组成和结构的初步了解,但其得出的降解过程数据仅占总聚合物的一部分。仪器分析法包括紫外光谱法、红外光谱法、核磁共振波谱法等,其中紫外光谱法、红外光谱法提供的结构信息有限,核磁共振技术包括1H NMR、13C NMR、二维核磁共振波谱等,然而常规的一维1H NMR信号重叠,13C NMR灵敏度低,无法对各个信号进行详细的归属和定量,限制了其应用[10-12]。随着核磁共振技术的发展,二维核磁共振波谱提高了图谱分辨率,减少了信号之间的重叠,可获得更详细的信号归属,包括同核位移相关谱(Correlation Spectroscopy)、异核位移相关谱(Heteronuclear Multiple Quantum Coherence 、Heteronuclear Multiple-Bond Correlation、Heteronuclear Single Quantum Coherence)和NOE类相关谱(Nuclear Overhauser Effect Spectroscopy、Rotating Frame Overhauser Effect Spectroscopy),其中二维异核单量子相干谱(Two-dimentional Heteronuclear Single Quantum Coherence,2D HSQC)多用于木质素样品的分析检测。 2D HSQC NMR是将官能团上直接相连的碳核和氢核的峰组关联起来,通过获取氢核数据从而大大提高波谱的分辨率,其灵敏度比传统的13C NMR提高了30多倍[13]。近年来,以球磨植物细胞壁直接溶胀在核磁共振溶剂中的溶液态2D HSQC NMR成为研究木本类木质素原始结构的主要方法。Ralph等使用2D HSQC NMR先后分析乙酰化木质素及高度球磨后松树、杨树的全植物细胞壁,得到了这些物质的具有较高分辨率的二维核磁共振谱图[14-17]。Ragauskas等改进了溶剂体系,以DMSO-d6/HMPA-d18(4:1 v/v)为溶剂用于杨树等植物细胞壁溶胀,在一定程度上提高了生物质样品的溶胀度和迁移率,增强了核磁共振的信号[18]。溶液态2D HSQC NMR具有分辨率高、样品处理简单和不破坏植物的原始结构的特点,它除了在定性表征方面有绝对的优势,还可进行定量分析[13,19]。最常用的是2D HSQC NMR的半定量分析法,通过分别对波谱的不同区域进行体积积分估算其所占比例[20]。2D HSQC NMR已广泛应用于松树、杨树和多年生芒草等生物质的结构表征[21],但由于行业核磁共振仪器尚不普及,导致烟草木质素结构的二维核磁共振研究鲜有报道。
本文通过优化溶剂种类和样品前处理技术,建立了表征烟草木质素的2D HSQC NMR方法,实现对烟草木质素基本单元及单元间连接键信号的定性归属和定量分析,提出烟叶木质素分子的结构示意图。为提高烟草制品的吸食品质和安全性提供重要的基础支撑。
1 材料与方法
1.1 材料、试剂和仪器
实验样品为烤烟(B2F、C2F、X2F,湖北恩施,2019年)、白肋烟(C2F,湖北恩施,2019年)、香料烟(B2,云南保山,2016年)、梗丝、烟草薄片(由江西中烟工业有限责任公司提供)。烟叶样品均除去茎脉,全部实验样品在50℃下烘干2 h后进行机械粉碎,过40目筛,密封储存以备用。
松柏醇(标准品,>98%,上海阿拉丁生化科技股份有限公司);脱碱木质素(95%,北京沃凯生物科技有限公司,CAS号9005-53-2);氘代吡啶(Pyridine-d5,D,99.5%)、氘代二甲基亚砜(DMSO-d6,D,99.9%)、氘代六甲基磷酰三胺(HMPA-d18,D,99.6%)(上海麦克林生化科技有限公司);纤维素分解酶Cellic® Ctec2(100 FPU/mL,Sigma-Aldrich公司);甲苯、乙醇、冰醋酸、醋酸钠、盐酸、氢氧化钠(AR,国药集团化学试剂有限公司);实验用水为二次蒸馏水。
Bruker Avance Ⅲ 600 MHz超导核磁共振谱仪配备5 mm带Z梯度场线圈1H/13C/15N三共振反式超低温探头(德国Bruker公司)、DECO-PBM-V-0.4L球磨机配备4个100 mL玛瑙球磨罐(长沙市德科仪器设备有限公司)、XW-80A漩涡振荡器(上海晖创化学仪器有限公司)、FD-2D-80真空冷冻干燥机(上海舜制仪器制造有限公司)、DF-101S恒温加热磁力搅拌器(巩义市予华仪器有限责任公司)、S7500超声仪(上海必能信超声有限公司)、TDL-5-A离心机(上海安亭科学仪器厂)、THZ-92B数显气浴恒温振荡器(常州市金坛科兴仪器厂)、JA2003电子天平(感量0.001 g,上海舜宇恒平科学仪器有限公司)。
1.2 方法
1.2.1 全植物细胞壁样品的制备
取10 g烟草样品,用甲苯-乙醇混合溶液(2:1 v/v)索氏提取预粉碎的样品8 h,风干然后置于60℃的烘箱内烘干,得到去脂样品。取去脂样品1 g,置于100 mL球磨罐中球磨6 h,球磨机工作环境为室温,转速设置为600 r/min,为防止球磨过程中植物粉末温度过度升高,球磨机每工作20 min后休息10 min,得到全植物细胞壁样品(WCW),密封保存,以备分析。
1.2.2 木质素的提取及纯化
1.2.2.1 酸洗-酶解法提取
采用烟草行业标准YC/T 347—2010[22]中酸性洗涤方案对10 g烟草样品进行预处理,以去除半纤维素等成分。将获得的酸性洗涤纤维置于250 mL锥形瓶中,加入pH 4.8的醋酸-醋酸钠缓冲溶液和纤维素分解酶。50℃下,在空气浴摇床中孵育48 h后,离心除去上清液,用乙酸缓冲液和二次蒸馏水洗涤3次,冷冻干燥后得到酸洗-酶解木质素(AEL),密封保存以备分析。
1.2.2.2 碱溶法提取
参考文献[23-24]的方法对烟草样品进行碱溶法提取。取10 g去脂烟草样品,置于500 mL烧瓶中,加入200 mL 0.5 mol/L的NaOH溶液,将烧瓶置于恒温水浴锅在100℃下反应4 h,离心,过滤,用双蒸水洗涤,收集滤液,用6 mol/L HCl调节溶液pH 5.5~6.0,然后用旋转蒸发仪浓缩至约50 mL,将滤液滴入3倍体积的95%的乙醇溶液中进行纯化,离心收集上清液,再次减压浓缩,将浓缩液滴入10倍体积pH 2的盐酸溶液中,析出碱提木质素沉淀(AL),冷冻干燥后保存,以备分析。
1.2.3 核磁共振样品的制备
称取一定量的实验样品,转移到5 mm核磁共振管中,样品尽可能从试管底部和侧面向上分布。加入0.5 mL核磁共振溶剂,旋涡振荡5~15 min,超声1~3 h(取决于样品),使样品溶解或溶胀在溶剂体系中。
1.2.4 核磁共振分析
核磁共振谱是在600 MHz Bruker Avance Ⅲ超导核磁共振谱仪上获得的,仪器配备超低温探头,在298 K下,采用标准布鲁克脉冲序列(invietgssi)实现。具体参数如下:F2(1H)维度的谱宽为11 ppm,采样点为1024 (TD1);F1(13C)维度的谱宽为170 ppm,采样点为256(TD2);扫描次数(NS)为64;扫描延迟(D1)1 s。使用DMSO-d6溶剂中心峰(δC/δH= 39.52/2.50 ppm)进行化学位移校准,并使用MestReNova 6.1软件对HSQC谱中的特征峰进行数据处理。
2 结果与讨论
2.1 烟草木质素2D HSQC NMR定性分析
2.1.1 2D HSQC NMR溶剂体系的优化
2D HSQC NMR的溶剂应具备对待测样品有良好溶解度且不破坏样品的天然结构和连接的特点,并且得到的样品溶液应具有较小的粘度,以获得较长的T2弛豫时间。同时,为了进行较为准确的半定量研究,应基于在波谱区域中获得较高的信号强度和信号分散来选择溶剂。目前,用于木质素2D HSQC NMR分析的溶剂体系有DMSO-d6、DMSO-d6/Pyridine-d5(4:1 v/v)、DMSO-d6/HMPA-d18(4:1 v/v)、DMSO/四丁基氟化铵(TBAF)、DMSO/氮甲基咪唑(NMI)[14-16,18]。但是,DMSO/TBAF、DMSO/NMI溶剂体系需要对样品进行乙酰化实验,从而导致部分信息丢失[15]。因此,我们选择DMSO-d6、DMSO-d6/Pyridine-d5(4:1 v/v)、DMSO-d6/HMPA-d18(4:1 v/v)3种溶剂体系,来探讨溶剂对木质素二维核磁共振谱图的影响。将50 mg脱碱木质素分别溶解在0.5 mL以上3种溶剂体系中进行2D HSQC NMR分析。脱碱木质素在以上3种溶剂中的溶解和流动性状况如图1所示,脱碱木质素在以上3种溶剂体系中均可完全溶解,且呈棕褐色溶液。与DMSO-d6和DMSO-d6/Pyridine-d5相比,脱碱木质素在DMSO-d6/HMPA-d18溶液流动性更好,粘度更低,有利于提高信号分辨率,获得更高质量的二维HSQC NMR谱图。这是因为HMPA的P=O键高度极化,氧原子带强负电荷,作为一种强极性非质子溶剂,HMPA-d18的加入可能会产生溶剂化效应,增加样品溶液的流动性[18]。

注:(a)DMSO-d6, (b)DMSO-d6/Pyridine-d5, (c)DMSO-d6/HMPA-d18。
脱碱木质素在DMSO-d6、DMSO-d6/Pyridine-d5(4:1 v/v)和DMSO-d6/HMPA-d18(4:1 v/v)中的2D HSQC NMR谱图如图2所示,木质素的二维谱图可分为2个区域:木质素边链区(δH2.5-6.0 ppm, δC50-90 ppm)和芳香区(δH6.0-8.0 ppm, δC100-150 ppm)。图3是木质素边链区和芳香区的局部放大图,由图3可知,木质素边链区由不同类型的木质素连接键组成,包括β-芳基醚单元β-O-4(A),苯基香豆素单元β-5(B),树脂醇单元β-β(C);芳香区有紫丁香基单元(S)、愈创木基单元(G)、对羟基苯基单元(H)、阿魏酸盐(FA)和肉桂醇端基(XI)信号出现,这些基本单元及单元间连接键的信号依据文献报道的化学位移[16,18]进行归属,定性表征结果见表1。由表1可知,在DMSO-d6溶剂中A-Sβ、Bβ、Cβ等信号均不能被检测到,在DMSO-d6/Pyridine-d5溶剂中Bβ、Cβ等信号不能被检测到,而在DMSO-d6/HMPA-d18(4:1 v/v)混合溶剂中脱碱木质素主要的特征峰信号均可被检测到。与其它2种溶剂相比,在DMSO-d6/HMPA-d18溶剂中木质素芳香区中S'2/6、G6、FA6相关的峰较为分散,对羟基苯基H2,6的信号峰强度较高。综上,DMSO-d6/HMPA-d18溶剂中得到的木质素的相关信号最丰富并且分散,所以本研究优选DMSO-d6/HMPA- d18作为木质素的最佳NMR分析溶剂。
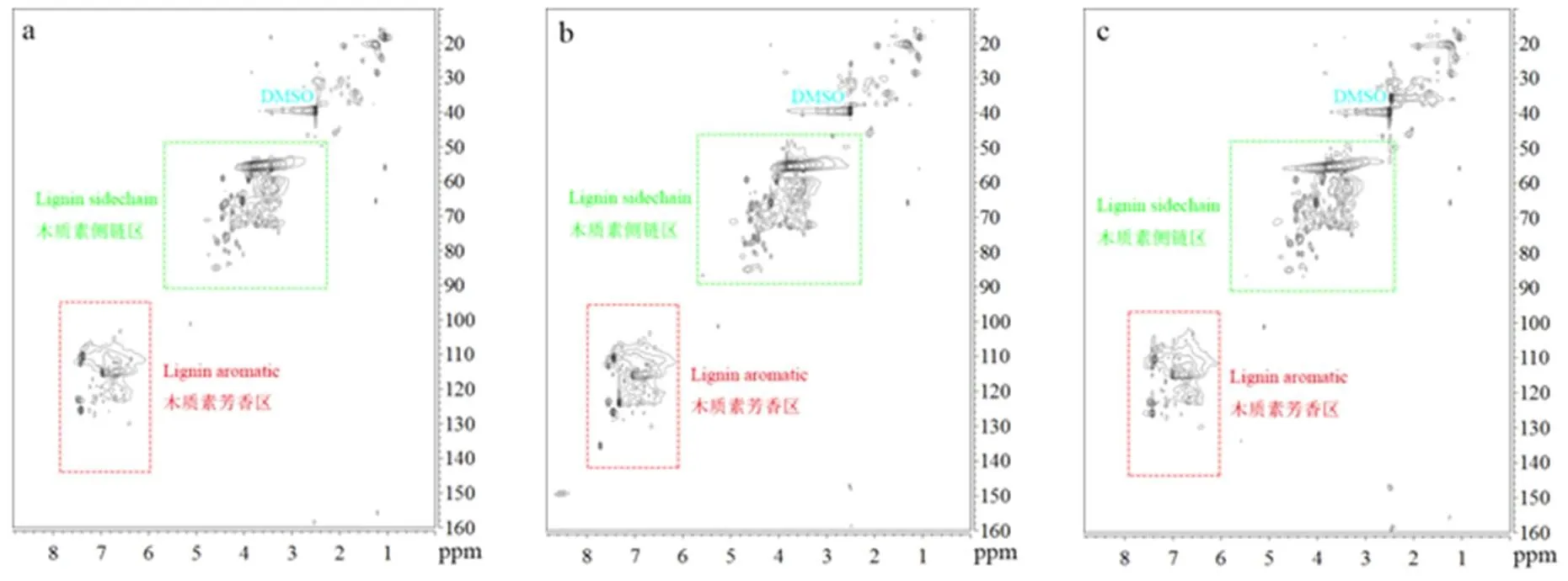
注:(a)DMSO-d6, (b)DMSO-d6/Pyridine-d5, (c)DMSO-d6/HMPA-d18。

注:(a)DMSO-d6, (b)DMSO-d6/Pyridine-d5, (c)DMSO-d6/HMPA-d18。
表1 不同溶剂中木质素样品主要单元的2D HSQC NMR谱图信号归属

Tab.1 Assignments of main cross-peaks in 2D HSQC NMR spectra of lignin in different solvents
2.1.2 烟草木质素的2D HSQC NMR结构表征
在DMSO-d6/HMPA-d18溶剂中,对烤烟中部烟叶的碱提木质素(AL)进行2D HSQC NMR分析,共检测出27种木质素基本单元及单元间连接键结构的信号,见图4,对图4中特征峰信号进行归属得到表1定性表征结果。如图4所示,烟草木质素二维谱图的边链区同脱碱木质素边链区类似,有β-芳基醚单元β-O-4(A),苯基香豆素单元β-5(B),树脂醇单元β-β(C),二苯并二噁英单元5-5/β-O-4(D)和甲氧基信号的出现。木质素单元间连接键中最突出的信号对应于β-O-4(A)连接的芳基之间的醚键和树脂醇单元β-β(C)连接的芳基之间的C-C键。在这几种木质素单元间连接键中,首先,β-O-4(A)的13Cα-1Hα相关性显示两个重叠的信号,这可以解释为在烟叶木质素的β-O-4(A)结构包含至少2个不同的变体。变体可能包括在Aα(G/H),Aα(S)的γ-C上有一个游离羟基的β-O-4'(A′);在 γ-C为酯化形成对羟基苯甲酸酯结构的β-O-4''(A'')。特别是,在δC/δH63.34/3.96 ppm处可明显观察到γ-乙酰化的β-O-4的信号。其次,应位于δC/δH53.14/3.82 ppm处的苯基香豆素单元β-5(B)的Cβ-Hβ与甲氧基基团的信号重叠,而树脂醇单元β-β(C)的Cβ-Hβ信号与甲氧基基团的信号则能够良好分离,位于53.50/3.04 ppm处。最后,在δC/δH83.45/5.01 ppm处出现痕量的二苯并二噁英单元5-5/β-O-4(Dα)信号峰,并且与β-O-4(A),β-5(B),β-β(C)等木质素间连接键的α位13C-1H相关信号峰分离,有利于进行较为准确的定量分析。
在烟草木质素芳香区(图4b)中,可清晰检测到紫丁香基(S)、愈创木基(G)和对羟基苯基(H)芳香环的结构信号。S型单元的C2,6-H2,6相关峰主要在δC/δH103.21/6.64 ppm,而Cα被氧化的结构S′在δC/δH107.66/7.27 ppm位置显示一个相对较弱的信号。G型单元的C5-H5和C6-H6相关峰分别在δC/δH115.04/6.88 ppm和117.59/6.93 ppm位置被观察到,而G型单元被氧化成α-酮的C2-H2和C6-H6相关峰分别位于δC/δH111.17/7.48 ppm和122.52/7.48 ppm。在δC/δH127.70/7.20 ppm处H单元的C2,6-H2,6相关峰与在δC/δH128. 80/7.23 ppm苯丙氨酸的相关峰有重叠,这会导致H单元的含量被高估,这与Wang等相关研究一致[25]。此外,在δC/δH110.85/7.29 ppm和123.30/7.14 ppm处清楚地检测到阿魏酸酯FA的C2-H2和C6-H6相关峰,表明该单元存在于烟叶木质素中。据报道,阿魏酸酯在草本植物中通过酯键和醚键与半纤维素形成木质素-碳水化合物复合物(LCC)[26]。通过以上对烟草木质素的定性分析可知,2D HSQC NMR分辨率良好,适合烟草木质素的表征。
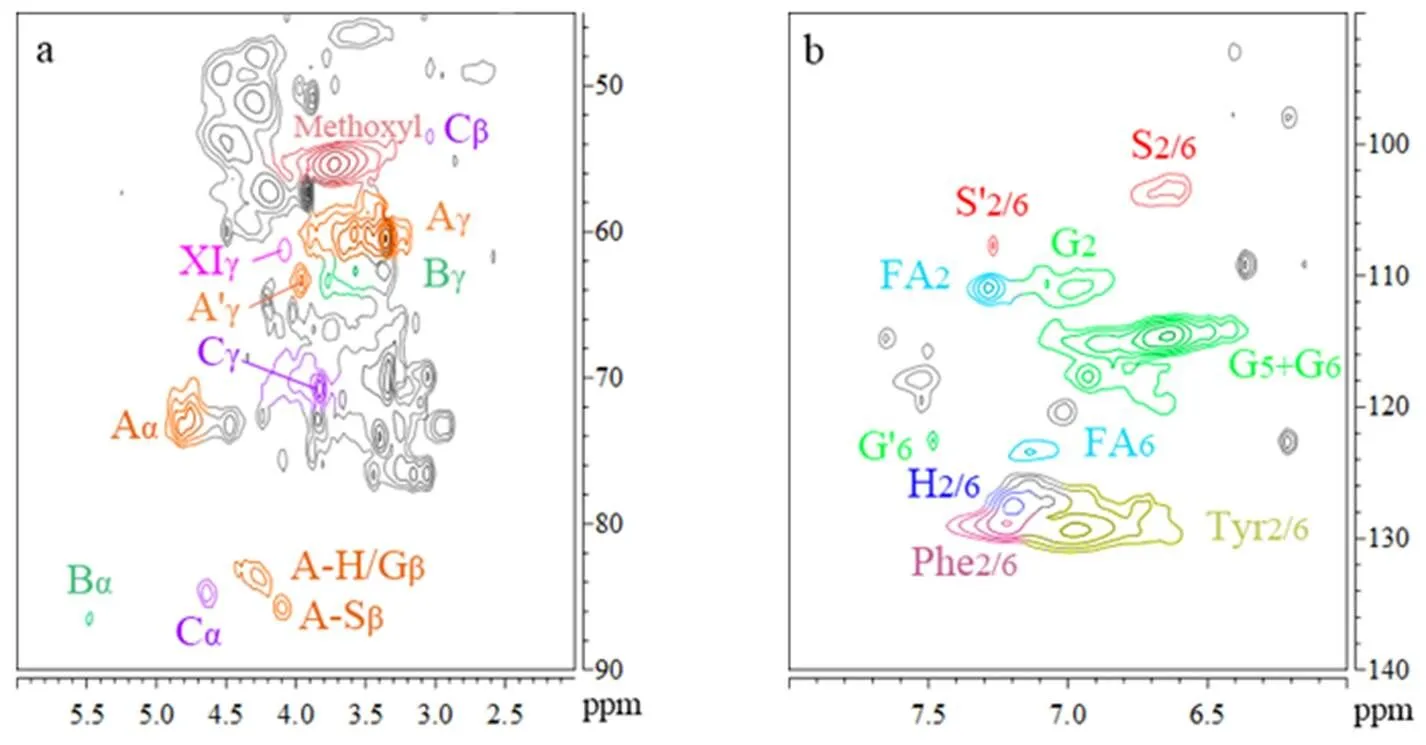
注:(a)边链区,(b)芳香区,(c)木质素组分的分子结构。
Note:(a) Side-chain region, (b) Aromatic region, (c) Molecular structures of lignin components.
图4 DMSO-d6/HMPA-d18溶剂中烤烟中部烟叶碱提木质素的2D HSQC NMR谱图
Fig.4 2D HSQC NMR spectra of alkali-lignin from middle leafs of flue-cured tobacco in DMSO-d6/HMPA-d18
2.1.3 松柏醇的2D HSQC NMR分析
松柏醇是愈创木基(G)型木质素的单体,其化学结构如图5a所示,松柏醇的二维核磁谱图特征峰数量少,峰形简单,易于分辨,因此本文选择松柏醇对2D HSQC NMR方法进行验证。将50 mg松柏醇样品分别溶于DMSO-d6和DMSO-d6/HMPA-d18中,通过涡旋振荡、超声等手段,使样品溶解在溶剂中后进行2D HSQC NMR分析。
松柏醇在两种溶剂中的二维核磁共振谱图见图5,相关峰的化学位移归属见表2。由表2知,在DMSO-d6中松柏醇的化学位移与文献[18]相比高度一致;在DMSO-d6和DMSO-d6/HMPA-d18两种溶剂体系中,松柏醇特征峰的化学位移差值均小于0.2 ppm,因此DMSO-d6/HMPA-d18作为核磁共振溶剂对木质素组分的化学位移没有影响。此外,HMPA-d18溶剂峰的信号位于35.53/2.47 ppm处,不干扰木质素组分共振峰的定性定量分析。为了确定日间精密度,在同一参数下连续3 d对溶于DMSO-d6/HMPA-d18溶剂中的松柏醇进行2D HSQC NMR检测,通过比较同一样品的多次波谱采集结果确定精密度。结果表明,松柏醇特征峰的化学位移偏差均小于0.1 ppm,特征峰化学位移δC/δH的相对标准偏差(RSD)均小于0.2%。说明在DMSO-d6/HMPA-d18溶剂体系内进行2D HSQC NMR实验的精密度较好,可以实现样品的准确定性表征。

注:(a)DMSO-d6, (b)DMSO-d6/HMPA-d18。
表2 松柏醇在不同溶剂中的2D HSQC NMR谱图信号归属
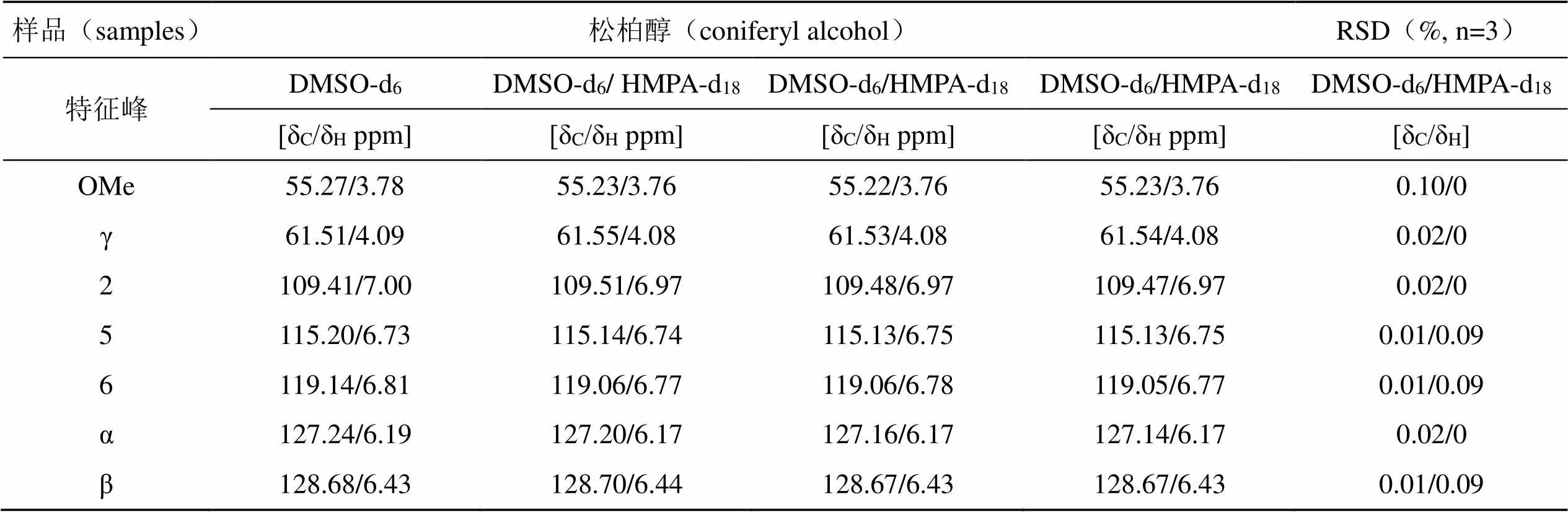
Tab.2 Assignments of main cross-peaks in 2D HSQC NMR spectra of coniferyl alcohol in different solvents
2.2 烟草木质素2D HSQC NMR定量分析
2.2.1 不同含量脱碱木质素的2D HSQC NMR定量分析
通过2D HSQC NMR对木质素的主要基本单元和单元间连接键进行定量分析,可以更好地了解木质素片段的基本化学结构。然而,2D HSQC NMR由于1H-13C耦合常数的偏差、非共振效应、1H T1弛豫效应、1H和13C T2弛豫效应以及1H同核耦合效应[1],难以实现准确定量,目前主要以半定量分析为主。2D HSQC NMR的半定量分析是在同一水平下比较木质素基本单元和单元间连接键的体积积分来实现相对定量。Cheng等用木质素基本单元的相对体积积分之和表示样品中木质素的相对含量,具体计算如公式1所示[21]。木质素基本单元的相对含量是每种木质素基本单元的体积积分占总木质素基本单元体积积分之和的比例,如公式2所示。单元间连接键的相对含量则是每种单元间连接键的体积积分占总单元连接键体积积分的比例,如公式3所示[13,21]。

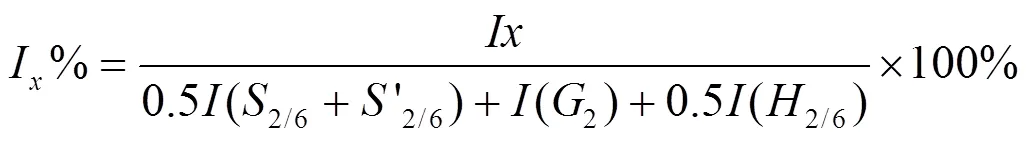

其中,(2/6+'2/6),(2+6),(2/6),(2+6),(2/6)分别代表S和S',G,H,FA,PB在2、6位的体积积分之和;,,,分别代表 β-O-4,β-5,β-β,5-5/β-O-4在α位的体积积分;I,I分别代表待测木质素基本单元和单元间连接键的体积积分;令木质素基本单元S、G、H的相对含量之和为100%,即[0.5 (2/6+2/6)]%+(2)%+[0.5(2/6)]%=100%;木质素基本单元间连接键A、B、C、D的相对含量之和为100%,即%+%+%+%=100%。
为了获得高分辨、高灵敏度的二维核磁共振谱图,不仅需提高核磁共振仪器的分辨率,还要求核磁共振样品中木质素含量足够高。为探讨木质素核磁共振样品中木质素的量对2D HSQC NMR分析结果的影响,实验设置了2.5 mg、5 mg、10 mg、15 mg四种不同含量的脱碱木质素溶液(0.5 mL DMSO-d6/HMPA-d18,v/v 4:1)进行2D HSQC NMR分析,谱图如图6所示,对图6中信号归属结果见表3。由图6可知,随着木质素含量的增大,谱图中信号越来越丰富。以溶剂DMSO-d6中甲基的C-H相关峰(δC/δH39.52/2.50 ppm)作为参考,把其体积积分设为100,即设I(DMSO-d6)=100,将木质素基本单元的体积积分与之比较,得到各个脱碱木质素基本单元的相对体积积分,再代入公式1计算,得到不同含量脱碱木质素的相对体积积分,结果如图7所示,随着脱碱木质素含量增大,可检出的脱碱木质素芳香区的相对体积积分也随之增大。结合表3,对不同含量脱碱木质素2D HSQC NMR谱图信号归属,可知当木质素含量在2.5 mg时,可检测到11种木质素特征峰信号;木质素含量在5 mg时,可检测到19种木质素特征峰信号;木质素含量在10 mg以上时,可检测到所有主要的特征峰信号。研究表明,只有核磁共振样品中木质素含量在10 mg以上,即计算所得木质素的相对含量在21.83以上时,才能够得到清晰分辨的高灵敏二维核磁共振谱图。

注:(a)2.5 mg, (b) 5 mg, (c)10 mg, (d)15 mg。
表3 不同含量脱碱木质素在DMSO-d6/HMPA-d18溶剂中的2D HSQC NMR信号归属
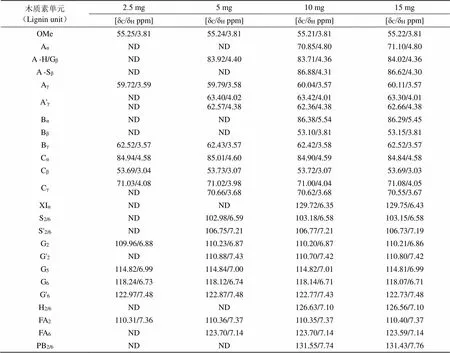
Tab.3 Assignments of 2D HSQC NMR spectra of different contents of dealkaline lignin in DMSO-d6/HMPA-d18
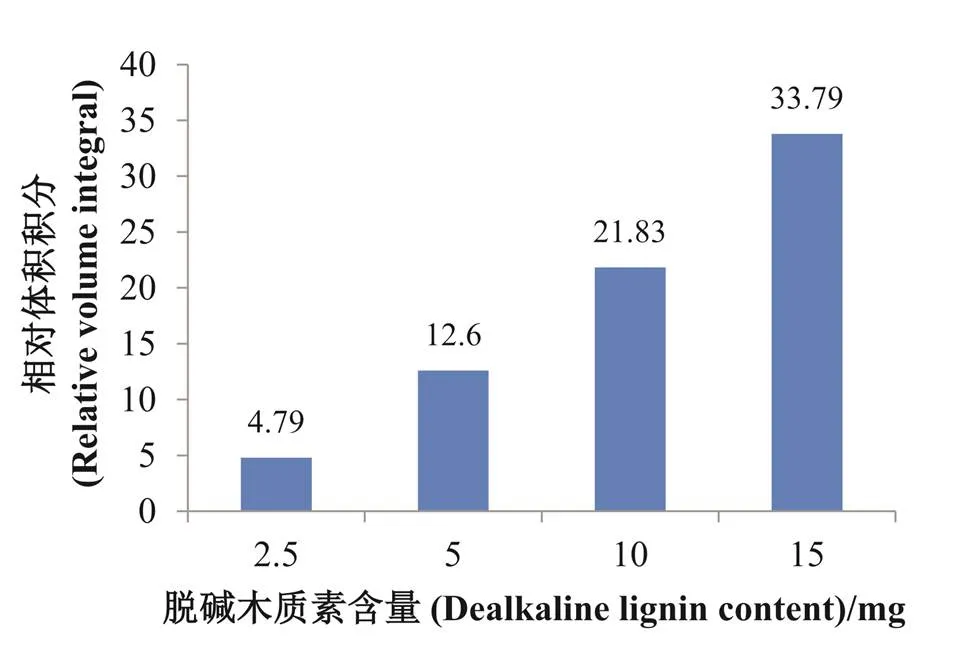
图7 不同含量脱碱木质素的相对体积积分
2.2.2 烟草木质素的2D HSQC NMR定量分析
王婉婉等[27]对杨树、松树等木本类作物的全植物细胞壁溶液态二维核磁共振进行研究,得到了分辨率良好的二维谱图。但杨树、松树的木质素含量约在25%~30%,而烟叶中木质素含量约在3.5%~7.5%之间[28],因此,要得到清晰烟草木质素的二维核磁共振谱图,需要对烟草样品进行预处理,以提高烟草核磁共振样品木质素的相对含量。通常,植物样品中木质素分离的预处理方法分为4类,有机溶剂提取法、酶解法、酸析法和碱溶法[24,29-30]。有机溶剂提取法是通过降解半纤维素和木质素间交联的酯键,使木质素溶解,再重结晶于酸性水溶液中来分离木质素。但由于有机溶剂提取法具有提取率低、成本高等特点而不适合烟草木质素的提取。酶解法则是通过特定的蛋白酶降解纤维素和半纤维素等物质,木质素留在固体中,该方法具有特异性高、生物友好等特点,但是过程速度慢、耗时长,且可能会引入蛋白质杂质。酸析法是在酸性条件下使纤维素和半纤维素等干扰成分发生水解,木质素留在固体中。但是,浓酸条件下木质素芳基醚键发生了严重的断裂。通常也可采用酸性洗涤剂法[22]与酶解法结合来分离木质素,但是实验过程繁琐,需要多次洗涤,可能会产生操作误差。碱溶法是通过降解木质素与碳水化合物之间的键,使木质素溶出,该方法具有提取率高,成本低,实验易操作等特点。
因此,本研究选择仅进行去脂后的烟叶全植物细胞壁(WCW),酸洗-酶解木质素(AEL)以及使用碱溶法提取的碱提木质素(AL)这3种不同处理程度的样品各50 mg进行二维核磁共振实验,并对实验所得的谱图比较分析。通过公式1计算,得到不同预处理方式提取的烤烟中部烟叶木质素的相对含量,如图8所示,全植物细胞壁(WCW)木质素的相对含量为2.79,酸洗-酶解木质素(AEL)为5.95,与全植物细胞壁(WCW)相比,其木质素的相对含量稍有增加,但仍远小于21.83,得不到清晰可观的二维谱图,而碱提木质素(AL)的相对含量为37.51,所有相关的特征峰结构均可清晰展现。研究表明,使用碱溶法提取烟草木质素的预处理方式,对烟草木质素进行结构表征和半定量分析,可以获得更加全面且丰富的定性定量信息。
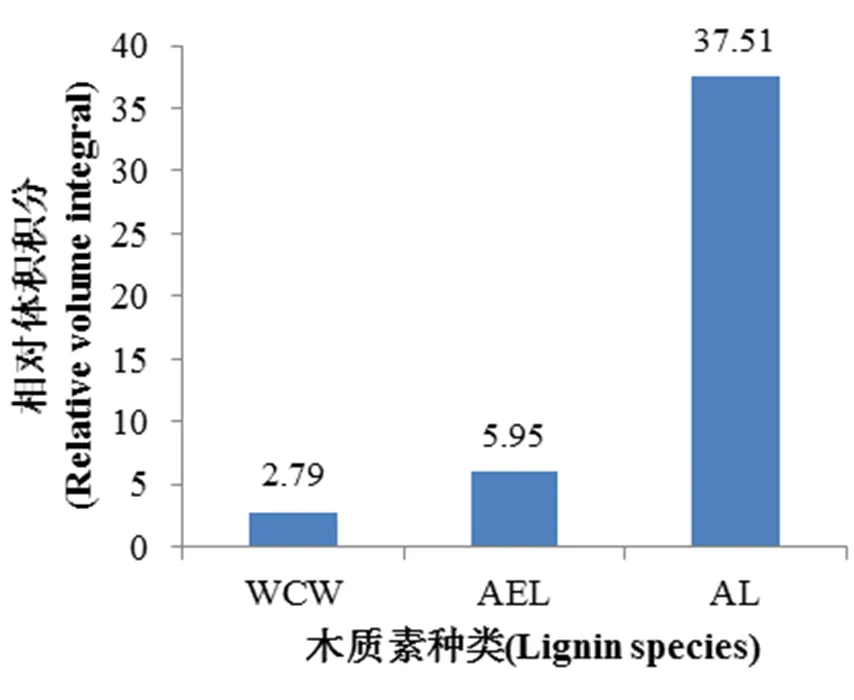
图8 不同预处理方式对烤烟中部烟叶木质素相对体积积分的影响
通过碱溶法提取烤烟中部烟叶获得了烟叶碱提木质素的二维核磁共振谱图,结合公式2、公式3计算木质素基本单元结构和木质素连接键的相对含量,结果如表4所示,烤烟中部烟叶木质素是SGH型木质素,且G型木质素单元含量最高(54.25%),S型木质素单元含量最低(17.96%),木质素化学稳定性重要指标S/G值[31]为0.33。与其它植物相比(杨树S/G值为1.5、玉米芯S/G值为1.0)[18,32],烟叶木质素的S/G值较低,这也与植物样品中木质素含量越低,其S型木质素单元含量越少,S/G值越小的规律是一致的[31]。此外,烤烟烟叶H型木质素单元含量比其它植物类型要高,这符合草本植物H型木质素单元含量较高的规律,如玉米芯(15.1%)、柳枝稷(13.4%)[18,32]。烤烟中部烟叶木质素的边链区,β-芳基醚单元β-O-4(A)是最主要的单元间的连接键,占木质素单元间连接键的91.36%,树脂醇单元β-β(C)是次丰富的,占木质素单元间连接键的5.65%。此外,烤烟中部烟叶木质素还含有丰富的阿魏酸酯FA(25.82%)和少量的对羟基苯甲酸酯PB(0.5%)。
表4 不同烟草木质素样品基本单元及单元间连接键的相对含量及S/G的比值

Tab.4 Relative content of lignin subunits and linkages and S/G ratio in different tobacco lignin samples
注:a. A:β-O-4; b.B:β-5;c.C:β-β; d.D:5-5/β-O-4; e.S/G=0.5I(S2/6+S'2/6)/I(G2+G'2)[33];木质素芳香区基本单元相对百分比(S+G+H=100%);木质素边链区结构单元相对百分比(A+B+C+D=100%);FA,PB占S+G+H的百分比。
Note:a.A:β-O-4;b.B:β-5;c.C:β-β; d.D:5-5/β-O-4; e.S/G=0.5I(S2/6+S'2/6)/I(G2+G'2)[33]; Lignin-Aromatic molar percentages (S+G+H=100%);Lignin-Aliphatic molar percentages(A+B+C+D=100%); FA,PB as percentages of (S+G+H).
2.3 不同样品中烟草木质素的2D HSQC NMR分析
通过优化溶剂和预处理手段,利用2D HSQC NMR方法对烤烟上中下部位烟叶、白肋烟叶、香料烟叶、梗丝和烟草薄片等实验样品中的木质素进行二维核磁共振波谱表征,分析发现木质素代表性的基团均在以上样品中出现,主要木质素结构单元及单元间连接键的定量分析结果如表4所示,所有实验样品均为SGH型木质素,愈创木基(G)是最主要的基本单元,且在这些样品中,β-芳基醚单元β-O-4(A)始终是最主要的木质素间连接键,其次是树脂醇单元β-β(C)。烤烟烟叶部位自上而下,S型木质素单元含量不断减少(26.51%~15.62%),G型和H型木质素单元含量不断增加(G:52.88%~55.58%;H:20.62%~28.81%),S/G比值不断减少(0.50~0.28),且G型木质素单元含量最高,这反映烟叶的生长发育过程中,G型木质素单元最先沉积[34]。不同品种的烟叶木质素单元之间的比例也不相同,中部烤烟、白肋烟和香料烟烟叶木质素中,S型木质素单元含量从低到高为烤烟<白肋烟<香料烟,G型木质素单元含量从低到高为香料烟<烤烟<白肋烟,且香料烟S/G比值最高(0.4)。梗丝与烟草薄片跟烟叶相比,其G型木质素单元含量偏高,均在70%左右,而H型木质素单元含量偏低,约在5%左右。在热解过程中β-芳基醚单元β-O-4(A)单元更容易断裂,而缩合的树脂醇单元β-β(C)不容易断裂,即β-O-4(A)单元含量越低、β-β(C)单元含量越高,样品的热稳定性越好[31]。梗丝和烟草薄片中β-O-4(A)单元在70%左右,显著低于烟叶中的含量,β-β(C)单元含量则明显增加到15%左右,揭示梗丝与烟草薄片样品比烟叶样品的热稳定性高。
通常,苯基香豆素单元β-5(B)只能通过木质素单体与愈创木基(G)或对羟基苯基(H)单元偶联制得,PB通过酰化连接到γ位置,同时FA通过醚键与木质素连接[16]。依据表4中木质素样品基本单元及单元间连接键的含量,参照文献[21,25]的方法,构建出烟叶木质素的网状结构。以烤烟中部烟叶为例,本研究首次描绘出烟叶木质素大分子的结构示意图(图9)。研究结果为研究烟草大分子结构与热解性能的关系提供坚实的理论基础。
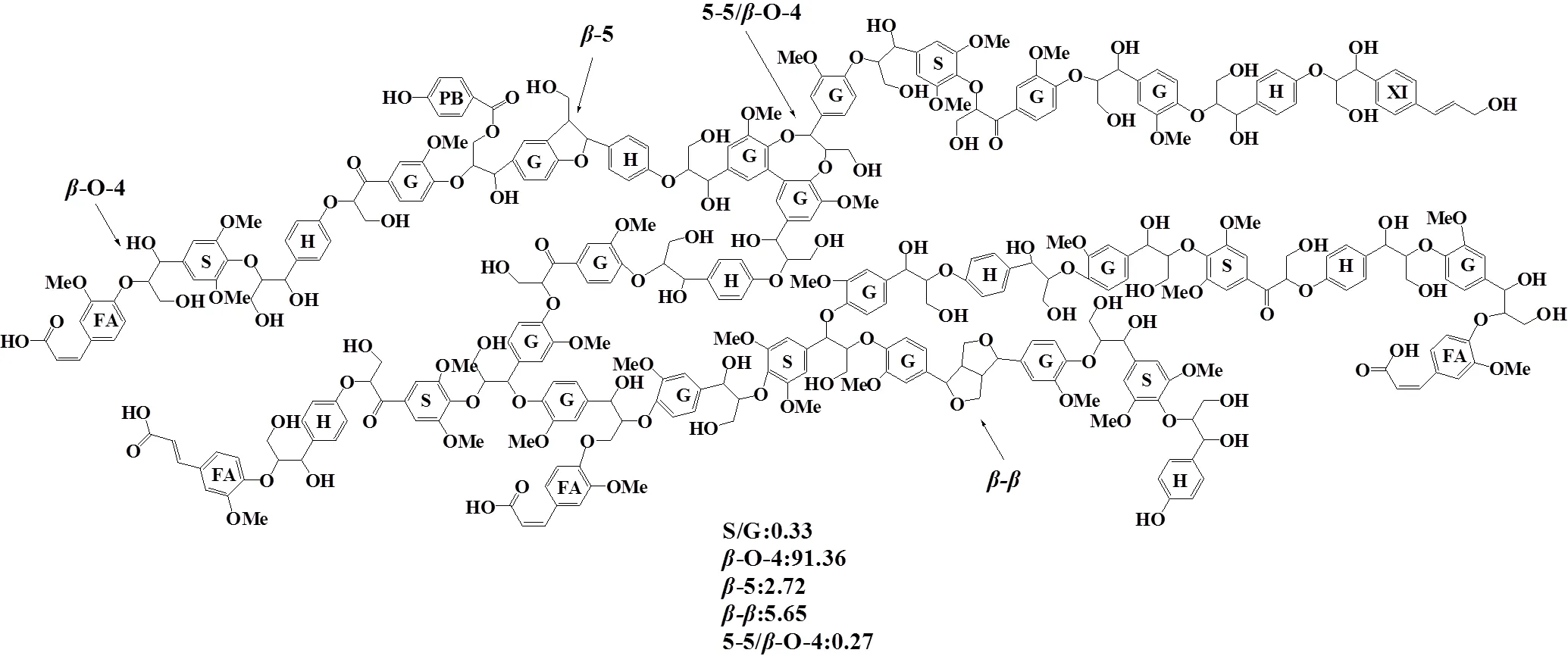
图9 烤烟中部烟叶木质素结构示意图
3 结论
本研究通过优化溶剂与预处理手段,建立了一种烟草木质素二维核磁共振波谱分析新方法,实现了烟草中木质素结构表征和半定量分析,通过对二维谱图中木质素单元信号峰归属,结合木质素单元及其连接键的相对含量,成功获得了烟叶木质素分子的结构示意图。将本方法应用于烟叶、梗丝和烟草薄片等实验样品的分析,结果表明:烟草木质素为SGH型木质素,β-芳基醚单元A(β-O-4)始终是最主要的木质素间连接键,其次是树脂醇单元C(β-β)。与其它植物样品相比,烟叶中的紫丁香基(S)单元的含量较低,对羟基苯基(H)单元的含量较高,S/G值较小。烤烟烟叶部位自上而下,紫丁香基(S)单元的含量逐渐减少,愈创木基(G)和对羟基苯基(H)单元的含量逐渐增加。梗丝和烟草薄片与烟叶相比,愈创木基(G)单元的含量较高,对羟基苯基(H)单元的含量较低,同时β-芳基醚单元A(β-O-4)的含量较低,树脂醇单元C(β-β)的含量较高,表现为较高的热稳定性。因此,本研究可为烟草制品吸食品质与安全性和其内在生物大分子的关系研究提供一定的理论基础。
[1] Foston M, Samuel R, He J, et al. A review of whole cell wall NMR by the direct-dissolution of biomass[J]. Green Chemistry, 2016, 18(3): 608-621.
[2] Sun R C. Lignin source and structural characterization[J]. ChemSusChem, 2020, 13(17): 4385-4393.
[3] 臧亚楠,孔宁川,李地艳,等. 烟草木质素的研究概况[J]. 云南农业大学学报(自然科学),2015, 30(5): 822-828.
ZANG Yanan, KONG Ningchuan, LI Diyan, et al. Advanced researcheson lignin of tobacco. Journal of Yunnan Agricultural University, 2015, 30(5): 822-828.
[4] 葛畅,吴丽洒,赵晓梅,等. 溶剂萃取-GC/MS法测定梗丝与叶丝中的致香成分[J]. 广东化工,2020, 47(4): 178-180, 197.
GE Chang, WU Lisa, ZHAO Xiaomei, et al. Solvent extraction -GC/MS method was used to determine the aromatic components in stem and leaf filaments[J]. Guangdong Chemical Industry, 2020, 47(4): 178-180, 197.
[5] 刘刚,杨飞,杜云海,等. 木质素对再造烟叶烟气中苯酚的影响[J]. 光谱实验室,2012, 29(2): 1118-1122.
LIU Gang, YANG Fei, DU Yunhai, et al. Effect of lignin on phenol in mainstream smoke of reconstituted tobacco[J].Chinese Journal of Spectroscopy Laboratory, 2012, 29(2): 1118-1122.
[6] 高娅北,孙曙光,王胜雷,等. 烤烟成熟期烟叶木质素合成关键酶基因的转录分析[J]. 中国烟草学报,2019, 25(3): 43-51.
GAO Yabei, SUN Shuguang, WANG Shenglei, et al. Transcriptional analysis of key Enzymes in lignin synthesis from flue-cured tobacco leaves[J]. Acta Tabacaria Sinica, 2019, 25(3): 43-51.
[7] Zheng M, Gu S, Chen J, et al. Development and validation of a sensitive UPLC–MS/MS instrumentation and alkaline nitrobenzene oxidation method for the determination of lignin monomers in wheat straw[J]. Journal of Chromatography B, 2017, 1055: 178-184.
[8] Lu F, Ralph J. Derivatization followed by reductive cleavage (DFRC method), a new method for lignin analysis: protocol for analysis of DFRC monomers[J]. Journal of Agricultural and Food Chemistry, 1997, 45(7): 2590-2592.
[9] Yamamura M, Hattori T, Suzuki S, et al. Microscale thioacidolysis method for the rapid analysis of beta-O-4 substructures in lignin[J]. Plant Biotechnology, 2012, 29(4): 419-423.
[10] Janshekar H, Brown C, Fiechter A. Determination of biodegraded lignin by ultraviolet spectrophotometry[J]. Analytica Chimica Acta, 1981, 130(1): 81-91.
[11] Gilarranz M A, Rodríguez F, Oliet M, et al. Phenolic OH group estimation by FTIR and UV spectroscopy. Application to organosolv lignins[J]. Journal of Wood Chemistry and Technology, 2001, 21(4): 387-395.
[12] Choi J W, Faix O. NMR study on residual lignins isolated from chemical pulps of beech wood by enzymatic hydrolysis[J]. Journal of Industrial and Engineering Chemistry, 2011, 17(1): 25-28.
[13] Wen J L, Sun S L, Xue B L, et al. Recent advances in characterization of lignin polymer by solution-state nuclear magnetic resonance (NMR) methodology[J]. Materials, 2013, 6(1): 359-391.
[14] Lu F, Ralph J. Non-degradative dissolution and acetylation of ball-milled plant cell walls: high-resolution solution-state NMR[J]. The Plant Journal, 2003, 35(4): 535-544.
[15] Kim H, Ralph J, Akiyama T. Solution-state 2D NMR of ball-milled plant cell wall gels in DMSO-d6[J]. Bioenergy Research, 2008, 1(1): 56-66.
[16] Kim H, Ralph J. Solution-state 2D NMR of ball-milled plant cell wall gels in DMSO-d6/pyridine-d5[J]. Organic & Biomolecular Chemistry, 2010, 8(3): 576-591.
[17] Yelle D J, Ralph J, Frihart C R. Characterization of nonderivatized plant cell walls using high-resolution solution-state NMR spectroscopy[J]. Magnetic Resonance in Chemistry, 2008, 46(6): 508-517.
[18] Yoo C G, Pu Y, Li M, et al. Elucidating structural characteristics of biomass using solution-state 2 D NMR with a mixture of deuterated dimethylsulfoxide and hexamethylphosphoramide[J]. ChemSusChem, 2016, 9(10): 1090-1095.
[19] 文甲龙,陈天影,孙润仓. 生物质木质素分离和结构研究方法进展[J]. 林业工程学报,2017, 2(05): 76-84.
WEN Jialong, CHEN Tianying, SUN Runcang, Lignin separation and structure of biomass [J]. Journal of Forestry Engineering, 2017, 2(05): 76-84.
[20] Trubetskaya A, Lange H, Wittgens B, et al. Structural and thermal characterization of novel organosolv lignins from wood and herbaceous sources[J]. Processes, 2020, 8(7).
[21] Cheng K, Sorek H, Zimmermann H, et al. Solution-state 2D NMR spectroscopy of plant cell walls enabled by a dimethylsulfoxide- d6/1-ethyl-3-methylimidazolium acetate solvent[J]. Analytical Chemistry, 2013, 85(6): 3213-3221.
[22] YC/T347—2010. 烟草及烟草制品中性洗涤纤维, 酸性洗涤纤维, 酸洗木质素的测定洗涤剂法[S].
YC/T347-2010. Determination of neutral detergent fiber, acid detergent fiber and acid pickling lignin in tobacco and tobacco products by detergent method[S].
[23] 李云雁,刘锋,宋光森,等. 碱法分离板栗壳木质素的研究[J]. 湖北农业科学,2006(6): 817-819.
LI Yunyan, LIU Feng, SONG Guangsen, et al. Separation of lignin from Chestnut shell by alkali method [J]. Hubei Agricultural Sciences, 2006(06): 817-819.
[24] Sun D, Wang B, Wang H-M, et al. Structural elucidation of tobacco stalk lignin isolated by different integrated processes[J]. Industrial Crops and Products, 2019, 140: 111631.
[25] Wang H M, Ma C Y, Li H Y, et al. Structural variations of lignin macromolecules from early growth stages of poplar cell walls[J]. ACS Sustainable Chemistry & Engineering, 2019, 8(4): 1813- 1822.
[26] Reinoso F A, Rencoret J, Gutiérrez A, et al. Fate of p-hydroxycinnamates and structural characteristics of residual hemicelluloses and lignin during alkaline-sulfite chemithermome- chanical pretreatment of sugarcane bagasse[J]. Biotechnology for Biofuels, 2018, 11(1): 1-12.
[27] 王婉婉,蔡继宝,徐振宇,等. 植物细胞壁物质在DMSO-d6/ HMPA-d18中的溶液态2D HSQC NMR分析[J]. 中国科学技术大学学报,2020, 50(8): 1077-1083.
WANG Wanwan, CAI Jibao, XU Zhenyu, et al. Analysis of plant cell wall material in DMSO-d6/HMPA-d18 solution by 2D HSQC NMR [J]. Journal of University of Science and Technology of China, 2020, 50(8): 1077-1083.
[28] 闫克玉,闫洪洋,李兴波,等. 烤烟烟叶细胞壁物质的对比分析[J]. 烟草科技,2005(10): 6-11.
YAN Keyu, YAN Hongyang, LI Xingbo, et al. Comparative analysis of cell wall substances in flue-cured tobacco leaf[J]. Tobacco Science & Technology, 2005(10): 6-11.
[29] Bjorkman A. Isolation of lignin from finely divided wood with neutral solvents[J]. Nature, 1954, 174(4440): 1057-1058.
[30] Lu Y, Lu Y C, Hu H Q, et al. Structural characterization of lignin and its degradation products with spectroscopic methods[J]. Journal of Spectroscopy, 2017, 2017:1-15.
[31] Sequeiros A, Labidi J. Characterization and determination of the S/G ratio via Py-GC/MS of agricultural and industrial residues[J]. Industrial Crops and Products, 2017, 97: 469-476.
[32] Kim H, Padmakshan D, Li Y, et al. Characterization and elimination of undesirable protein residues in plant cell wall materials for enhancing lignin analysis by solution-state nuclear magnetic resonance spectroscopy[J]. Biomacromolecules, 2017, 18(12): 4184-4195.
[33] Geng W, Narron R, Jiang X, et al. The influence of lignin content and structure on hemicellulose alkaline extraction for non-wood and hardwood lignocellulosic biomass[J]. Cellulose, 2019, 26(5): 3219-3230.
[34] 杨欣. 不同生长阶段毛竹及绿色溶剂预处理中毛竹木质素分离和结构解析[D]. 雅安:四川农业大学,2019.
YANG Xin. Separation and structure analysis of lignin from phyllostachys moso at different growth stages and pretreatment with green solvent [D]. Sichuan Agricultural University, 2019.
Structure characterization of tobacco lignin by Two-dimensional Nuclear Magnetic Resonance spectroscopy
GAO Miao1, CAI Jibao2, XU Zhenyu2, TIAN Dayu1, SU Jiakun2, ZHANG Yi2, YANG Jun1*
1 Tobacco and Health Research Center, University of Science and Technology of China, Hefei 230051, China;2 Technology Center, China Tobacco Jiangxi Industrial Co., LTD., Nanchang 330096, China
Lignin has an important effect on tobacco quality and safety. In order to improve the quality of tobacco products, it is necessary to study the chemical structure and content of tobacco lignin.In this study, tobacco lignin was characterized by two-dimensional heteronuclear single quantum coherence nuclear magnetic resonance(2D HSQC NMR), and the structure characterization and semi-quantitative analysis of tobacco lignin were studied.Test data show: 1) There were 10 kinds of lignin subunits and linkages and 27 signals of related structures were found in tobacco lignin; 2) Tobacco sample lignin is a SGH type lignin. Guaiacyl (G) is the most important lignin subunit, of which the content ranges from 50.72 to 73.50 percent; the content of syringyl (S) is between 15.62 and 26.51 percent, and the content of p-hydroxyphenyl (H) is between 5.66 and 28.90 percent. β-aryl ether units β-O-4 (A) are the most important lignin linkages, whose content ranges from 72.93 to 92.97 percent of the whole linkages of lignin, followed by resinol units β-β (C) in the range of 3.88-15.81 percent; 3) From the top to the bottom of flue-cured tobacco leaves, the content of syringyl (S) units gradually decreases, while the content of guaiacyl (G) and p-hydroxyphenyl (H) units gradually increases. Compared with tobacco leaves, the content of guaiacyl (G) units is higher in cut stem and tobacco sheet, but the content of p-hydroxyphenyl (H) units is lower. However , the content of β-aryl ether units β-O-4 (A) is lower, and the content of resinol units β-β (C) is higher.In this paper, qualitative and semi-quantitative analysis of lignin subunits and linkages of different tobacco samples were realized by using 2D HSQC NMR method, and the model of tobacco lignin molecular structure was proposed. These results provide a theoretical and technical basis for the study of tobacco lignin macromolecules.
2D NMR; HSQC; tobacco; lignin; structural characterization; quantitative analysis
. Email:yjun8202@ustc.edu.cn
高淼,蔡继宝,徐振宇,等. 烟草木质素结构的二维核磁共振波谱表征[J]. 中国烟草学报,2022,28(2).GAO Miao, CAI Jibao, XU Zhenyu, et al. Structure characterization of tobacco lignin by Two-dimensional Nuclear Magnetic Resonance spectroscopy[J]. Acta Tabacaria Sinica, 2022, 28(2).doi:10.16472/j.chinatobacco. 2021.T0169
江西中烟工业有限责任公司科技项目“烟草木质素结构的二维核磁共振波谱研究与应用”(2020360000340303)
高淼(1998—),硕士研究生,主要从事烟草大分子结构分析研究,Tel:0551-63492060,Email:gaomiao@mail.ustc.edu.cn
杨俊(1967—),博士,副教授,主要从事烟草化学研究,Tel:0551-63492065,Email:yjun8202@ustc.edu.cn
2021-09-24;
2022-03-07

