Cu基催化剂脱除逃逸氨的机理研究
黄 尚,王晓雪,罗春欢,2,苏庆泉,2
(1. 北京科技大学 能源与环境工程学院,北京 100083;2. 北京科技大学 冶金工业节能减排北京市重点实验室,北京 100083)
在燃烧烟气的脱硝工艺中,以氨作为还原剂的选择性催化还原(NH3selective catalytic reduction,NH3-SCR)技术是应用最广的工艺之一。NH3-SCR以NH3为还原剂使NOx在催化剂的作用下反应生成N2和H2O,随着催化剂的劣化失活,脱硝烟气中的逃逸氨会逐渐增加,而氨与烟气中硫的氧化物等反应生成的(NH4)2SO4会沉积在排烟管道的内表面,从而造成管道堵塞。同时,氨也是PM2.5二次颗粒的重要前体物[1-5]。因此,研究如何高效地将脱硝烟气中的逃逸氨转化为N2对降低烟气脱硝系统的运行成本有重要意义,同时也是减少PM2.5二次颗粒生成的关键途径。
针对逃逸氨脱除的研究,选择性催化氧化(Selective catalytic oxidation,SCO)是目前最有前途的方法之一。过渡金属氧化物如CuO,因为成本低且低温活性高而引起了广泛关注[6-7]。Cu基催化剂与NH3反应时,NH3首先在催化剂表面被活化为化学性质活泼的中间产物,进而发生下一步反应生成N2[8]。在钢铁生产流程中,脱硝烟气中含有不同体积分数的SO2,而SO2的存在影响中间产物的生成,适当的引入Al2O3可以提高催化剂耐SO2的能力[9-11]。对于CuO/Al2O3负载型催化剂而言,影响Cu基催化剂活性的主要因素是CuO的质量分数,现有的研究主要是针对低质量分数的Cu基催化剂。GANG等[12]研究发现,在NH3体积分数为1.14%、O2体积分数为8.21%,总流量为74.7 mL/min的气氛中,5%CuO/Al2O3催化剂(催化剂中CuO质量分数为5%,下同)在350 °C时,NH3去除率为60%,N2选择性为100%。10%CuO/Al2O3催化剂在350 °C时,NH3去除率为60%,N2选择性为100%,CHMIELARZ等[6]在NH3体积分数为0.5%、O2体积分数为2.5%,总流量为40 mL/min的氛围下,发现在350 °C时,20%CuO/Al2O3的NH3脱除率能达到90%,N2选择性能达到80%。对比使用醋酸盐、硫酸盐和硝酸盐前驱体制备的催化剂,发现用硝酸盐制备的催化剂能在载体上形成较多的高分散CuO分子,反应效果优于由醋酸盐和硫酸盐制备的催化剂[13]。在现有的研究中,所做的工作大多针对活性组分(如CuO)质量分数低于20%的催化剂,对于活性组分(如CuO)质量分数高于20%的催化剂尚缺乏研究。此外,目前,对于催化剂的硫中毒,主要是认为催化剂与SO2反应生成硫酸盐而造成催化剂失活[14],关于催化剂硫中毒的机理还有待进一步的研究。
本文对硝酸盐前驱体制备的高质量分数的催化剂处理逃逸氨的性能及耐硫性进行了研究。鉴于Cu基催化剂具有载氧体的属性,本文就质量分数为30%的Cu基催化剂展开了实验研究,探究了该催化剂在脱除逃逸氨的反应中除了催化氧化机理外,是否还含有基于化学链燃烧反应的氨脱除反应机理。
1 实验部分
1.1 实验试剂
γ-Al2O3,质量分数为99.5%,中国铝业山东分公司;刚玉球,质量分数为99%,直径1~2 mm,中国铝业山东分公司;Cu(NO3)2•3H2O,分析纯,国药集团北京试剂公司;聚乙烯醇,质量分数为97%,北京益利精细化学品有限公司。
1.2 催化剂制备
采用250~300 目的γ-Al2O3作为载体,Cu(NO3)2•3H2O作为活性成分的前体物。在60 °C下,配制质量分数为56.5%的Cu(NO3)2溶液,采用等体积浸渍法在60 °C恒温水浴中将配好的溶液浸渍在γ-Al2O3上,干燥后在马弗炉中500 °C焙烧5 h,重复上述步骤至CuO的负载量(质量分数)为30%。随后在样品粉末中加入质量分数为2%的聚乙烯醇水溶液做粘合剂并均匀混合,将粉末放入模具中在压片机(769YP-24B,天津科器高新技术有限公司)上,以10 MPa的压力压制3 min后取出。将得到的饼状催化剂干燥、焙烧后再破碎,并筛选出粒径为0.71~1.00 mm的颗粒作为实验用的催化剂样品,标记为30-CuO/Al2O3。
1.3 催化剂表征
在日本Rigaku Ultima IV衍射仪上进行催化剂物相分析,采用Cu靶,Ni滤波片,λ= 0.15406 nm。在Micromeritics ASAP 2020 PLUS HD88吸附仪上分析样品的比表面积和孔径分布。首先将1.00 g样品放在300 °C、N2气氛下进行脱气处理(N2流量为50 mL/min,脱气时间为3 h),然后在-196 °C进行N2吸附实验。通过Brunauer-Emmett-Teller(BET)法计算样品比表面积,Barrett-Joyner-Halenda (BJH)法计算平均孔径和总孔容。
1.4 催化剂活性评价
在连续流动-固定床反应器中考察了催化剂与NH3反应的性能。实验装置由反应器、气体供给系统和气体分析仪3部分组成。混合气中NH3体积分数为50 µL/L,CO2的体积分数为8%,O2的体积分数为6%,平衡气为N2。通过相应的质量流量控制器进行调节,30-CuO/Al2O3的填充量为2.1 mL(1.83 g)。空速(Gas hour space velocity,GHSV)为60000 h-1,总流量为2100 mL/min,反应在常压下进行。催化剂放置于恒温区,催化剂上下用刚玉球(直径1~2 mm)支撑,通过电炉加热。NH3和NO的体积分数由线红外分析仪(北京北分麦哈克分析仪器有限公司)测量,取样探头及管线全程加热,进样量0.5 L/min。N2O和NO2的体积分数由气相色谱质谱联 用 仪(Thermo Trace 1310,Thermo Scientific)测量,进样量1 mL,进样口110 °C,流量15 mL/min,柱温50 °C,检测器300 °C,尾吹5 mL/min。NH3脱除率、NO选择性分别按式(1)、(2)计算。
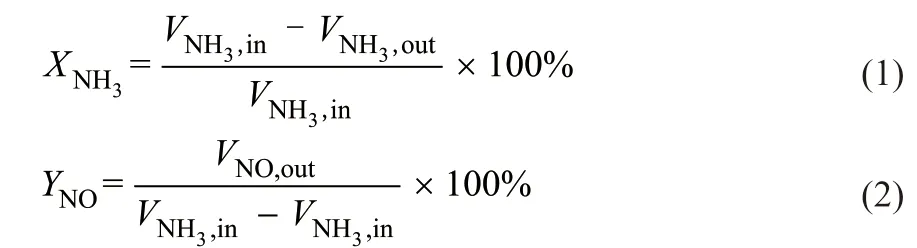
式中, 为NH3脱除率,%;YNO为NO选择性,%;为反应器入口NH3的体积分数,µL/L;为反应器出口NH3的体积分数,µL/L; 为反应器出口NO的体积分数,µL/L。
2 结果与讨论
2.1 30-CuO/Al2O3的逃逸氨脱除反应性能
2.1.1 反应温度的影响
首先对30-CuO/Al2O3的逃逸氨脱除性能进行了评价。模拟NH3-SCR脱硝烟气的气体组成,配制了反应气体(混合气中NH3体积分数为50 µL/L CO2体积分数为8%,O2体积分数为6%,N2为平衡气,总流量为2100 mL/min)。催化剂床层中30-CuO/Al2O3的填充量为2.1 mL(1.83 g),反应空速为60000 h-1、反应温度为200~450 °C,结果如图1所示。

图1 NH3脱除率与NO选择性随反应温度的变化(a)和350 °C下产气中NH3、NO、N2O和NO2的体积分数(b)Fig. 1 Variation of NH3 removal rate and NO selectivity with reaction temperature (a) and volume fraction of NH3, N2O, NO and NO2 in product gas at 350 °C (b)
如图1(a)所示,随着反应温度的升高,NH3脱除率逐渐升高,并在350 °C时达到完全脱除,而NO选择性从300 °C开始随着温度升高而增加,在450 °C时达到68.0%。此外,还对350 °C下的N2O和NO2生成量进行了测定,如图1(b)所示。氨的脱除反应除了N2之外只可能生成3种氮氧化物,即NO、N2O和NO2,在代表性反应温度350 °C下分析得到的只有NO,几乎没有检测到N2O和NO2,说明生成的氮氧化物以NO为主,这与GANG等[12]、武永健等[15]、LIANG 等[16]和CUI等[17]的研究结果一致。
2.1.2 O2对反应的影响
Cu基催化剂具有载氧体的属性,为了探究其逃逸氨脱除反应机理除了选择性催化还原机理之外是否还包括化学链燃烧机理,在反应效果最优的温度(350 °C)下进行了有无O2存在时逃逸氨脱除反应的对比实验,结果如图2所示。

图2 有无O2条件下,NH3脱除率与NO选择性随反应时间的变化Fig. 2 Variation of NH3 removal rate and NO selectivity with reaction time in presence or absence of O2
化学链燃烧将燃料与空气中的分子氧(O2)发生的常规燃烧转化为两个气固反应,一个是燃料与氧化态载氧体发生的氧化态载氧体还原反应,在此反应中氧化态载氧体失去晶格氧的同时被还原为还原态载氧体,而燃料获得晶格氧的同时被氧化为CO2和H2O;另一个反应是O2与还原态载氧体发生的还原态载氧体氧化再生反应,在此反应中还原态载氧体被氧化再生为氧化态载氧体,而O2转化为载氧体中的晶格氧。如图2所示,在不加O2的15.2 h中,NH3脱除率均保持在81.3%以上,而NO选择性一直维持在0%。由于没有O2,此时显然不会发生以CuO为催化剂、基于催化氧化机理的式(7)和式(8)所示的氨脱除反应,而是发生了式(3)、式(4)所示的基于氧化态载氧体(CuO)还原反应的氨脱除反应。根据式(3)、式(4)和催化剂床层中30-CuO/Al2O3的填充量计算得到的氨的理论脱除量与不加O2的15.2 h中实际脱除的氨的数量基本吻合,实际发生的氨脱除反应为式(3)、式(4)所示的氧化态载氧体还原反应也由此得到了支持。

进一步地,开始加入O2,此时的催化剂床层在微观上可以看作是由许多微小的氧化态载氧体还原反应器和还原态载氧体氧化再生反应器组成,当NH3在某一时刻某一地点与氧化态载氧体(CuO、Cu2O)发生式(3)、式(4)的氧化态载氧体还原反应时,在另一时刻另一地点发生着式(5)、式(6)所示的还原态载氧体(Cu、Cu2O)与O2的还原态载氧体氧化再生反应。从宏观上看,氨的化学链燃烧反应,即基于化学链燃烧机理的氨脱除反应在催化剂床层中连续地进行。
此外,由图2可知,在加入O2之后NO选择性明显上升,可知,此时除了基于化学链燃烧机理的氨脱除反应之外,还发生着如式(7)、式(8)所示的以CuO为催化剂、基于催化氧化机理的氨脱除反应。而从NO的选择性与分子氧的相关关系可以推断,基于化学链燃烧机理的氨脱除反应的N2选择性明显高于基于催化氧化机理的氨脱除反应的N2选择性。
2.1.3 SO2对反应的影响
在实际工况中,脱硝烟气中含有不同体积分数的SO2,针对低体积分数的含硫烟气展开了研究,配制了含硫反应气体(混合气中NH3体积分数为50 µL/L,SO2体积分数为50 µL/L ,CO2体积分数为8%,O2体积分数为6%,N2为平衡气,总流量为2100 mL/min),对30-CuO/Al2O3在含硫氛围下的逃逸氨脱除性能进行了评价,结果如图3所示。

图3 有无SO2条件下, NH3脱除率(a)和NO选择性(b)随反应温度的变化Fig. 3 Variation of NH3 removal rate (a) and NO selectivity (b) with reaction temperature in presence or absence of SO2
从图3(a)可以看出,在含硫条件下,NH3脱除率随着反应温度的升高而逐渐升高,温度为450 °C时NH3脱除率达到了92.0%,但300~400 °C的温度范围内,与不含硫时相比有所下降。而如图3(b)所示,含硫时400 °C以下基本无NO产生,SO2的存在使得氨脱除反应的N2选择性得到了明显的改善。
2.2 催化剂的表征
对于加50 µL/L SO2、350 °C下的实验,对反应前和反应后的催化剂进行了XRD及BET表征,结果如图4及表1所示。从图4可以看出,反应前催化剂中主要成分为CuO,而反应后,在2θ= 28°处有Cu2S的衍射峰,说明30-CuO/Al2O3发生了硫中毒。另外从表1可知,反应后的催化剂比表面积和孔容有所下降,表明催化剂的催化活性受到了硫中毒和高温烧结的影响,催化剂表面的催化活性位减少,导致基于催化氧化机理的氨脱除反应受到了显著的抑制,NH3脱除率在300~400 °C的温度范围内与不含硫时相比有所下降。由于本文催化剂的CuO负载率较高(质量分数为30%),只有部分的CuO转化为Cu2S,所以SO2对基于化学链燃烧反应机理的NH3脱除率的影响并不显著。因此,在两个氨脱除反应机理的共同作用下,SO2的存在导致NO选择性下降显著,虽然NH3的脱除率也有所下降,但下降幅度较小,其结果使得N2选择性得到了改善,这与CHEN等[18]和GAO等[19]的研究结果相吻合。据此可以推断,当脱硝烟气中含有SO2时,基于Cu催化剂的氨脱除反应中以化学链燃烧反应机理为主导。

图4 反应前(a)和反应后(b) 30-CuO/Al2O3的XRD谱图Fig. 4 XRD patterns of 30-CuO/Al2O3 before (a) and after (b)reaction

表1 反应前后30-CuO/Al2O3的孔结构参数Table 1 Pore structural parameters of 30-CuO/Al2O3 before and after reaction
3 结论
本文对基于Cu基催化剂的脱硝烟气中逃逸氨脱除机理展开了实验研究,得出主要结论如下:
(1)基于Cu基催化剂的逃逸氨脱除反应中,氨脱除率随温度的升高而升高,在350 °C达到100%,而NO选择性在300 °C以上开始随温度的升高而升高。由于Cu基催化剂具有载氧体的属性,在无O2存在的条件下仍发生了氨脱除反应,表明其脱除逃逸氨的反应包括基于氧化态Cu基载氧体的化学链燃烧机理,而基于化学链燃烧机理的逃逸氨脱除具有很高的N2选择性。
(2)脱硝烟气中的SO2使逃逸氨脱除反应的NO选择性得到了明显的抑制,而对氨的脱除率影响不大。当反应气体中含有50 µL/L SO2时,与不含SO2相比,350 °C下的NO选择性从38.0%大幅降至2.7%,而NH3脱除率则从100.0%降至72.0%,降幅较小,其结果使得N2选择性得到了改善。结合催化剂的XRD及BET表征结果认为,在脱硝烟气含有SO2的情况下,基于Cu基催化剂的逃逸氨脱除反应以化学链燃烧机理为主。

