HPLC法测定盐酸替罗非班注射液中光学异构体
胡小燕,石胜男,薛允宁
分析检测
HPLC法测定盐酸替罗非班注射液中光学异构体
胡小燕,石胜男,薛允宁
(沈阳新马药业有限公司,辽宁 沈阳 110102)
建立盐酸替罗非班注射液光学异构体的测定方法。色谱柱采用CHIRALPAK® IC手性色谱柱,流动相为(正己烷)∶(异丙醇)∶(甲醇)∶(三氟乙酸)∶(无水乙二胺)=40∶40∶20∶0.3∶0.3。检测波长227 nm,流速0.8 mL·min-1。重点针对样品的制备方法进行考察,对样品处理方式、稀释剂配比和超声时间进行了筛选,确定采用旋蒸除水然后稀释剂提取的方式制备供试品溶液。该方法专属性、线性、灵敏度、耐用性均良好,适用于盐酸替罗非班注射液中光学异构体的检测。
HPLC法;盐酸替罗非班注射液; 光学异构体
盐酸替罗非班(Tirofiban hydrochloride)为非肽类血小板表面糖蛋白GP Ⅱb/Ⅲa受体拮抗剂,临床上常与肝素连用,用于预防不稳定型心绞痛或非Q波心肌梗塞病人,预防心脏缺血事件,同时也适用于冠脉缺血综合征病人进行冠脉血管成形术或冠脉内斑块切除术,以预防与经治冠脉突然闭塞有关的心脏缺血并发症[1-6]。
盐酸替罗非班化学名为N-(正丁基磺酰基)-O- [4-(4-哌啶基)丁基]-L-酪氨酸盐酸盐一水合物,分子式为C22H36N2O5S·HCl·H2O,分子量为495.08。结构中含有L构型酪氨酸片段,D构型为合成工艺中引入的光学异构体[7],需在药品标准中作为杂质进行控制,本文参考盐酸替罗非班质量标准和相关文献[8-11],对样品前处理方法重点进行了考察,采用HPLC法测定盐酸替罗非班注射液中的光学异构体。经规范的方法验证[12-14],本法适合盐酸替罗非班注射液中光学异构体的测定。

1 实验部分
1.1 仪器
BP211D型电子天平(北京赛多利斯天平有限公司);Agilent 1260 VWD 高效液相色谱仪(安捷伦科技有限公司);Agilent 1260 DAD 高效液相色谱仪(安捷伦科技有限公司);变色龙工作站Chromeleon 7.2.10 ES;RE-52A旋转蒸发器(上海亚荣生化仪器厂);KQ-250DE超声波清洗器(昆山市超声仪器有限公司)CHIRALPAK® IC手性色谱柱,250 mm×4.6 mm,5μm(大赛璐药物手性技术(上海)有限公司)。
1.2 试剂
样品:盐酸替罗非班注射液(批号:04210601,通辽华邦药业有限公司),正己烷(色谱纯,上海西格玛奥德里奇贸易有限公司);异丙醇(色谱纯,上海西格玛奥德里奇贸易有限公司);甲醇(色谱纯,上海西格玛奥德里奇贸易有限公司);三氟乙酸(分析纯,山东西亚化学试剂);无水乙二胺(分析纯,国药集团化学试剂有限公司)。
2 方法与结果
2.1 色谱条件
色谱条件:采用CHIRALPAK® IC色谱柱(250 mm×4.6 mm,5μm);以(正己烷)∶(丙醇)∶(甲醇)∶(三氟乙酸)∶(无水乙二胺)=40∶40∶20∶0.3∶0.3为流动相;流速为每分钟0.8 mL;柱温为35 ℃;检测波长为227 nm;进样体积为50μL。
2.2 对照溶液的制备
精密量取供试品溶液适量,加上述稀释剂稀释制成每1 mL中约含替罗非班1.25μg的溶液。
2.3 供试品溶液制备方法的考察
1)样品提取方式的选择
本品盐酸替罗非班注射液为灭菌水溶液,所选择的分析方法采用正相体系进样高效液相色谱仪,无法采用直接稀释定容的方式制备样品,需将样品中水分除去后再进一步处理制备成供试品溶液。盐酸替罗非班在甲醇、冰醋酸中极易溶解,在水中微溶。如果采用萃取的方式并无合适的萃取溶剂,本品采用旋转蒸发将水分低温(30~60 ℃)去除后,用稀释剂提取并稀释定容。
2)稀释剂的选择
本品药液经旋转蒸发仪蒸干,残渣为白色固体粉末,其中盐酸替罗非班仅占固体粉末重量的2.25%,其他为处方中的辅料。为将残渣中盐酸替罗非班充分提取,需考察稀释剂的组成。参考标准[6]中采用(正己烷)∶(异丙醇)∶(甲醇)=20∶30∶50作为稀释剂,将该稀释剂用于盐酸替罗非班注射液蒸发残渣的提取,发现主成分回收率偏低,考虑到盐酸替罗非班在甲醇中溶解度较好,提高稀释剂中甲醇的比例,调整为(正己烷)∶(异丙醇)∶(甲醇)=10∶15∶75,残渣的提取溶液中主成分回收率明显提高。
由于盐酸替罗非班注射液中异构体为未检出,上述用于稀释剂筛选的样品为按限度(0.2%)添加异构体的盐酸替罗非班注射液。
两种稀释剂的提取效率对比结果见表1。

表1 稀释剂的选择
对比结果显示稀释剂2提取率好于稀释剂1,所以选择(正己烷)∶(异丙醇)∶(甲醇)=10∶15∶75作为异构体方法中的稀释剂。
3)超声提取时间的确定
供试品溶液制备方法建立过程中,对超声提取的时间进行了筛选,筛选结果如表2。
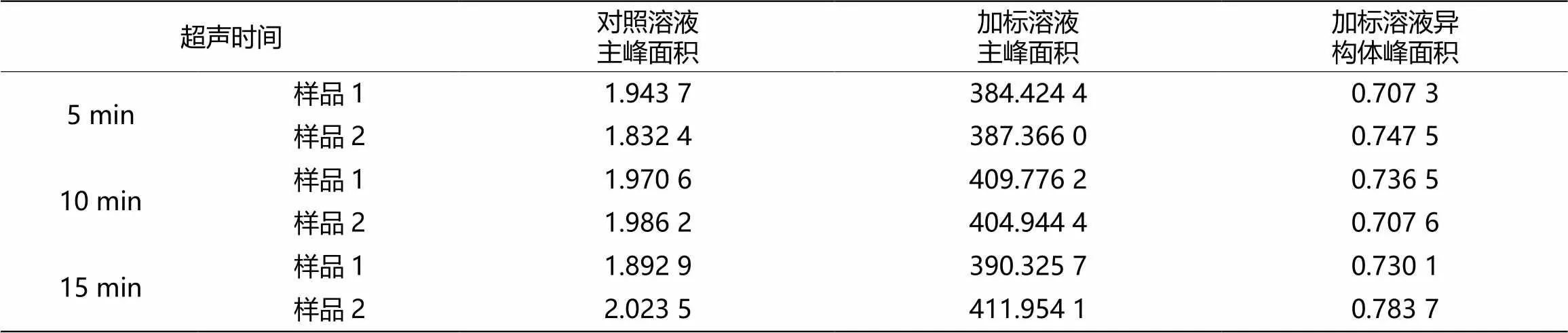
表2 超声提取时间的选择
超声5 min、10 min、15 min的异构体检测结果无明显差异,所以超声时间折中选择了10 min。
供试品溶液的制备精密量取本品10 mL,置旋转蒸发器上蒸干,精密加入稀释剂(正己烷)∶(异丙醇)∶(甲醇)=10∶15∶75 10 mL,超声10 min,滤过,即得。
2.4 检测波长的确定
与参考文献[9]中描述一致,UV扫描结果显示除末端吸收外最大吸收波长为227 nm,所以将检测波长确定为227 nm。
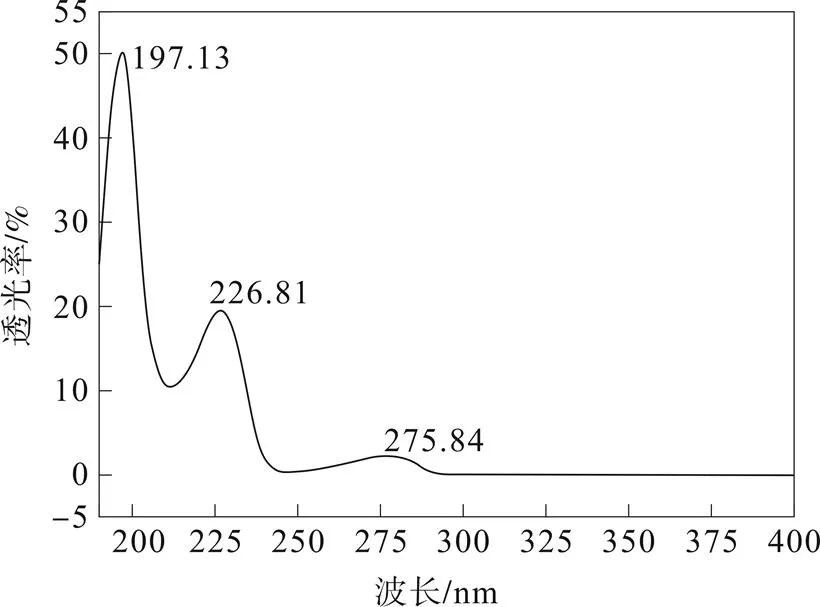
图1 盐酸替罗非班紫外扫描图谱
2.5 专属性试验
酸破坏试验:取供试品溶液10 mL,置25 mL量瓶中,加0.1 mol·L-1盐酸溶液2 mL,置80 ℃水浴加热4 h,放冷,加0.1 mol·L-1氢氧化钠溶液2 mL中和,置旋转蒸发器上蒸干,精密量取稀释剂10 mL,超声10 min,滤过,取滤液作为供试品溶液。
碱破坏试验:取盐酸替罗非班注射液10 mL,置25 mL量瓶中,加0.1 mol·L-1氢氧化钠溶液2 mL,置80 ℃水浴加热4 h,放冷,加0.1 mol·L-1盐酸溶液2 mL中和,置旋转蒸发器上蒸干,精密量取稀释剂10 mL,超声10 min,滤过,取滤液作为供试品溶液。
氧化破坏试验:取盐酸替罗非班注射液10 mL,置25 mL量瓶中,加1%过氧化氢溶液1 mL,置80 ℃水浴加热1 h,放冷,置旋转蒸发器上蒸干,精密量取稀释剂10 mL,超声10 min,滤过,取滤液作为供试品溶液。
高温破坏试验:取盐酸替罗非班注射液10 mL,置80 ℃水浴加热8 h,置旋转蒸发器上蒸干,精密量取稀释剂10 mL,超声10 min,滤过,取滤液作为供试品溶液。
光照破坏试验:取替罗非班注射液10 mL,在(4 500±500)lx的光照强度下放置4 d。置旋转蒸发器上蒸干,精密量取稀释剂10 mL,超声10 min,滤过,取滤液作为供试品溶液。
将按照上述破坏条件制备的供试液按照“2.1”项下色谱条件进样,记录色谱图(图2)。各破坏条件下目标峰与相邻杂质峰的分离度均符合要求。

2.6 线性关系、检测限与定量限考察
精密称量盐酸替罗非班对照品适量,用稀释剂制成含替罗非班质量浓度分别为0.248 5、0.397 7、0.497 1、0.745 6、1.242 7、2.485 4 μg·mL-1的溶液,按照光学异构体色谱条件进样检测,记录色谱图。以峰面积为纵坐标,浓度为横坐标绘制标准曲线,得回归方程:=1.695 5- 0.068 7(=0.999 4)。替罗非班0.248 5~2.485 4 μg·mL-1与峰面积呈良好的线性关系。
取对照品溶液,逐级稀释,分别进样检测,记录色谱图,得替罗非班检测限(S/N≌3)和定量限(S/N≌10)分别为4.97 ng、9.07 ng。
2.7 耐用性试验
考察在柱温、流速、波长及流动相比例发生微小变化时,主峰与光学异构体的分离度情况及异构体的检测情况,结果在不同变换条件下检测同一批供试品,系统适用性溶液主峰与异构体峰分离度均大于2.0,表明方法耐用性良好。异构体含量RSD为4.83%。符合可接受标准[13]。
2.8 光学异构体检测
精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。供试品溶液色谱图中如有替罗非班异构体峰,其峰面积不得大于对照溶液主峰面积的0.4倍(0.2%)。
3 结论
本文重点针对样品的制备方法进行考察,对样品处理方式、稀释剂配比和超声时间进行了考察,确定采用旋蒸除水然后提取的方式制备供试品溶液。色谱条件为CHIRALPAK® IC手性色谱柱,流动相为(正己烷)∶(异丙醇)∶(甲醇)∶(三氟乙酸)∶(无水乙二胺)=40∶40∶20∶0.3∶0.3。该方法经验证,专属性、线性、灵敏度、耐用性均良好,本方法适用于盐酸替罗非班注射液中光学异构体的检测,可以有效控制产品质量。
参考文献:
[1]董春阳.盐酸替罗非班注射液联合酒石酸美托洛尔治疗急性心肌梗死的效果[J]. 河南医学研究,2019,28(12):2217-2218.
[2]曾广伟.小剂量盐酸替罗非班注射液在老年急性ST段抬高型心肌梗死患者经皮冠状动脉介入治疗中的应用效果[J]. 实用心脑肺血管病杂志,2017,25 (5):105-108.
[3]王强等.国产盐酸替罗非班注射液在急性冠脉综合征的应用[J]. 东南大学学报(医学版),2010,29(3):280-282.
[4]王蕊,李正,王广林. 盐酸替罗非班注射液联合酒石酸美托洛尔治疗急性心肌梗死的效果分析[J]. 微量元素与健康研究,2020,37(4):85-86.
[5]李路.盐酸替罗非班注射液联合酒石酸美托洛尔治疗急性心肌梗死的效果观察[J]. 健康必读,2020(33):26-27.
[6]盐酸替罗非班注射液(AGGRASTAT)进口药品说明书[R]. Medicure Pharma, lnc.
[7]郑永勇. 盐酸替罗非班的合成[J]. 中国医药工业杂志,2012, 43 (6),408-410
[8]山东罗欣药业股份有限公司. 盐酸替罗非班质量标准[S].
[9]杨彩霞. HPLC测定盐酸替罗非班氯化钠注射液中的D-异构体[J]. 华西药学杂志,2014,29(6):714-716.
[10]陈晶冰, 温欣茹. 盐酸替罗非班有关物质方法学研究[J],中国保健营养,2018, 28(9):253.
[11]吴燕 , 林向阳, 张福成. 手性高效液相色谱法测定盐酸替罗非班光学异构体[J],中国药学杂志,2014, 49(13):1165-1167.
[12]国家药品监督管理局药品审评中心.化学药物杂质研究的技术指导原则[R].
[13]国家药品监督管理局药品审评中心.化学药物质量控制分析方法验证技术指导原则[R].
[14]王静,姜凌娟.脂肪乳氨基酸(17)葡萄糖(11%)注射液氨基酸注射液中吲哚-3-甲醛的测定[J].辽宁化工,2021,50(6):901-911.
Determination of Optical Isomers in Tirofiban hydrochloride injection by HPLC
,,
(Shenyang Xinma Pharmaceutical Co., Ltd., Shenyang Liaoning 110102, China)
A method for the determination of optical isomers in tirofiban hydrochloride injection was established. The chromatographic column was CHIRALPAK® IC, and the mobile phase consisted of n-hexane-isopropanol- methanol-trifluoroacetic acid-anhydrous ethylenediamine (40∶40∶20∶0.3∶0.3). The detection wavelength was 227 nm, and the flow rate was 0.8 mL·min-1. The preparation method of the sample was studied, sample treatment method, diluent ratio and ultrasonic time were screened, it was determined to use rotary evaporation to remove water and then diluent extraction to prepare the test solution. The method has good specificity, linearity, sensitivity and durability, and is suitable for the determination of optical isomers in tirofiban hydrochloride injection.
HPLC method; Tirofiban hydrochloride injection; Optical isomers
O657
A
1004-0935(2022)04-0569-04
2021-12-06
胡小燕(1981-),女,黑龙江省双鸭山市人,工程师,硕士研究生,2006年毕业于沈阳药科大学中药学院天然药物化学专业,研究方向:药品质量研究。

