固相萃取-超高效液相色谱-串联质谱测定水中痕量苯甲地那铵
刘思思,陈长二,陈仕保,傅新龙,李金玲,应光国
广东省化学品污染与环境安全重点实验室/环境理论化学教育部重点实验室,华南师范大学环境研究院/环境学院,广东 广州 511436
苯甲地那铵又名苦精,是一种目前世界上已知的最苦的人工合成化学品。由于其强烈的苦味和较弱的毒性,苯甲地那铵被广泛添加到家庭日用品、工业乙醇、防冻剂和动物驱散剂中[1-3]。苯甲地那铵在环境中既不会发生水解,也很难生物降解[4-6],非常稳定。此外,苯甲地那铵对哺乳动物和鸟类具有中等急性毒性(经口半致死剂量为196~841 mg/kg),对鱼类的急性毒性较弱(96 h半致死浓度大于1 000 mg/L)[7-8]。因此,苯甲地那铵被认定为一种潜在的PMT (环境持久性、高迁移性和毒性) 类物质[9]。虽然苯甲地那铵用途广泛且具有环境持久性,但其直到2017年才在德国污水处理厂中被首次检出,检出频率高达100%,最高质量浓度为341 ng/L[10-11]。目前,这种新兴环境微污染物在全球水环境中的残留水平和分布特征仍不清楚。
建立可靠的痕量苯甲地那铵检测方法对监测其环境水平和了解其环境迁移行为具有重要意义。目前,苯甲地那铵的主要检测方法有高效液相色谱法[12]、紫外可见分光光度法[13]、毛细管电泳法[14]、液相色谱-大气压化学电离质谱法[15]等。但这些检测方法主要适用于各种产品中高浓度的苯甲地那铵检测(μg/L ~ mg/L),并不适用于环境水体中痕量苯甲地那铵的检测( ng/L)。本文通过优化关键前处理参数,建立了水中痕量苯甲地那铵的固相萃取-超高效液相色谱-串联质谱分析方法,系统考察了该方法的准确度、精密度、基质效应、检出限以及线性范围,为监测环境水体中苯甲地那铵提供了有力的技术支撑。
1 实验部分
1.1 仪器与试剂
苯甲地那铵(纯度 > 98%,DB)购自上海阿拉丁生化科技股份有限公司,苯甲地那铵-D5(苄基-2,3,4,5,6氘取代,纯度 > 98%)购自上海甄准生物科技有限公司。甲醇(色谱纯)购自德国Merk公司;甲酸(色谱纯)和氨水(氨体积分数 ≥ 25%,色谱纯)购于上海阿拉丁生化科技股份有限公司。Oasis HLB固相萃取小柱(200 mg,3 mL)购自美国Waters公司,混合型阳离子交换(MCX)小柱(200 mg,3 mL)和弱阳离子交换(WCX)小柱(200 mg,3 mL)均购于上海安谱实验科技有限公司,纯水和超纯水由法国Elga水纯化系统(威立雅)提供。
固相萃取真空装置(16位,上海安谱公司);氮吹浓缩装置(MTN-2800D,天津奥特赛恩斯仪器有限公司);超高效液相色谱-三重四级杆串联质谱(UPLC Acquity®-Xevo TQS,美国Waters公司)。
1.2 标准溶液的配制
标准储备溶液的配制:准确称取标准品0.001 0 g,用甲醇溶解并定容到10 mL的棕色容量瓶中,配制成100 mg/L的标准储备溶液,在-18 ℃下避光保存(6个月内使用)。
标准工作溶液的配制:取上述标准储备液适量,用甲醇定容至10 mL,配制成已知浓度的中间标准工作溶液。用0.1% (体积分数)甲酸水溶液(初始流动相)稀释成系列浓度的标准工作液,密封于4 ℃下保存备用。
1.3 样品前处理
200 mL水样过0.7 μm 孔径玻璃纤维(GF/F)滤膜去除悬浮颗粒物后,以1 mol/L NaOH调节pH至8以上。采用WCX固相萃取小柱(200 mg,3 mL)来富集水样。上样前,SPE小柱先分别以3 mL甲醇和3 mL纯水进行活化和平衡。上样流速控制在2 ~ 3 mL/min。采用3 mL 体积分数为5%的氨水水溶液进行淋洗,然后抽干30 min。最后,以5 mL 2%(体积分数,下同)甲酸-甲醇洗脱SPE小柱上的目标物,收集于氮吹管中。目标物在50 ℃下氮吹至近干,以1 mL初始流动相重溶待测。
1.4 仪器分析
色谱柱为ACUITY UPLC BEH C18 (2.1 mm×50 mm,1.7 μm);0.1% (体积分数)甲酸水溶液为流动相A,甲醇为流动相B;流速为0.3 mL/min;柱温为40 ℃;进样量为5 μL;梯度洗脱程序见表1。

表1 梯度洗脱程序Table 1 Gradient elution programme
质谱条件:离子源采用电喷雾离子源(ESI+);分析物在正离子扫描下以多反应监测模式(MRM)分析(图1);优化的质谱参数见表2。其他优化后的质谱参数:毛细管电压为3.0 kV;离子源温度为150 ℃;脱溶剂气温度为300 ℃;脱溶剂气流量为800 L/h;锥孔反吹气流量为150 L/h;碰撞气流量为0.17 mL/min;雾化气压力为0.7 MPa。
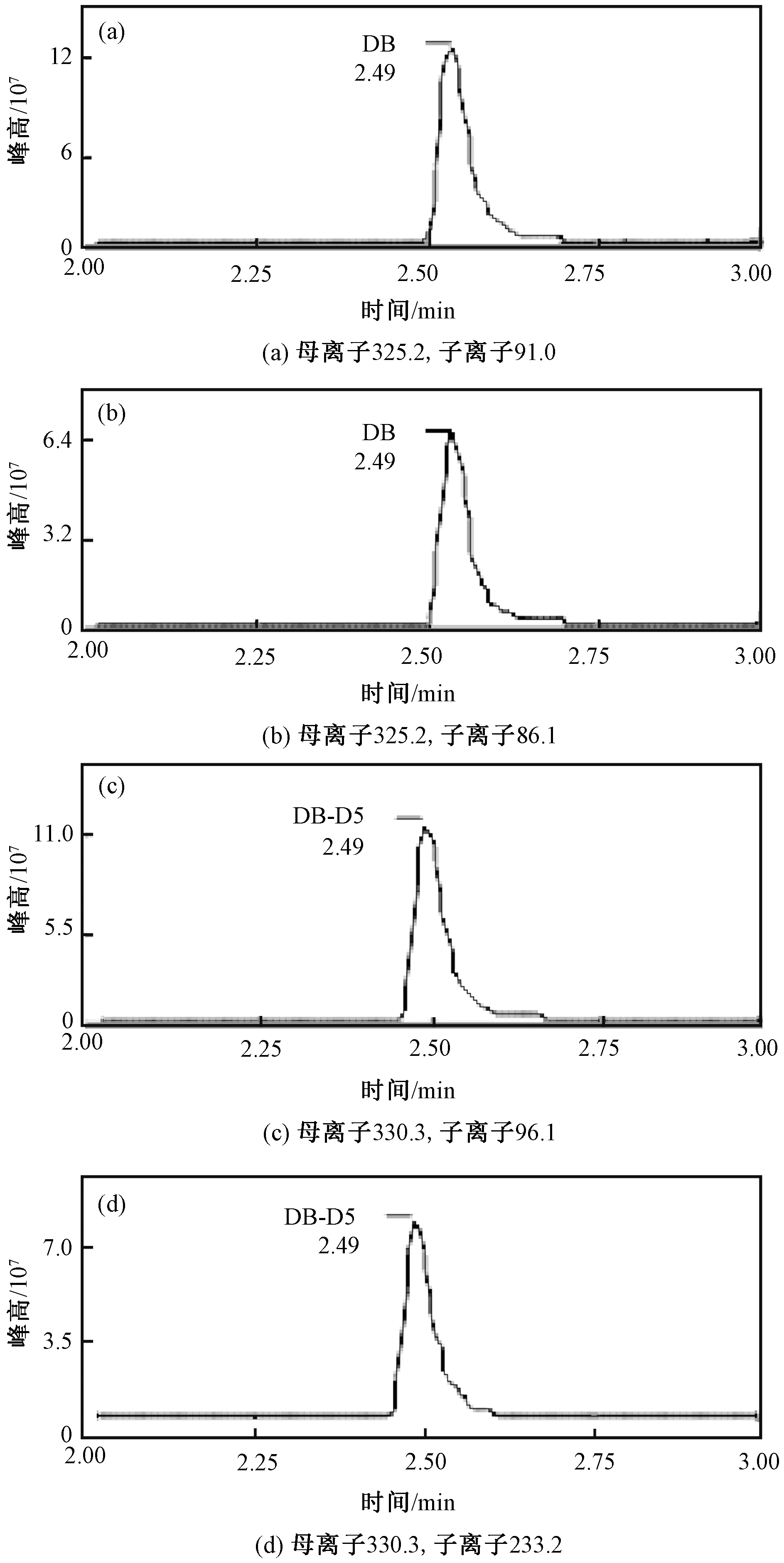
图1 50 μg/L标准品的提取离子流图(EIC)Fig.1 Extracted ion chromatograms (EIC) ofDB standard solution at 50 μg/L
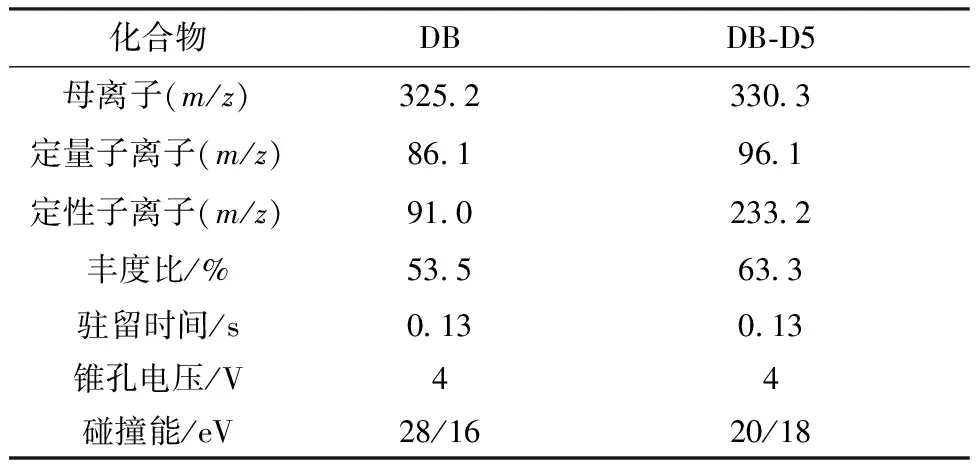
表2 DB及其内标DB-D5质谱参数Table 2 MS parameters of DB and theinternal standard,DB-D5
1.5 质量保证与质量控制
所有玻璃器皿用自来水超声清洗30 min,用自来水清洗干净后,再用纯水洗3次,烘干后甲醇洗2次,待溶剂挥发完全后,置于马弗炉中于450 ℃下烧3 h,自然冷却后取出待用。
所有样品在提取前添加回收率指示物标样(DB-D5),以指示整个样品前处理过程的回收率。同时进行方法空白、基质加标、基质加标平行样及样品平行样的测定,以进行质量控制与质量保证措施。
在每批样品进行仪器分析前,用空白溶剂和已知浓度标样检查仪器的灵敏度和稳定性,同一标样测定的误差小于20%方可进行样品测定,否则对仪器进行调试。
根据欧盟有关违禁药物检测的条例规定(2002/657/EC),为了保证目标化合物识别的准确性,采用如下2个标准:第一,样品中色谱峰保留时间与标准物质保留时间的相对偏差应在±2.5%以内;第二,定性离子的相对丰度比与标准品溶液中的定性离子相对丰度比的相对偏差(K)不超过表3规定的范围,则可判定样品中存在该目标物。

表3 定性离子相对丰度比的最大允许相对偏差Table 3 Maximum tolerance for the relative deviationsof the relative abundance of qualitative ions
2 结果与讨论
2.1 样品前处理条件比较
通过优化固相萃取过程中的关键参数(SPE柱类型、水样pH和洗脱溶剂种类),来确定最佳SPE条件。
2.1.1 SPE柱类型选择
由于DB属于离子型有机物,其主要母体结构带正电。因此比较了2种阳离子交换机理的SPE柱(WCX和MCX)以及一种通用型SPE柱(HLB),并控制上样pH在8左右,洗脱剂为2%甲酸-甲醇。从结果来看,WCX柱(110%±5.6%)和MCX柱的提取效率(106%±4.5%)要明显高于HLB柱的提取效率(75% ± 3.1%)。考虑到实际样品基质对测量浓度存在一定的抑制作用(图4),为部分补偿实际样品测定过程中的基质抑制效应,最终选择WCX柱来富集水样。
2.1.2 水样pH优化
水样pH可以决定离子型有机物的带电状态和赋存形态,也可以影响SPE吸附剂的带电状态。比较pH 分别为 6、8和10条件下采用WCX柱富集和2%甲酸-甲醇洗脱时的回收率(图2),可以看出水样pH=6时加标回收率为147%±19%,明显超过100%;而水样pH为8 ~ 10时对回收率结果的影响并不显著(P> 0.05,单因素方差分析),加标回收均能达到100%~110%。因此,最终选择将上样pH调至8以上。
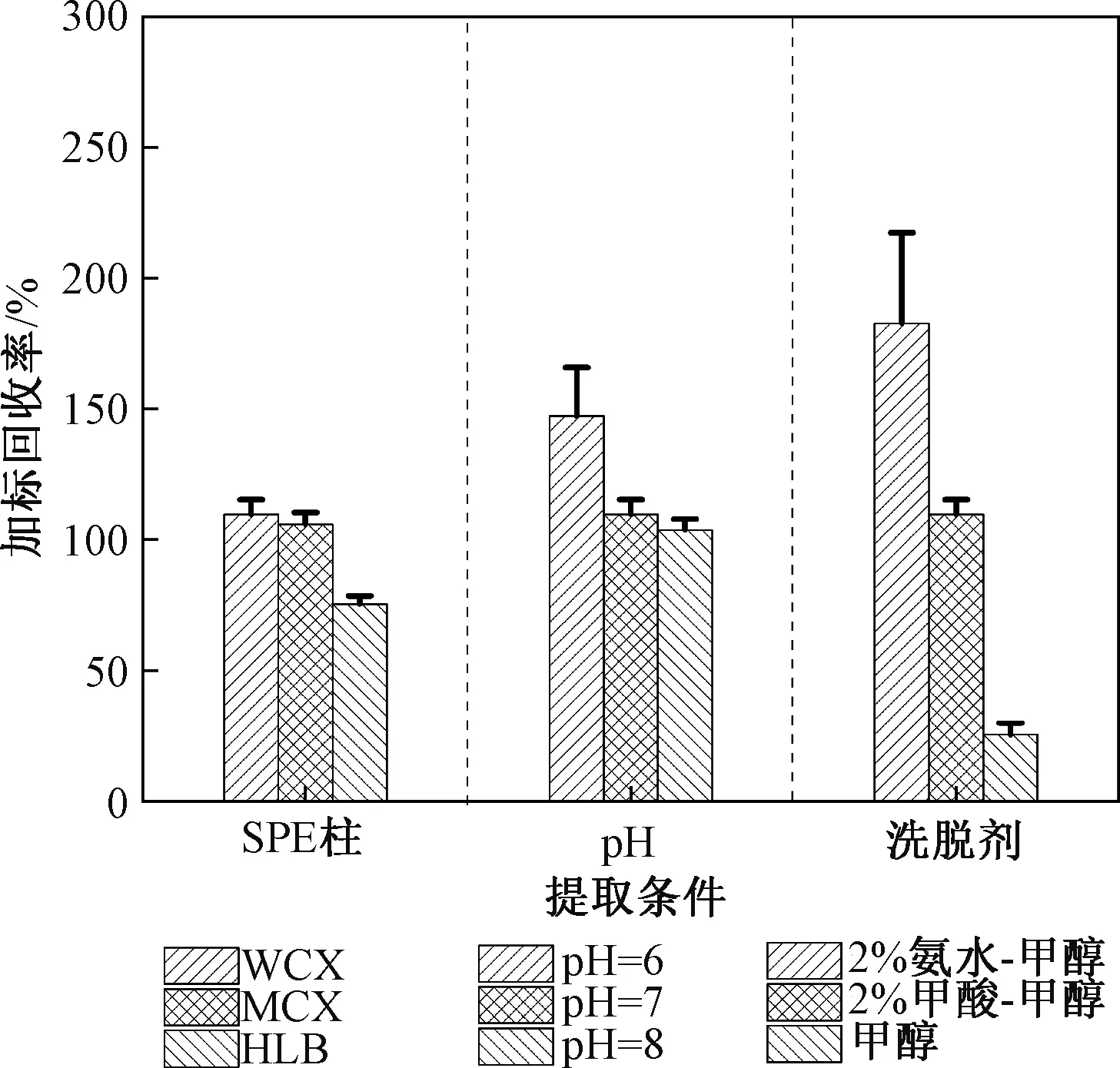
图2 不同提取条件下加标回收率比较Fig.2 Spiked recoveries of DB underdifferent SPE conditions
2.1.3 洗脱溶剂选择
采用WCX柱进行洗脱溶剂选择实验,实验中水样pH调至8左右。洗脱溶剂对比了甲醇、2%甲酸-甲醇和2%(体积分数,下同)氨水-甲醇。图2中表明,甲醇洗脱效率仅为25%±4.5% (n=3);而往甲醇中加入2%甲酸或者氨水均能显著提高DB的洗脱效率,但2%氨水-甲醇的洗脱效率远大于100%,说明可能更多的基质被同时洗脱下来。因此,最终选择2%甲酸-甲醇作为最佳洗脱溶剂。
2.2 准确度、精密度与基质效应
2.2.1 准确度
方法准确度是指使用该方法的测量结果与真实值的接近程度,一般用回收率表示。从图3可以看出,纯水中DB在不同加标水平下的加标回收率为97%~105%;珠江河水中DB在不同加标水平下的加标回收率为89%~119%。回收率均在80%~120%之间,表明方法准确度较高,可以高效富集环境水体中的DB。
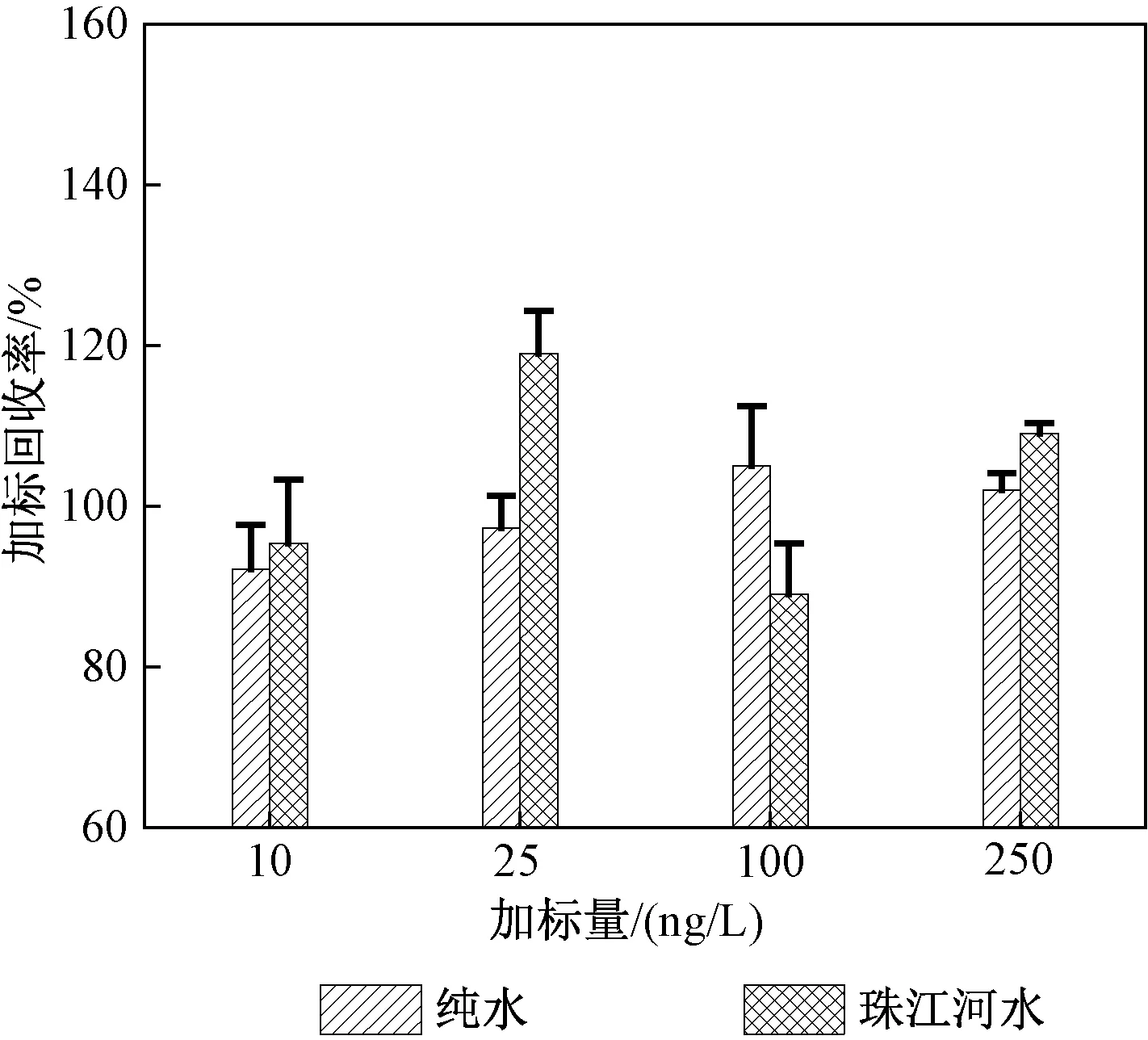
图3 纯水和珠江河水中不同加标水平下加标回收率及标准偏差Fig.3 Spiked recoveries and standarddeviations of DB in pure water and watersamples from the Pearl River atdifferent spiked levels
2.2.2 精确度
方法精密度是指在相同的实验条件下对同一个均质样品多次取样分析所测得结果之间的接近程度。一般用相对标准偏差(RSD,%)表示。纯水和珠江河水中不同加标浓度下测量结果的RSD均小于7%,说明该方法的精密度较高。
2.2.3 基质效应
基质指样品中被分析物以外的组分。基质常常对分析物的分析过程有显著的干扰,并影响分析结果的准确性。基质对分析结果的影响可以通过基质效应(ME)来衡量[16]。污水处理厂进水和珠江河水样品中不同加标浓度下基质效应如图4所示。
从图4可以看出,DB在污水处理厂进水和河水样品中的基质效应(n=3)分别为-23.8%~-12.5%和-16.5% ~ -8.5%。ME均为负数,说明存在基质抑制效应。污水处理厂进水样品的基质抑制效应相比河水样品更大,尤其是在较低浓度时,可能是由于污水处理厂进水基质相比河水更加复杂。而河水样品的ME均小于20%,说明河水样品对该方法的基质干扰较小。
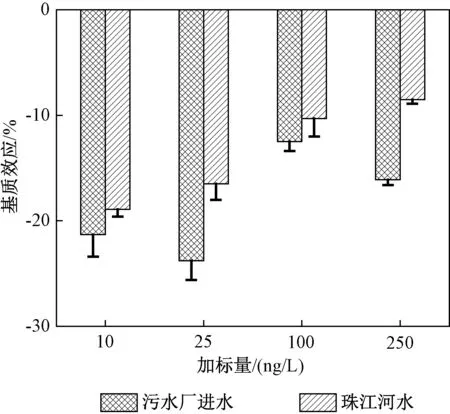
图4 污水处理厂进水和珠江河水样品中不同加标浓度下基质效应Fig.4 Matrix effects of DB in water samplesfrom the influent of a WWTP and the PearlRiver at different spiked levels
2.3 方法检出限与线性范围
方法检出限是指在特定基质中对被分析物能进行可靠确认和定量的最低浓度,且其测定结果应有不低于90%的准确度。通过往7份200 mL空白水样中加入0.1 ng目标物,经过全过程分析,计算得到方法检出限(MDL)[17]为0.07 ng/L,可满足环境水体中痕量苯甲地那铵的检测。
通过测量0.01、0.05、0.1、0.5、1、5、10、20、50 μg/L 9个质量浓度梯度的标准品溶液,建立目标物的标准曲线(内标质量浓度为1 μg/L)。从图5可以看出,标准曲线的相关系数r为0.999,说明DB在该浓度范围内有很好的线性。当DB质量浓度为50 μg/L时,峰高为1.2 × 108,接近检测器的饱和阈值;而当DB质量浓度增加至100 μg/L时,发现检测信号已经发生饱和。如果样品中DB的测量值超过50 μg/L时,可能需要对样品浓度进行稀释后重新测量。因此,DB的线性范围为0.01 ~ 50 μg/L。

图5 标准曲线Fig.5 Standard curve for DB
2.4 环境水样测定
采用该方法测定了3份采集于珠江广州城区段水样中DB的浓度。结果表明DB在3份水样中均被检出,3次全过程重复分析结果分别为(2.8±0.4)、(5.7±0.2)、(4.7±0.2)ng/L。在显著性水平α=0.05时计算的F值均小于临界值,说明3组测量结果的精密度之间无显著性差异。污水处理厂可能是环境中DB的主要来源[11]。因此,未来有必要研究DB在污水处理厂中的分布特征和去除情况。
3 结论
本文建立了一种固相萃取-超高效液相色谱-串联质谱法检测水中DB的方法,该方法准确度高、精密度好,基质效应较小,方法检出限可达痕量级别,可用于准确定量环境水体中的痕量DB。

