气相分子吸收光谱法测定海水中氨氮的干扰因素识别及预处理方法研究
郑鑫吾,封 莉,刘永泽,张立秋,许秀艳,郝 俊
1.北京林业大学,北京市水体污染源控制技术重点实验室,北京 100083 2.北京林业大学环境科学与工程学院,北京 100083 3.中国环境监测总站,国家环境保护环境监测质量控制重点实验室,北京 100012 4.上海安杰环保科技股份有限公司,上海 201906
海水中氨氮含量过高会使海洋水域富营养化,严重破坏和恶化海洋生态环境[1]。因此,准确检测海水中的氨氮是预防、发现和治理海洋生态环境污染的基础和前提[2-3]。海水中氨氮的常用分析方法主要有流动注射比色法[4]、次溴酸盐氧化法[5]、纳氏试剂法[5-6]、气相分子吸收光谱法等,这些分析方法在分析实际海水样品过程中均存在一定的缺点,其中,流动注射比色法显色较慢,操作繁杂;次溴酸盐氧化法的测定范围较窄,高浓度的样品如果稀释测定又会引起稀释误差;纳氏试剂法毒性较大,对环境产生二次污染,且海水浊度高,共存离子种类多、强度大,需要做相关预处理,复杂的操作影响测定结果的准确性,难以适应大量海水样品快速准确的分析要求[7]。气相分子吸收光谱法作为国内自主研发的一种简便、快捷的分析手段,具有分析结果准确、测试成本低等优点。本研究采用气相分子吸收光谱法测定海水中的氨氮,对海水中常见共存离子对氨氮测定的干扰影响进行探究[8],并提出干扰消除的预处理方法,为大量海水样品中氨氮的准确分析检测提供新的方法[9]。
1 材料与方法
1.1 方法原理
在盐酸介质中,次溴酸钾可以将水样中的氨、铵盐氧化为亚硝酸盐,再利用无水乙醇的催化作用将亚硝酸盐快速分解为NO2,在213.5 nm波长处对NO2的吸光度进行监测,吸光度与NO2的浓度符合朗伯-比尔定律,可进一步换算得到待测样品中亚硝酸盐和氨氮的浓度。
1.2 实验仪器和试剂
1.2.1 实验仪器
气相分子吸收光谱仪型号为AJ-3700,上海安杰环保科技股份有限公司。
1.2.2 实验试剂
除另有说明,分析时均使用分析纯化学试剂,实验用水为新制备的去离子水(或无氨水)。
6 mol/L盐酸溶液:浓盐酸与水按体积比1∶1混合均匀而成。
40%氢氧化钠溶液:200 g的NaOH用纯水溶解定容到500 mL。
乙醇-盐酸混合溶液:于1 L容量瓶中,按顺序加入6 mol/L盐酸500 mL、无水乙醇150 mL和去离子水350 mL,充分摇匀,静置2 h以上,储于棕色试剂瓶中低温密封遮光保存。
次溴酸盐母液:2.81 g溴酸钾与30 g溴化钾用水溶解混合定容至500 mL,储于棕色试剂瓶中4 ℃冷藏贮存备用。
次溴酸盐氧化剂:于250 mL棕色容量瓶中,加入100 mL去离子水,吸取3.0 mL次溴酸盐母液及6.0 mL盐酸溶液沿瓶壁缓慢加入,轻微晃动摇匀,立即密塞,于暗处静置 5~10 min,加入冷的100 mL氢氧化钠溶液充分摇匀,待小气泡逸尽后使用。该试剂在室温(不高于28 ℃)下配制。
1 000 mg/L氨氮标准溶液:采用市售或配制[10]。
氨氮质控样:采用市售成品。
1.2.3 仪器条件
Zn空心阴极灯电流为2.5 mA;载气为空气;流量为0.095 L/min;工作波长为213.5 nm;测量方式为峰面积;加热温度为90 ℃。
1.3 实验方法
启动仪器预热30 min,将载流液管路、氧化剂管路分别插入乙醇-盐酸混合溶液和次溴酸盐氧化剂中,再将配置好的氨氮标准溶液放入自动进样器中,在软件上输入标准曲线浓度点及样品编号,仪器自动记录试样的吸光度,并绘制标准曲线,计算相关系数、截距、斜率,实验流程如图1所示。再取7份10 mg/L氨氮标准溶液5 mL,添加常见海水元素进行实验[11],定容至50 mL,每种样品平行测定3次,同步空白试样进行校正,根据标准曲线计算相关数据,判断海水中该离子的浓度是否会影响气相分子吸收光谱法测定氨氮。
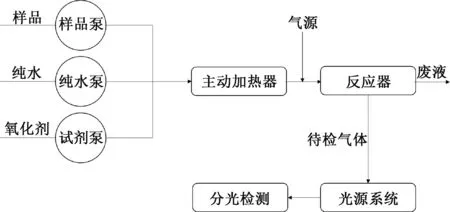
图1 试验流程图Fig.1 Test flow chart
2 结果与讨论
2.1 仪器条件的选择
2.1.1 载气流量的影响
根据第1.3节实验方法,仅改变载气流量,考察不同载气流量(0.089、0.091、0.093、0.095、0.097、0.099、0.101 L/min)条件下3个质量浓度为2.00 mg/L的氨氮标准溶液的测定结果,计算相对标准偏差,结果见表1。
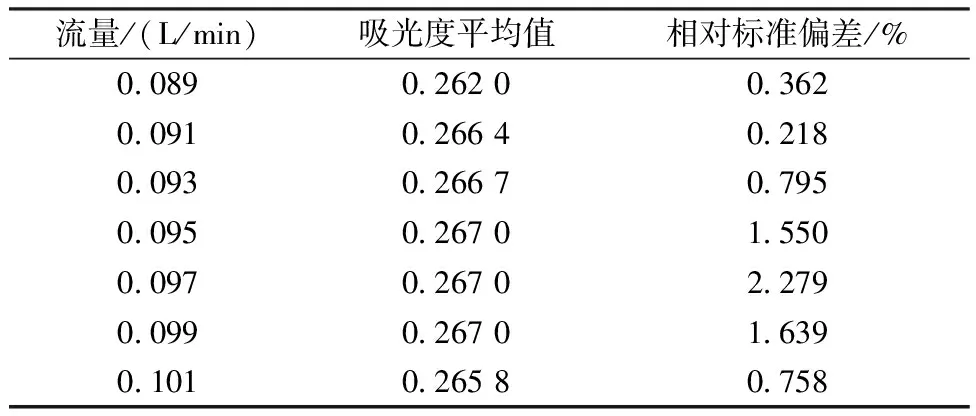
表1 载气流量对氨氮测定结果的影响Table 1 Influence of flow rate on the determinationresult of ammonia nitrogen
由表1可知,当载气流量为0.095~0.099 L/min时,测定结果最大。对比相对标准偏差,载气流量为0.095 L/min时的相对标准偏差较小,说明测定的稳定性重复性较好,因此选择0.095 L/min为测定载气流量。
2.1.2 加热温度的影响
根据第1.3节实验方法,仅改变仪器的加热温度,测定质量浓度为(0.764±0.037)mg/L的质控样(2005112)。加热温度为70~95 ℃,每隔5 ℃对样品重复进行3次测试,结果见表2。
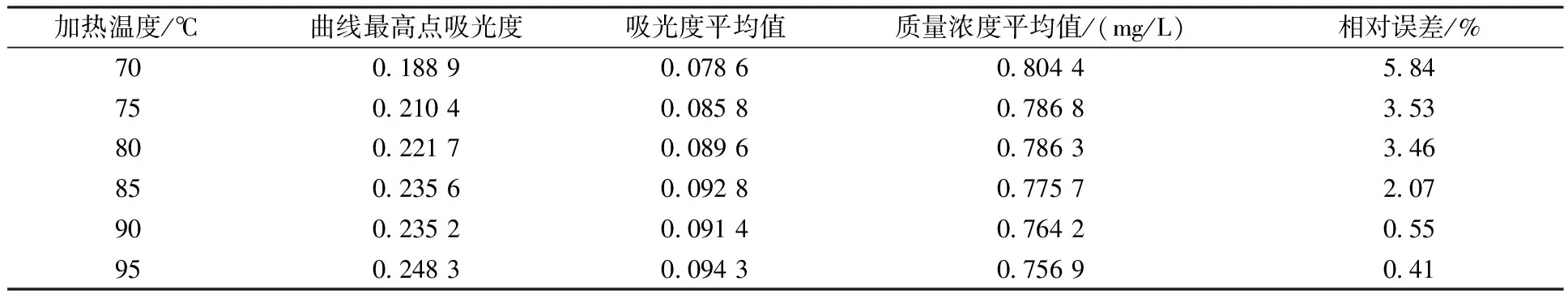
表2 不同加热温度对氨氮测定结果的影响Table 2 The influence of heating temperature on the determination result of ammonia nitrogen
由表2可知,加热温度升高可以提高测定的灵敏度和准确性。综合考虑曲线最高吸光度(灵敏度)和测量结果的相对误差,当加热温度达到85 ℃及以上时,测定结果的灵敏度和准确性都较好。考虑到温度接近水的沸点会加速仪器管路的损坏,确定85~90 ℃为最佳实验温度。
2.1.3 试剂配比的影响
根据第1.3节实验方法,仅改变载流液(乙醇-盐酸混合液)体积配比,对2.00 mg/L的氨氮标准溶液进行测定,结果见表3。
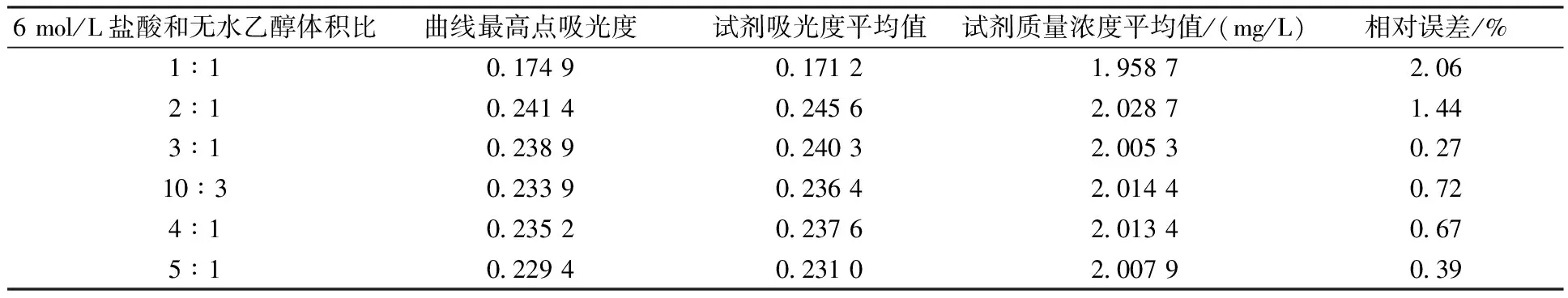
表3 不同载流液体积比对氨氮测定结果的影响Table 3 The influence of carrier liquid volume ratio on the determination result of ammonia nitrogen
通过表3可知,6 mol/L盐酸和无水乙醇体积比为2∶1~4∶1时均满足测试要求。综合考虑测定的灵敏度和测试稳定性,确定载流液中盐酸和无水乙醇的最佳体积比为3∶1。
2.2 方法特性参数的确定
2.2.1 方法检出限
根据有关规定[5],在上述实验条件下测定7个质量浓度为0.02 mg/L的平行样品,计算方法检出限和定量测定下限。结果表明,7个平行样品的测定值分别为0.020 24、0.018 62、0.018 79、0.022 02、0.019 94、0.019 55、0.018 20 mg/L,平均值为0.019 62 mg/L,标准偏差S为0.02 mg/L,T值为3.143,检出限为0.006 mg/L,测定下限为0.024 mg/L。
2.2.2 方法精密度和准确度
根据有关规定,在上述最佳实验条件下,对2种不同浓度的水质样品进行平行测定6次。结果表明,样品1的6个平行样品的测定值分别为0.785 6、0.778 6、0.776 0、0.765 4、0.769 8、0.778 6 mg/L,样品2的6个平行样品的测定值分别为2.022 8、2.007 0、2.018 4、2.023 7、2.016 7 mg/L。统计平行样测定结果的相对标准偏差(RSD)均小于1%,与真值的相对误差(RE)在2%以内,表明方法的精密度和准确度良好。统计结果见表4。

表4 精密度和准确度测试数据Table 4 Precision and Accuracy test data
2.3 共存离子影响
海水中常见离子种类与浓度如表5所示[11-12]。

表5 海水中常见元素离子的浓度Table 5 Concentrations of commonelement ions in seawater
2.3.1 阳离子的影响
分别取7份10 mg/L氨氮标准溶液10 mL,根据表5海水中该元素的离子质量浓度加入不同浓度梯度的Na+、K+、Ca2+、Mg2+,如Na+在海水中质量浓度为10.773 g/L,则加入质量浓度为4、8、12、16、20、24 g/L的Na+溶液,定容至50 mL(此时氨氮含量为2.0 mg/L),平行测定3次质量浓度,所得结果如图2所示。
由图2可得,阳离子的存在会对氨氮的测定产生一定的影响,Na+、K+、Mg2+的存在使测定值产生正偏差,Ca2+则多为负偏差。但是实验所得的测定结果与真值的相对误差均在5%以内。因此,本研究认为这些离子在测定过程中不会干扰氨氮和次溴酸钾氧化剂之间的反应,海水中氨氮的测定结果的影响在可接受范围之内。
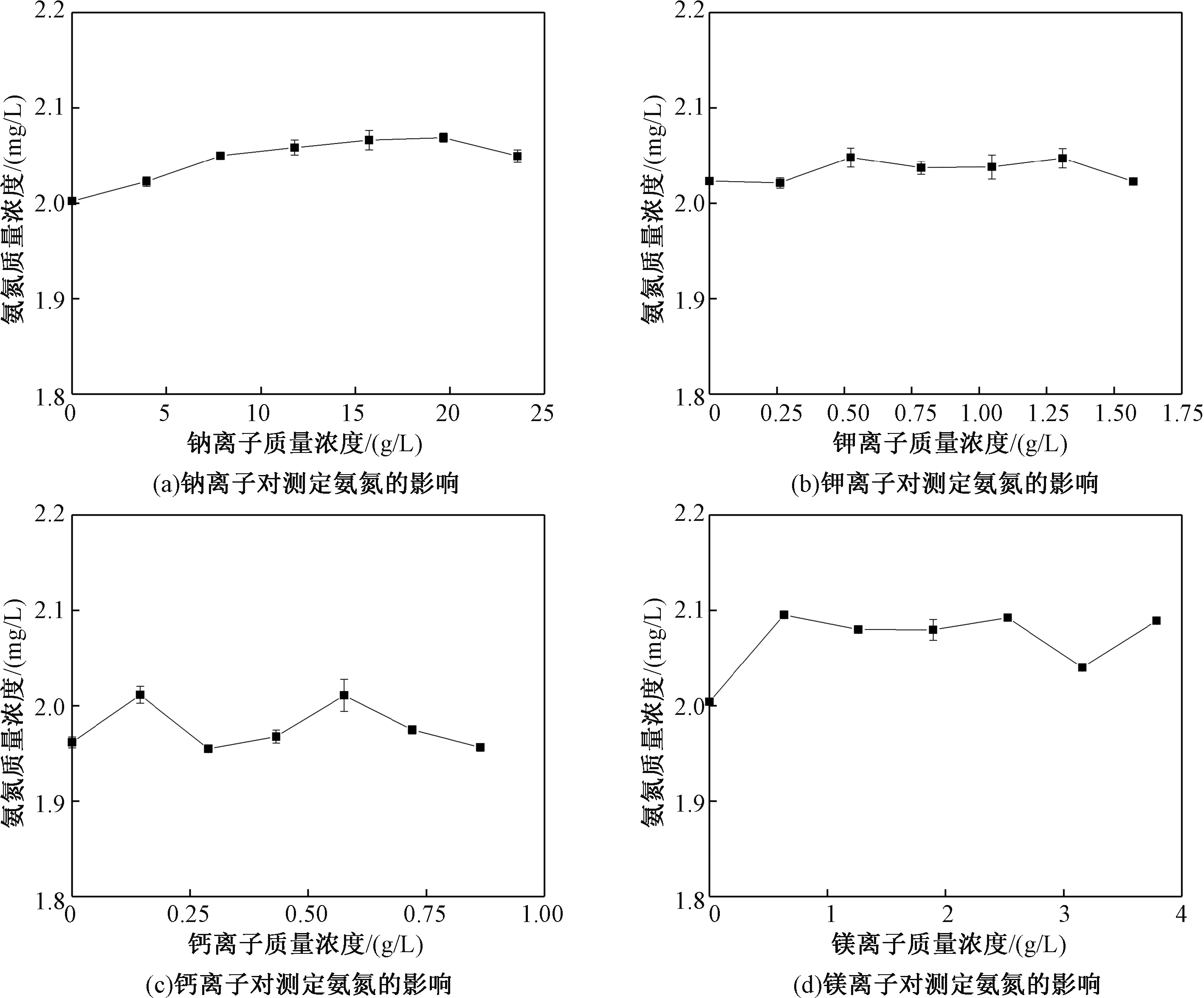
图2 阳离子对测定氨氮的影响Fig.2 The influence of cations on the determination of ammonia nitrogen
2.3.2 常规阴离子的影响


图3 阴离子对测定氨氮的影响Fig.3 The influence of anion on the determination of ammonia nitrogen
2.3.3 碘离子的影响
取8份10 mg/L氨氮标准溶液5 mL,根据表5海水中碘离子质量浓度配制不同浓度梯度的碘离子溶液,定容至50 mL(此时氨氮质量浓度为1.0 mg/L),平行测定3次,氨氮质量浓度平均值有明显变化,因此进一步缩小范围,在适合的质量浓度范围内取20个梯度值重复进行实验,最终得到该离子影响测定的拐点,所得结果如图4所示。
由图4可得,当碘离子共存质量浓度为0.076 5 g/L时,氨氮的测定值开始明显低于真值,随着碘离子浓度的增加,样品的测定结果与真值的相对误差也随之加大。当碘离子质量浓度达到0.191 0 g/L时,下降趋势缓解。分析原因,主要是在测定过程中,碘离子先与次溴酸盐氧化剂发生了氧化反应,导致氨氮未能被氧化成亚硝酸盐,对该方法测定结果有严重的干扰。根据表5海水中碘离子平均质量浓度为0.98 mg/L,大部分海水中碘离子对气相分子吸收光谱法测定海水中氨氮影响较小,但在高盐度海水中或高碘水样中,碘离子依然会对气相分子吸收光谱法测定海水中氨氮产生严重的干扰。

图4 碘离子对测定氨氮的影响Fig.4 The influence of iodide ion on thedetermination of ammonia nitrogen
2.4 干扰离子的消除实验
2.4.1 碘酸钾去除干扰实验
取7份10 mg/L氨氮标准溶液5 mL,加入不同质量浓度梯度的碘离子溶液,定容至50 mL(此时氨氮质量浓度为1 mg/L),测定质量浓度;再重复上述实验,不同的是在溶液中预先加几滴6 mol/L盐酸变为弱酸性溶液,然后再分别加入10.7 g/L碘酸钾5 mL,测定质量浓度,结果见图5。
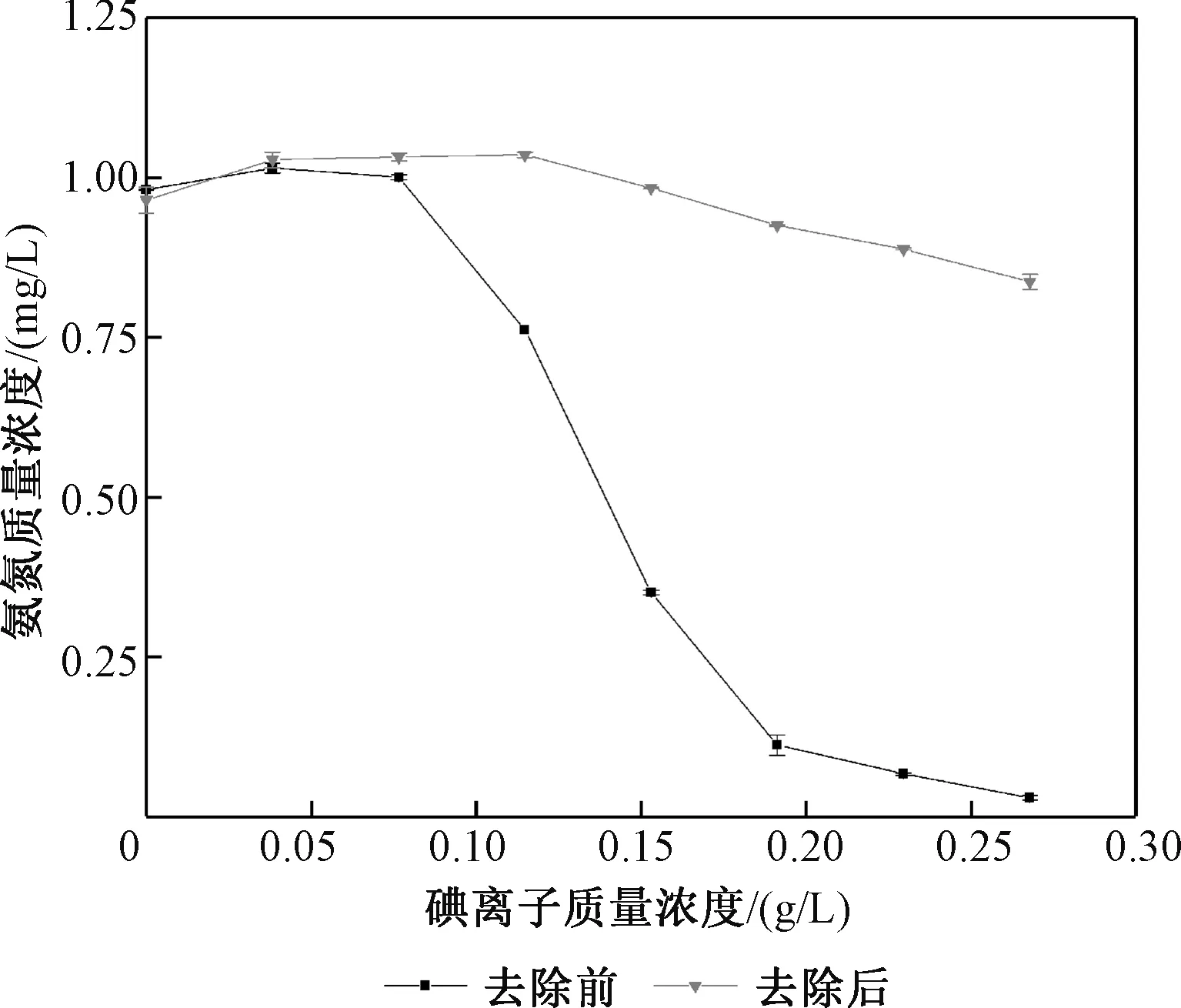
图5 碘酸钾去除碘离子干扰效果图Fig.5 Effects of potassium iodate onremoving the interference of iodine ions
图5显示,在酸性条件下,碘酸钾与碘离子反应生成单质碘,明显去除了碘离子对测定氨氮的干扰。碘离子生成单质碘后不会与次溴酸盐氧化剂发生反应,使氨氮可以正常进行反应和检测。但随着反应的进行,碘单质增多,又会在次溴酸盐氧化剂的碱性条件下发生歧化反应,碘离子进一步干扰测定结果,检测的氨氮质量浓度逐渐下降,但与不预处理相比仍然有着显著的去除效果。
因此,气相分子吸收光谱法在测定海水中氨氮质量浓度时,当碘离子质量浓度达到0.076 5 g/L前,无需预处理且测定结果准确,当质量浓度超过0.076 5 g/L时,在使用该方法测定前,先需要在水样中加入适量的酸和碘酸钾溶液,其浓度配比参考反应方程式,去除水样中的碘离子,再用仪器进行测定。但该预处理方法在高浓度碘离子时效果欠佳,因此提出去除效果更优的硝酸银沉淀法。
2.4.2 硝酸银去除干扰实验
取7份10 mg/L氨氮标准溶液5 mL,加入不同质量浓度梯度的碘离子溶液,定容至50 mL(此时氨氮质量浓度为1 mg/L),测定质量浓度;再重复上述实验,并在溶液中分别加入0.85 g/L硝酸银5 mL,测定质量浓度,结果如图6所示。
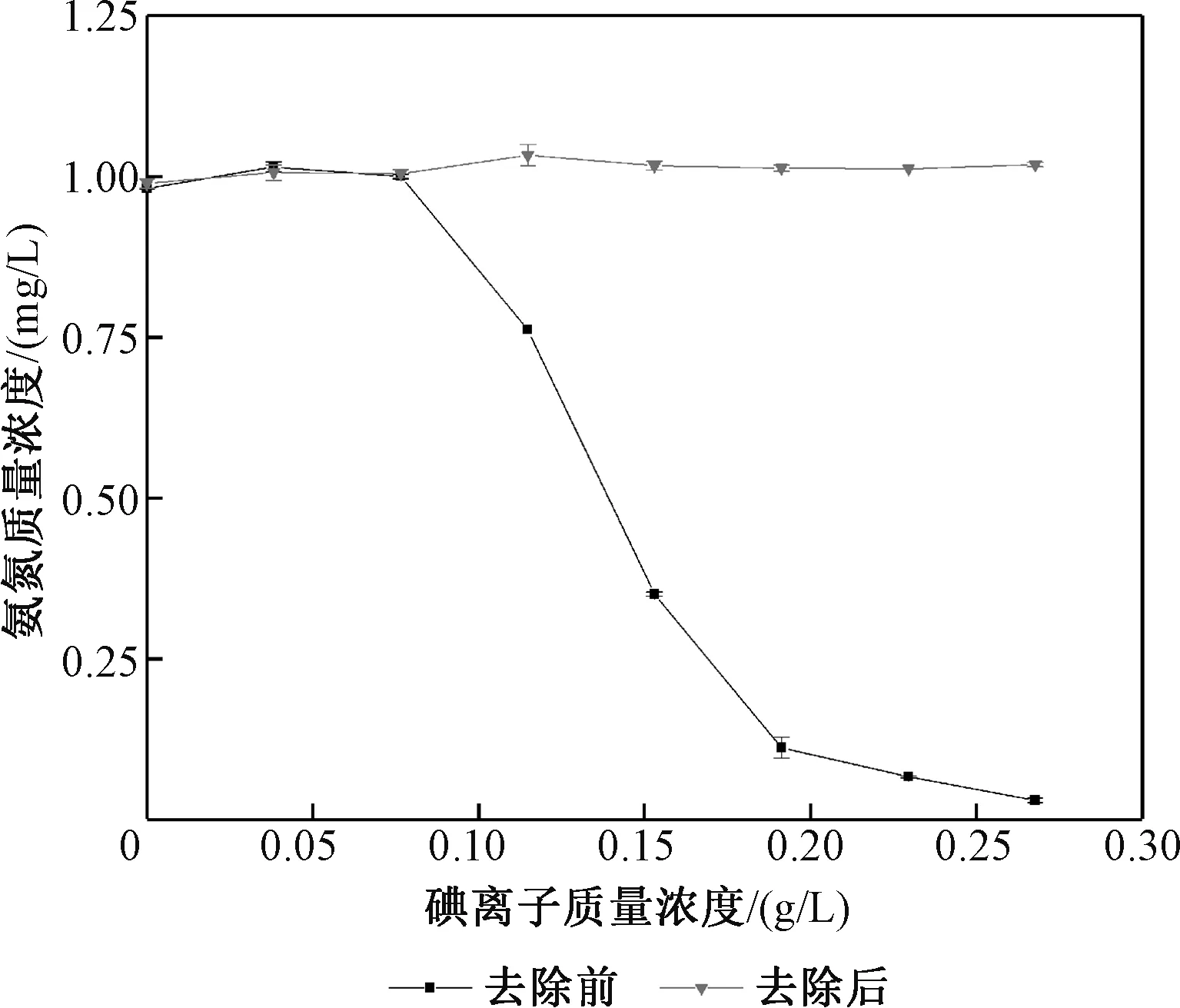
图6 硝酸银去除碘离子干扰效果图Fig.6 Effects of silver nitrate on removingthe interference of iodine ions
图6显示,由于硝酸银可与碘离子反应产生沉淀,可以明显去除碘离子对测定氨氮的干扰,且去除效果优于碘酸钾。在硝酸银过量的情况下,碘化银几乎不溶于水和稀酸,在此反应过程中十分稳定,去除效果也很稳定。
2.4.3 实际水样测定
取6份实际海水样品(东经118.740 8°,北纬39.011 8°,固定剂为硫酸,海水盐度为20.6%),用气相分子吸收光谱法测定氨氮质量浓度,结果表明,6个海水样品的测定值分别为0.076 1、0.080 9、0.084 1、0.084 9、0.082 7、0.083 3 mg/L,平均值为0.082 0 mg/L,标准偏差S为0.003 2 mg/L,相对标准偏差RSD为0.29%。再进行加标回收的测试,结果见表6。

表6 加标回收率测定结果Table 6 Result of spike recovery
3 结论
在使用气相分子吸收光谱法分析海水中的氨氮时,当仪器载气流量选择0.095 L/min、加热温度为85~90 ℃、载流液中盐酸和无水乙醇的体积比为3∶1时,该方法的检出限为0.006 mg/L,准确度和精密度最好,是氨氮分析的最优条件。
海水样品中含有一定量的碘离子时,当碘离子质量浓度达到0.076 5 g/L时,测定的结果与标准值相比开始有明显的下降趋势,且在碘离子质量浓度达到0.191 0 g/L时,下降趋势缓解且氨氮测定值达到检出限;为了使气相分子吸收光谱法满足测定海水中氨氮的需要,可以滴加碘酸钾氧化法或者硝酸银沉淀法等去除碘离子的干扰,后者去除效果更好,检测结果与标准值相同,省去了很多前处理步骤。因此,在现有的方法基础上进行优化,解决了海水离子的影响,使气相分子吸收光谱法可以进行大量海水样品中氨氮的分析,具有一定的推广意义。

