贝伐珠单抗生物类似药和原研药治疗非小细胞肺癌有效性、安全性和免疫原性的Meta分析
陈海韬 杨森森 邓为上 杨昌缘 陈吉生



中圖分类号 R979.1 文献标志码 A 文章编号 1001-0408(2022)08-1003-06
DOI 10.6039/j.issn.1001-0408.2022.08.17
摘 要 目的 比较贝伐珠单抗生物类似药与贝伐珠单抗原研药治疗非小细胞肺癌(NSCLC)的有效性、安全性和免疫原性,为临床用药提供循证参考。方法 计算机检索PubMed、Embase、Web of Science、Cochrane图书馆、中国生物医学文献服务系统、中国知网、维普网、万方数据、ClinicalTrials.gov和中国临床试验中心等数据库,检索时限均为建库起至2021年9月25日。收集贝伐珠单抗生物类似药(试验组)对比贝伐珠单抗原研药(对照组)用于NSCLC的随机对照试验(RCT)。筛选文献、提取资料并采用Cochrane系统评价员手册5.1.0推荐的偏倚风险评估工具对纳入的RCT进行质量评价后,采用RevMan 5.3软件进行Meta分析、敏感性分析和发表偏倚分析。结果 共纳入11项RCT,合计6 596例患者。Meta分析结果显示,两组患者的总有效率[RR=0.97,95%CI(0.92,1.02),P=0.22]、总不良反应发生率[RR=1.00,95%CI(0.99,1.01),P=0.79]、严重不良反应发生率[RR=1.04,95%CI(0.96,1.13),P=0.38]、抗药抗体阳性率[RR=1.10,95%CI(0.88,1.36),P=0.41]及常见不良反应(除呕吐外)发生率(P>0.05)比较,差异均无统计学意义。敏感性分析结果显示,所得结果稳健。发表偏倚分析结果显示,本研究存在发表偏倚的可能性较小。结论 贝伐珠单抗生物类似药治疗NSCLC的有效性、安全性和免疫原性均与贝伐珠单抗原研药相当。
关键词 贝伐珠单抗;生物类似药;原研药;非小细胞肺癌;有效性;安全性;免疫原性;Meta分析
Meta-analysis of efficacy, safety and immunogenicity of bevacizumab biosimilars and original drugs for patients with non-small cell lung cancer
CHEN Haitao,YANG Sensen,DENG Weishang,YANG Changyuan,CHEN Jisheng(Key Specialty of Clinical Pharmacy, the First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou 510080,China)
ABSTRACT OBJECTIVE To compare the efficacy, safety and immunogenicity of bevacizumab biosimilars and original drugs for non-small cell lung cancer (NSCLC), and to provide evidence-based reference for clinical use. METHODS PubMed, Embase, Web of Science, Cochrane Library, CBM, CNKI, VIP, Wanfang database, ClinicalTrials.gov, and Clinical Trial Center of China were searched from the establishment of the database to September 25, 2021, randomized controlled trials (RCTs) about bevacizumab biosimilars (trial group) versus bevacizumab original drugs (control group) for NSCLC were collected. After literature screening, data extraction and quality evaluation of included RCTs with bias risk assessment tool recommended by Cochrane Handbook 5.1.0, meta-analysis, sensitivity analysis and publication bias analysis were performed by using RevMan 5.3 software. RESULTS A total of 11 RCTs were included, involving 6 596 patients in total. Meta-analysis showed that there was no statistical significance in the difference of overall response rate [RR=0.97, 95%CI(0.92, 1.02),P=0.22], the total incidence of adverse reaction [RR=1.00, 95%CI(0.99, 1.01), P=0.79], the incidence of severe adverse reaction [RR=1.04, 95%CI(0.96, 1.13), P=0.38], positive rate of anti-drug antibody [RR=1.10, 95%CI(0.88, 1.36, P=0.41] and the incidence of common adverse reactions (except for vomiting) among 2 groups (P>0.05). The sensitivity analysis results showed that the obtained results were robust. The results of publication bias analysis showed that there was little possibility of publication bias. CONCLUSIONS The efficacy, safety and immunogenicity of bevacizumab biosimilars used for NSCLC are equivalent to those of bevacizumab original drugs.
KEYWORDS bevacizumab; biosimilars; original drugs; non-small cell lung cancer; efficacy; safety; immunogenicity; meta-analysis
贝伐珠单抗是一种重组人源化免疫球蛋白G1(immunoglobulin G1,IgG1)单克隆抗体,可结合血管内皮生长因子(vascular endothelial growth factor,VEGF),阻止其与内皮细胞表面的VEGF-1受体和VEGF-2受体相互作用,从而抑制血管生成,阻止肿瘤生长、发展及转移[1]。根据其作用机制,贝伐珠单抗的临床应用主要集中在由血管生成驱动的、VEGF高表达的、预后较差的或侵袭性更强的实体瘤中,比如非小细胞肺癌(non-small cell lung cancer,NSCLC)、结直肠癌(colorectal cancer,CRC)、乳腺癌(breast cancer,BC)等。贝伐珠单抗原研药(商品名Avastin)分别于2004年2月、2005年1月获得美国食品药品监督管理局(U.S. Food and Drug Administration,FDA)、欧洲药品管理局(European Medicines Agency,EMA)批准上市。作为抗肿瘤血管生成的代表药物,该药现已在全球134个国家上市。贝伐珠单抗是首批抗肿瘤靶向制剂之一,为预后不良的晚期肿瘤患者提供了有效的治疗选择。1997-2019年,全球有超过37 000例患者在临床试验中接受了贝伐珠单抗治疗,同时估计有超过350万例NSCLC等恶性肿瘤患者接受了贝伐珠单抗治疗,提示该药是目前临床应用较广泛、作用特点较明确的血管生成抑制剂[2]。
生物类似药是指在质量、安全性和有效性方面与已获准注册的原研药具有相似性的治疗用生物制品,其在物理、化学和生物特性方面与原研药高度相似,仅允许存在不影响临床安全性和有效性的微小差异[3]。随着贝伐珠单抗原研药的专利到期,国内外涌现出一大批贝伐珠单抗生物类似药,包括俄罗斯的BCD-021、印度的Bevacirel、美国的ABP 215、PF 06439535和我国的QL1101、IBI305,此外还有相关产品正处于研究阶段。截至2021年2月,全球约有30种贝伐珠单抗生物类似药开发、上市,如HLX04、SB8、MYL-1402O、BEVZ92等[4],未来这些药物很可能成为原研药的经济替代品。然而,生物类似药具有分子量大、结构复杂、生物活性对其结构完整的依赖性强、生产工艺复杂等特点,仅能做到与原研药类似,并不能同仿制药一样做到百分百还原[5]。《中国药品综合评价指南参考大纲(第二版)》指出,药品的有效性、安全性等评价主要遵循循证医学的方法,必要时需对纳入的随机对照试验(randomized controlled trials,RCT)进行Meta分析[6],加之目前尚缺乏生物类似药临床使用有效性和安全性数据的积累[7],故有必要采用循证的方法对其进行系统评价。基于此,本研究采用Meta分析的方法比较了贝伐珠单抗生物类似药与其原研药治疗NSCLC的有效性、安全性和免疫原性,旨在为临床用药提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 本研究纳入的研究类型为国内外公开发表的RCT;语种限定为中文和英文。
1.1.2 研究对象 本研究纳入的患者均符合2017年美国癌症联合委员会(American Joint Committee on Cancer,AJCC)发布的相关诊断标准[8],诊断为ⅢB、Ⅳ期或复发性非鳞状NSCLC;性别、种族、国籍均不限;年龄≥18岁。
1.1.3 干预措施 试验组患者给予贝伐珠单抗生物类似药联合卡铂和紫杉醇;对照组患者给予贝伐珠单抗原研药联合卡铂和紫杉醇。
1.1.4 结局指标 本研究的结局指标包括:(1)总有效率(overall response rate,ORR);(2)总不良反应发生率;(3)严重不良反应发生率(导致死亡、危及生命、需要住院或延长住院时间、持续或严重丧失能力或严重干扰正常生活、导致出生缺陷,则视为严重不良反应);(4)常见不良反应发生率(参照药品说明书总结和分类);(5)免疫原性,如抗药抗体(anti-drug antibody,ADA)阳性率。疗效判定标准按照《实体肿瘤的疗效评价标准1.1》(Response Evaluation Criteria in Solid Tumors 1.1, RECIST 1.1)分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病进展(progressive disease,PD)和疾病稳定(stable disease,SD)。CR表示所有靶病灶消失,全部病理淋巴结(包括靶结节和非靶结节)短径减少至10 mm以下;PR表示靶病灶直径之和较基线水平减少≥30%;PD表示以整个试验研究过程中所有测量的靶病灶直径之和的最小值为参照,直径之和增加≥20%(若基线测量值最小,则以基线值为参照)或满足直径之和的绝对值增加≥5 mm(若出现1个或多个新靶病灶也视为PD);SD表示相关指标未达上述标准;ORR=(CR例数+PR例数)/总例数×100%[9]。
1.1.5 排除标准 本研究的排除标准为:(1)患者或干预措施不符合的临床研究;(2)缺少疗效或安全性结果的文献;(3)系统综述或Meta分析、会议摘要、药物经济学研究、信件或评论、病例报告等文献;(4)重复发表的文献。
1.2 文献检索策略
计算机检索PubMed、Embase、Web of Science、Cochrane图书馆、中国生物医学文献服务系统、中国知网、维普网、万方数据,同时检索ClinicalTrials.gov、中国临床试验中心等数据库。中文检索词为“贝伐珠单抗生物类似药/贝伐单抗生物类似药”“原研贝伐珠单抗/原研贝伐单抗/安维汀”“非小细胞肺癌/非鳞状非小細胞肺癌”;英文检索词为“bevacizumab”“biosimilar”“Avastin”“non-small cell lung cancer”“NSCLC”“non squamous non-small cell lung cancer”。同时,手动检索相关文献的参考文献,以获取相关研究。采用主题词与自由词相结合的检索方式。检索时限均为各数据库建库起至2021年9月25日。
以PubMed为例,检索式为(“bevacizumab”[MeSH Terms] OR “bevacizumab”[All Fields] OR “bevacizu- mabs”[All Fields])AND(“biosimilar pharmaceuticals”[MeSH Terms] OR(“biosimilar”[All Fields] AND “pharmaceuticals”[All Fields]) OR “biosimilar pharmaceuticals”[All Fields] OR “biosimilar”[All Fields] OR “biosimilars”[All Fields] OR “biosimilarity”[All Fields]) AND(“non-small-cell”[All Fields] AND(“lung”[MeSH Terms] OR “lung”[All Fields]))。
1.3 文献筛选与资料提取
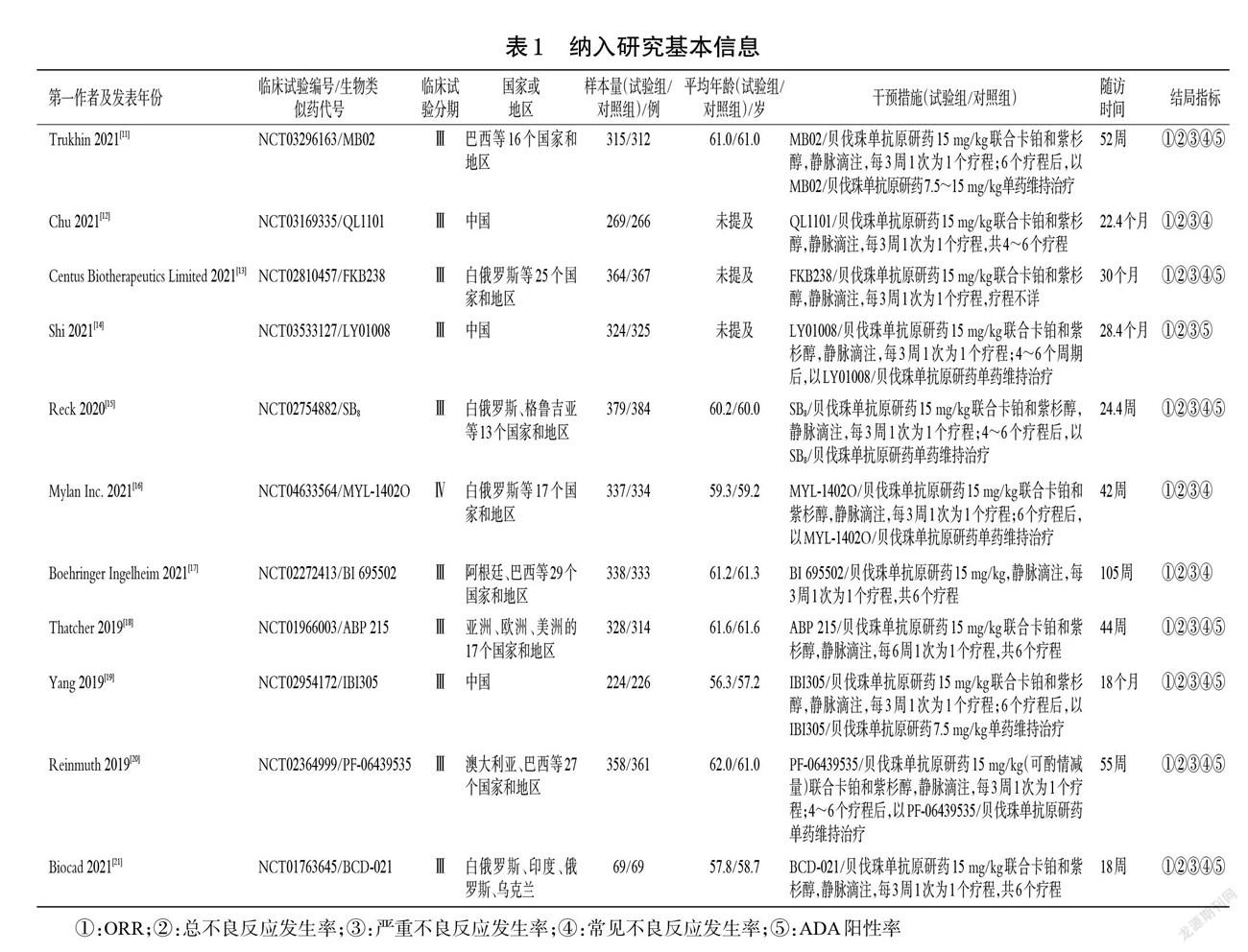
由两名研究者按照纳入与排除标准独立筛选文献,具体步骤为:去除重复文献;阅读标题和摘要,排除明显不符合纳入标准的文献;阅读全文,筛选出符合纳入与排除标准的文献并交叉核对;如遇分歧,则通过内部讨论或由第三名研究者裁决,最终确定纳入的文献。由两名研究者按照预先设计好的表格,独立提取数据,具体包括第一作者、发表年份、临床试验编号/生物类似药代号、国家或地区、临床试验分期、患者例数、年龄、随访时间、干预措施、结局指标等。
1.4 纳入文献质量评价
采用Cochrane系统评价员手册5.1.0推荐的偏倚风险评估工具對纳入文献的质量进行评价,具体包括随机序列的生成、分配序列的隐藏、盲法、结果数据是否完整、是否选择性报告结果、是否存在其他偏倚来源;每个条目分为“低偏倚风险”“高偏倚风险”“不清楚”[10]。
1.5 统计学方法
本研究已在PROSPERO网站(https://www.crd.york.ac.uk/PROSPERO/)注册,编号为CRD42021268664。采用RevMan 5.3软件进行Meta分析。二分类变量采用风险比(risk ratio,RR)及其95%置信区间(confidence interval,CI)表示;以Q检验和I 2检验评估研究间的异质性;若各研究间无统计学异质性(P>0.1,I 2<50%),采用固定效应模型进行Meta分析;反之,则采用随机效应模型进行Meta分析。采用RevMan 5.3软件进行敏感性分析和发表偏倚分析。检验水准α=0.05。
2 结果
2.1 文献筛选结果与纳入研究基本信息
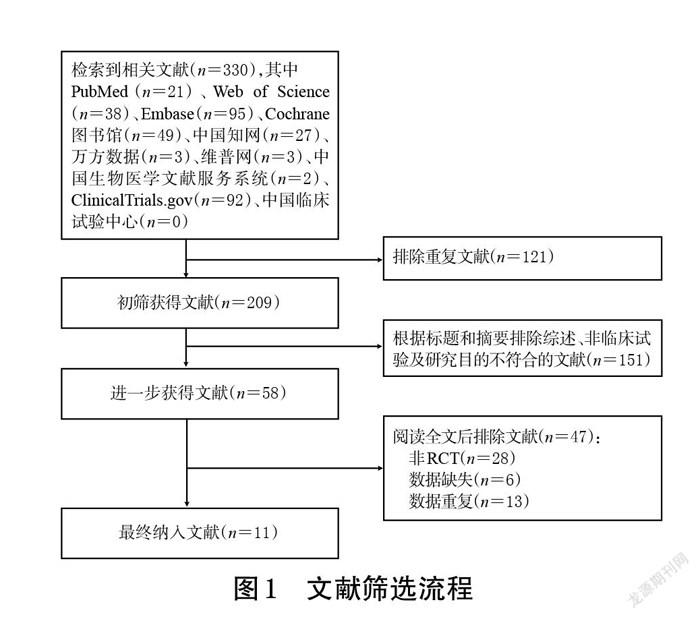
初检共获得相关文献330篇,经阅读标题、摘要及全文后,最终纳入文献11篇[11-21],共计患者6 596例,其中试验组3 305例、对照组3 291例。文献筛选流程见图1,纳入研究基本信息见表1。
2.2 纳入文献的质量评价结果
所有研究均为RCT,均采用随机序列、盲法并隐藏分配序列[11-21],但有2项研究对研究者实施的具体盲法描述不详[15,21];1项研究选择性报告结果[16],2项研究可能存在选择性报告结果的情况[11,21];2项研究对结果评估者实施的具体盲法描述不详[15,20];所有研究的结果数据均完整,但均不清楚是否存在其他偏倚来源[11-21]。结果见图2、图3。
2.3 Meta分析结果
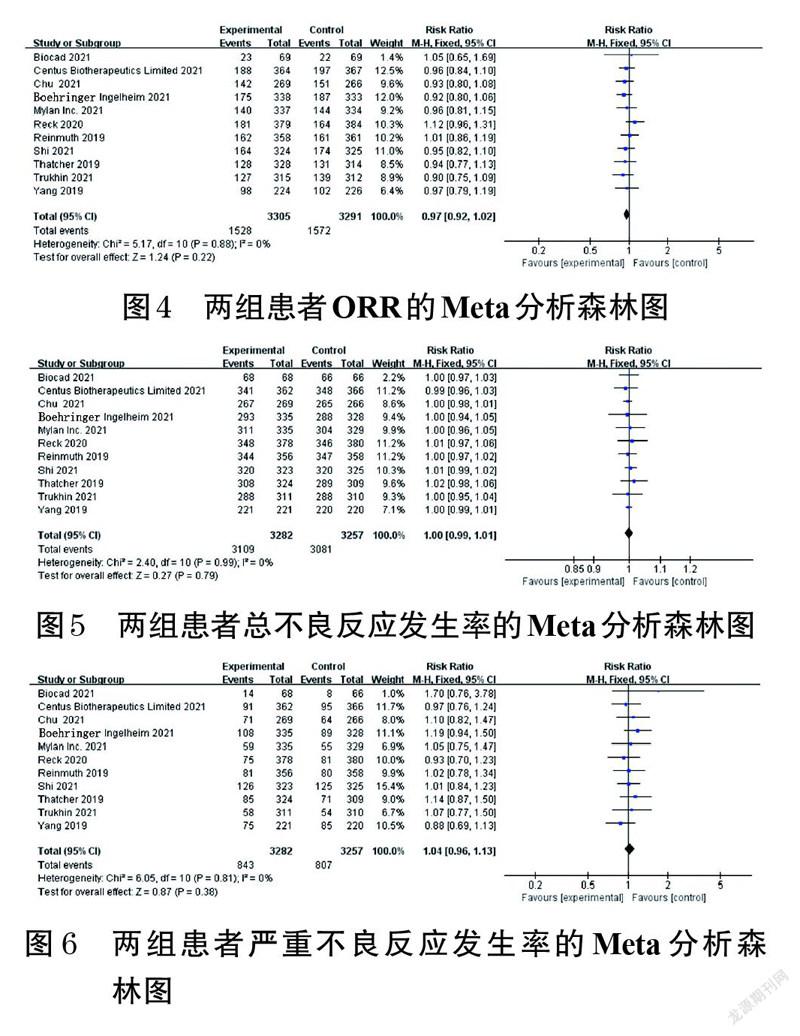
2.3.1 ORR 11项研究报道了患者的ORR[11-21],各研究间无统计学异质性(P=0.88,I 2=0),采用固定效应模型进行Meta分析,详见图4。Meta分析结果显示,两组患者的ORR比较,差异无统计学意义[RR=0.97,95%CI(0.92,1.02),P=0.22]。
2.3.2 总不良反应发生率 11项报道了患者的总不良反应发生率[11-21],各研究间无统计学异质性(P=0.99,I 2=0),采用固定效应模型进行Meta分析,详见图5[因安全性和免疫原性的评估基于安全数据集(safety set,SS),而SS为至少接受1次治疗且有安全性指标记录的实际人群,故图中各研究患者例数与表1不同,下同]。Meta分析结果显示,两组患者的总不良反应发生率比较,差异无统计学意义[RR=1.00,95%CI(0.99,1.01),P=0.79]。
2.3.3 严重不良反应发生率 11项研究报道了患者的严重不良反应发生率[11-21],各研究间无统计学异质性(P=0.81,I 2=0),采用固定效应模型进行Meta分析,详见图6。Meta分析结果显示,两组患者的严重不良反应发生率比较,差异无统计学意义[RR=1.04,95%CI(0.96,1.13),P=0.38]。
2.3.4 常见不良反应发生率 常见不良反应主要为脱发、贫血和中性粒细胞减少等。试验组患者的呕吐发生率显著高于对照组[RR=1.23,95%CI(1.05,1.45),P=0.01],两组患者其余常见不良反应发生率比较差异均无统计学意义(P>0.05)。结果见表2。
2.3.5 ADA阳性率 8项研究报道了患者的ADA阳性率[11,13-15,18-21],各研究间无统计学异质性(P=0.65,I 2=0),采用固定效应模型进行Meta分析,详见图7。Meta分析结果显示,两组患者的ADA阳性率比较,差异无统计学意义[RR=1.10,95%CI(0.88,1.36),P=0.41]。
2.4 敏感性分析
分别以ORR、总不良反应发生率、严重不良反应发生率、常见不良反应发生率、ADA阳性率为指标,逐一剔除文献进行敏感性分析。结果显示,Meta分析结果均未发生显著变化,提示Meta分析结果稳健。
2.5 发表偏倚分析
以ORR为指标绘制倒漏斗图以进行发表偏倚分析。结果显示,各研究散点分布在倒漏斗图的两侧,基本对称,提示本研究存在发表偏倚的可能性较小。结果见图8(以其余指标进行的发表偏倚分析所得结果类似,故图略)。
3 讨论
贝伐珠单抗是抗肿瘤血管生成靶向药物,主要靶点是VEGF受体,通过抑制肿瘤血管生成而抑制肿瘤细胞生长;此外,贝伐珠单抗还可以促进肿瘤血管正常化,增加化疗药物在肿瘤细胞内的药物浓度[22]。该药是首批获准上市的针对NSCLC的靶向治疗药物之一,也是首批帮助该类患者生存期超过1年的化疗药物[23]。欧洲医学肿瘤学会和美国国立综合癌症网络均指出,贝伐珠单抗治疗NSCLC的疗效较好[24-25]。
《生物类似药研发与评价技术指导原则(试行)》指出,生物类似药的研发采用药学、非临床、临床评价逐步递进的全证据方法,以证明其与原研药的相似性,这是生物类似药开发的基础[5]。所有获得各国/各地区药品监管机构批准的贝伐珠单抗生物类似药的RCT均观察到其与原研药的临床结果无显著差异。然而,考虑到RCT样本量的计算通常是基于主要疗效结果,故单个临床试验对次要疗效和安全性的证据可能不足[26]。因此,结合所有可获得的RCT数据,针对主要和次要临床结果,充分证明贝伐珠单抗生物类似药与其原研药的临床可比性是尤为重要的。
ORR是抗肿瘤生物类似药比较研究的临床终点之一,其信息丰富且具有足够的敏感性[26]。本研究结果显示,在有效性方面,两组患者的ORR比较,差异无统计学意义,ORR的敏感性分析结果与Meta分析结果基本一致,未发生反转,同时倒漏斗图显示各研究间无明显发表偏倚,表明ORR的Meta分析结果可靠。本研究结果还显示,在安全性方面,试验组患者的呕吐发生率显著高于对照组;而两组患者其余常见不良反应发生率、总不良反应发生率、严重不良反应发生率比较,差异均无统计学意义。在免疫原性方面,两组患者的ADA阳性率比较,差异无统计学意义。
综上所述,贝伐珠单抗生物类似药治疗NSCLC的有效性、安全性和免疫原性均与其原研药相当。本研究的局限性包括:(1)纳入研究的随访时间不一,导致患者生存结局指标不同,且大多数研究仅提供了生存期的中位值和区间值,故难以评估患者总生存期和无进展生存期等其他疗效指标;(2)仅纳入RCT,其受试者往往经过严格的筛选,具有一定的限制。因此,本研究所得结论尚需更多真实世界证据进一步证实。
参考文献
[ 1 ] SALEEM T,QURASHI H,JAMALI M,et al. Biosimilars as a future,promising solution for financial toxicity:a review with emphasis on bevacizumab[J]. Cureus,2020,12(7):e9300.
[ 2 ] GARCIA J,HURWITZ H I,SANDLER A B,et al. Bevacizumab(Avastin®) in cancer treatment:a review of 15 years of clinical experience and future outlook[J]. Cancer Treat Rev,2020,86:102017.
[ 3 ] 中国临床肿瘤学会(CSCO)抗淋巴瘤联盟.生物类似药临床应用专家共识[J].白血病·淋巴瘤,2021,30(3):129-136.
[ 4 ] Generics and Biosimilar initiative. Biosimilars of bevacizumab[EB/OL].[2021-07-13]. https://gabionline.net/biosi- milars/general/Biosimilars-of-bevacizumab.
[ 5 ] 国家食品药品监督管理总局.生物类似药研发与评价技术指导原则:试行[EB/OL].[2021-07-13]. https://www.dcpc.com/xwzx/zcfg/gjsyjzj/201503/P0201503045414475-
70315.pdf.
[ 6 ] 中國药品综合评价指南项目组.中国药品综合评价指南参考大纲:第二版[J].药品评价,2015,12(8):6.
[ 7 ] 郭瑞臣.抗肿瘤生物类似药的发展与临床应用[J].实用肿瘤杂志,2020,35(4):310-313.
[ 8 ] HODA S A. AJCC cancer staging manua,8th edition[J]. Adv Anat Pathol,2017,24(2):112.
[ 9 ] EISENHAUER E A,THERASSE P,BOGAERTS J,et al. New response evaluation criteria in solid tumours:revised RECIST guideline:version 1.1[J]. Eur J Cancer,2009,45(2):228-247.
[10] HIGGINS J P T,THOMAS J,CHANDLER J,et al. Cochrane handbook for systematic reviews of inter- ventions[EB/OL].[2021-07-13]. https://training.cochrane.org/handbook.
[11] TRUKHIN D,PODDUBSKAYA E,ANDRIC Z,et al. Efficacy,safety and immunogenicity of MB02(bevacizu- mab biosimilar) versus reference bevacizumab in advanced non-small cell lung cancer:a randomized,double-blind,phase Ⅲ study(STELLA)[J]. BioDrugs,2021,35(4):429-444.
[12] CHU T Q,LU J,BI M H,et al. Equivalent efficacy study of QL1101 and bevacizumab on untreated advanced non- squamous non-small cell lung cancer patients:a phase 3 randomized,double-blind clinical trial[J]. Cancer Biol Med,2021,18(3):816-824.
[13] Centus Biotherapeutics Limited. Evaluation of FKB238 and avastin in patients with advanced/recurrent non-squamous non-small cell lung cancer(AVANA)[EB/OL]. [2021-
07-13]. https://clinicaltrials.gov/ct2/show/NCT02810457?term=NCT02810457&draw=2&rank=1.
[14] SHI Y K,LEI K J,JIA Y M,et al. Bevacizumab biosimilar LY01008 compared with bevacizumab(Avastin) as first- line treatment for Chinese patients with unresectable,me- tastatic,or recurrent non-squamous non-small-cell lung cancer:a multicenter,randomized,double-blinded,phase Ⅲ trial[J]. Cancer Commun(Lond),2021,41(9):889-903.
[15] RECK M,LUFT A,BONDARENKO I,et al. A phase Ⅲ,randomized,double-blind,multicenter study to compare the efficacy,safety,pharmacokinetics,and immunogenicity between SB8(proposed bevacizumab biosimilar) and reference bevacizumab in patients with metastatic or recurrent nonsquamous non-small cell lung cancer[J]. Lung Cancer,2020,146:12-18.
[16] Mylan Inc.. MYL-1402O compared with Avastin®,in patients with stage Ⅳ nsNSCLC[EB/OL]. [2021-07-13].https://clinicaltrials.gov/ct2/show/results/NCT04633564?id=NCT02754882+OR+NCT04633564&draw=2&rank=
1&load=cart.
[17] Boehringer Ingelheim. Phase Ⅲ trial BI 695502 plus chemotherapy vs. Avastin® plus chemotherapy in patients with lung cancer[EB/OL].[2021-07-13]. https://clinical- trials.gov/ct2/show/NCT02272413?term=NCT02272413&
draw=2&rank=1.
[18] THATCHER N,GOLDSCHMIDT J H,THOMAS M,et al. Efficacy and safety of the biosimilar ABP 215 compared with bevacizumab in patients with advanced nonsquamous non-small cell lung cancer(MAPLE):a rando- mized,double-blind,phase Ⅲ study[J]. Clin Cancer Res,2019,25(7):2088-2095.
[19] YANG Y P,WU B,HUANG L N,et al. Biosimilar can- didate IBI305 plus paclitaxel/carboplatin for the treatment of non-squamous non-small cell lung cancer[J]. Transl Lung Cancer Res,2019,8(6):989-999.
[20] REINMUTH N,BRYL M,BONDARENKO I,et al. PF-06439535(a bevacizumab biosimilar) compared with reference bevacizumab(Avastin®),both plus paclitaxel and carboplatin,as first-line treatment for advanced non-squamous non-small-cell lung cancer:a randomized,double-blind study[J]. Bio Drugs,2019,33(5):555-570.
[21] Biocad. A safety and efficacy study of BCD-021 with paclitaxel and carboplatin compared to avastin with paclitaxel and carboplatin in non-small cell lung cancer[EB/OL].[2021-
07-13]. https://clinicaltrials.gov/ct2/show/NCT01763645?term=NCT01763645&draw=2&rank=1.
[22] 毕明宏.贝伐珠单抗治疗非小细胞肺癌进展[J].临床肺科杂志,2018,23(10):1909-1914.
[23] SANDLER A,GRAY R,PERRY M C,et al. Paclitaxel- carboplatin alone or with bevacizumab for non-small-cell lung cancer[J]. N Engl J Med,2006,355(24):2542-2550.
[24] PLANCHARD D,POPAT S,KERR K,et al. Correction to:“metastatic non-small cell lung cancer:ESMO clinical practice guidelines for diagnosis,treatment and follow-up”
[J]. Ann Oncol,2019,30(5):863-870.
[25] ETTINGER D S,AISNER D L,WOOD D E,et al. NCCN guidelines insights:non-small cell lung cancer,version 5.2018[J]. J Natl Compr Canc Netw,2018,16(7):807-821.
[26] CARGNIN S,SHIN J I,GENAZZANI A A,et al. Compa- rative efficacy and safety of trastuzumab biosimilars to the reference drug:a systematic review and meta-analysis of randomized clinical trials[J]. Cancer Chemother Pharmacol,2020,86(5):577-588.
(收稿日期:2021-09-17 修回日期:2022-02-23)
(編辑:陈 宏)

