曲妥珠单抗联合化疗致心脏毒性的影响因素分析
朱小丽 吕琛 杜雪亭 焦甲勋 高玲娜 孙霞 马红芳

中圖分类号 R969.3;R730.5 文献标志码 A 文章编号 1001-0408(2022)08-0992-04
DOI 10.6039/j.issn.1001-0408.2022.08.15
摘 要 目的 分析曲妥珠单抗联合化疗致人表皮生长因子受体2(HER-2)阳性乳腺癌患者心脏毒性的影响因素。方法 选取在我院2017年4月-2021年1月接受吡柔比星+环磷酰胺序贯紫杉醇+曲妥珠单抗治疗的HER-2阳性乳腺癌患者200例,根据有无发生心脏毒性分为发生心脏毒性组和未发生心脏毒性组。收集患者的临床资料及超声心动图检查结果,分析患者发生心脏毒性的影响因素。结果 200例乳腺癌患者中,发生心脏毒性的有43例,发生率为21.5%。其中,吡柔比星+环磷酰胺治疗期间出现心脏毒性的患者占5.5%(11/200),序贯紫杉醇+曲妥珠单抗治疗期间出现心脏毒性的患者占20.5%(41/200),后者显著高于前者(P<0.01)。同时,序贯紫杉醇+曲妥珠单抗治疗期间患者左室射血分数降低幅度显著高于吡柔比星+环磷酰胺治疗期间[14%(12%,17%) vs. 7%(3%,10%),P<0.001]。与未发生心脏毒性的患者相比,发生心脏毒性患者中有高脂血症史的占比显著升高(P<0.01),而使用右雷佐生的占比显著降低(P<0.01)。二分类Logistic回归分析结果显示,患者高脂血症史[OR=3.672,95%CI(1.499,8.992),P=0.004]、右雷佐生使用情况[OR=0.154,95%CI(0.072,0.330),P<0.001]与心脏毒性的发生相关。结论 高脂血症史是HER2阳性乳腺癌患者接受吡柔比星+环磷酰胺序贯紫杉醇+曲妥珠单抗致心脏毒性的独立危险因素,而使用右雷佐生则是保护因素。
关键词 吡柔比星;曲妥珠单抗;心脏毒性;人表皮生长因子受体2阳性乳腺癌;影响因素
Analysis of influential factors of cardiotoxicity induced by trastuzumab combined with chemotherapy
ZHU Xiaoli1,LYU Chen2,DU Xueting1,JIAO Jiaxun3,GAO Lingna1,SUN Xia4,MA Hongfang1(1. Dept. of Pharmacy, the People’s Hospital of Hengshui, Hebei Hengshui 053000, China; 2. Dept. of Medical Oncology, the People’s Hospital of Hengshui, Hebei Hengshui 053000, China; 3. Dept. of Osteooncology, the People’s Hospital of Hengshui, Hebei Hengshui 053000, China; 4. Dept. of Ultrasound, the People’s Hospital of Hengshui, Hebei Hengshui 053000, China)
ABSTRACT OBJECTIVE To analyze the influential factors of cardiotoxicity in patients with positive breast cancer of human epidermal growth factor receptor 2 (HER-2) treated by trastuzumab combined with chemotherapy. METHODS From April 2017 to January 2021, 200 HER-2 positive breast cancer patients receiving pirarubicin+cyclophosphamide combined with sequential paclitaxel+trastuzumab were collected from our hospital. According to the presence or absence of cardiotoxicity, the patients were divided into cardiotoxicity group and non-cardiotoxicity group. The clinical data and echocardiographic results of the patients were collected, and the influential factors of cardiotoxicity were analyzed. RESULTS Among 200 patients, 43 patients suffered from cardiotoxicity with the incidence of 21.5%. The proportion of patients with cardiotoxicity during pirarubicin+cyclophosphamide therapy accounted for 5.5% (11/200), and the proportion of patients with cardiotoxicity during sequential paclitaxel+trastuzumab therapy accounted for 20.5% (41/200); the latter was significantly higher than the former (P<0.01). At the same time, the decrease of left ventricular ejection fraction during sequential therapy of paclitaxel and trastuzumab was significantly higher than that during pirarubicin+cyclophosphamide therapy [14%(12%,17%) vs. 7%(3%,10%), P<0.001]. Compared with patients without cardiotoxicity, the proportion of patients with cardiotoxicity with a history of hyperlipidemia was significantly higher (P<0.01), while the proportion of patients receiving dexrazoxane was significantly lower (P<0.01). Results of binary Logistic regression analysis showed that the history of hyperlipidemia [OR=3.672,95%CI(1.499,8.992),P=0.004] and the use of dextrazoxane [OR=0.154,95%CI(0.072,0.330),P<0.001] were associated with the occurrence of cardiotoxicity. CONCLUSIONS Hyperlipidemia is an independent risk factor for cardiotoxicity induced by pirarubicin+cyclophosphamide combined with sequential paclitaxel+trastuzumab in HER2 positive breast cancer patients, while the use of dextrazoxane is a protective factor.
KEYWORDS pirarubicin; trastuzumab; cardiotoxicity; positive breast cancer of human epidermal growth factor receptor 2; influential factors
世界卫生组织发布的2020年全球癌症最新数据显示,乳腺癌新发病例数居于恶性肿瘤首位[1]。有研究指出,有20%~25%的乳腺癌患者存在人表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)过度表达[2]。目前,蒽环类药物序贯曲妥珠单抗是HER-2阳性乳腺癌患者辅助化疗的标准方案之一,但蒽环类药物的心脏毒性不容忽视,加之靶向药物曲妥珠单抗亦存在一定的心脏毒性,故相关指南建议两者不能同时应用[3]。此外,关于蒽环类药物序贯曲妥珠单抗时两种药物心脏毒性是否叠加尚存争议[4-5]。为此,本研究收集了我院HER-2阳性乳腺癌患者在吡柔比星+环磷酰胺(以下简称“AC”)序貫紫杉醇+曲妥珠单抗(以下简称“TH”)治疗过程中心脏毒性的发生情况,分析该方案致心脏毒性发生的影响因素,以期尽早对可能出现的心脏毒性进行干预,从而提高患者的存活率及生存质量。
1 资料与方法
1.1 研究对象
选取2017年4月-2020年1月在我院接受治疗的HER-2阳性乳腺癌患者200例,纳入标准包括:(1)经组织病理学确诊为乳腺癌,且免疫组化/荧光原位杂交试验结果显示HER-2阳性;(2)接受AC序贯TH治疗方案,同时未接受放疗;(3)无器质性心脏病史,化疗前超声心动图未见异常。排除标准包括:(1)伴有其他恶性肿瘤者;(2)由于疾病进展更换其他治疗方案或死亡者;(3)因主观或客观原因未能完成超声心动图监测者;(4)使用其他明确能够导致心脏毒性的药物者。
1.2 治疗方法
所有患者均接受AC序贯TH治疗方案,具体剂量按体表面积/体质量计算:注射用盐酸吡柔比星[瀚晖制药有限公司,国药准字H20045983,规格10 mg(以C32H37NO12计)]50 mg/m2+注射用环磷酰胺[江苏恒瑞医药股份有限公司,国药准字H32020857,规格0.2 g(以C7H15C12N2O2P计)]600 mg/m2,均于化疗第1天静脉滴注给药,每21天为1个周期,共治疗4个周期;随后序贯紫杉醇注射液(辰欣药业股份有限公司,国药准字H20057404,规格5 mL ∶ 30 mg)175 mg/m2,于化疗第1天静脉滴注给药,每14天为1个周期,共治疗4个周期+注射用曲妥珠单抗[美国Genentech Inc.公司,国药准字J20180073,规格440 mg(20 mL)/瓶]首次8 mg/kg,再次6 mg/kg,于化疗第1天静脉注射给药,每21天为1个周期,共治疗17个周期。注射用右雷佐生(江苏奥赛康药业有限公司,国药准字H20061157,规格250 mg)的剂量为吡柔比星剂量的10倍,在吡柔比星使用前30 min静脉注射。
1.3 观察指标
(1)分别在入组前、AC治疗(4周期)后、TH治疗(第3、6、9、12个月)后,由超声科主任医师对所有患者进行超声心动图检查,测量其左室射血分数(left ventricular ejection fraction,LVEF),判断心脏毒性发生情况,并分为发生心脏毒性组和未发生心脏毒性组。心脏毒性诊断标准如下:①LVEF降低的心肌病,表现为整体功能降低或室间隔运动明显降低;②充血性心力衰竭(congestive heart failure,CHF)相关的症状;③CHF相关的体征,如第三心音奔马律、心动过速,或两者都有;④LVEF较基线降低至少5%至绝对值<55%,伴随有CHF症状或体征,或LVEF降低至少10%至绝对值<55%,未伴随有CHF症状或体征[6]。本研究通过衡水市人民医院医学伦理委员会审核通过(批件号2020-3-010)。(2)以入组前LVEF为基线,针对发生心脏毒性的患者,计算其AC治疗期间和TH治疗期间LVEF的变化情况。(3)收集患者的临床资料,包括年龄、体质量指数(body mass index,BMI)、肿瘤分期、既往病史(高血压病史、糖尿病史、高脂血症史)、吸烟史、饮酒史、雌/孕激素状态、吡柔比星累积剂量以及右雷佐生使用情况。
1.4 统计学方法
采用SPSS 25.0软件进行统计分析。符合正态分布的计量资料以x±s表示,采用t检验;非正态分布的计量资料以M(P25,P75)表示,采用Wilcoxon符号秩检验。计数资料以例数或率表示,所有患者TH治疗前后心脏毒性发生情况比较采用配对χ 2检验,组间比较采用χ 2检验或Fisher确切概率法。将组间比较差异有统计学意义的指标纳入二分类Logistic回归分析以探讨AC序贯TH治疗方案致心脏毒性发生的影响因素。检验水准α=0.05。
2 结果
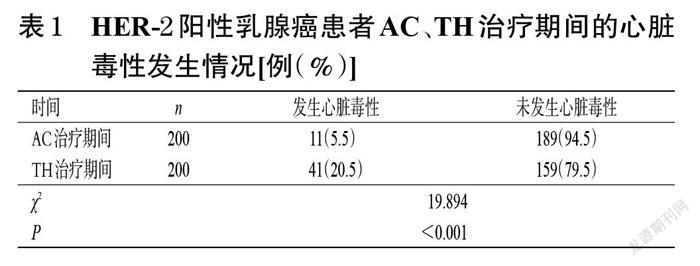
2.1 心脏毒性发生情况
在纳入的200例HER-2阳性乳腺癌患者中,出现心脏毒性的有43例,心脏毒性发生率为21.5%。其中,在AC治疗期间及TH治疗期间均发生心脏毒性的有9例,仅在TH治疗后发生心脏毒性的有32例,仅在AC治疗期间发生心脏毒性的有2例。TH治疗期间患者的心脏毒性发生率为20.5%(41/200),显著高于AC治疗期间的5.5%(11/200)(P<0.01),详见表1。参照不良事件通用术语标准(Common Terminology Criteria for Adverse Event,CTCAE)4.0版,所有发生心脏毒性患者均为Ⅱ级,包括LVEF降低且伴CHF相关症状的3例,LVEF降低但无相关症状的40例。由于心脏毒性的出现,4例患者中断了曲妥珠单抗的后续治疗,其余39例患者的LVEF均在停药后4~8周时恢复至满足用药标准后继续治疗,针对心脏毒性并未给予特殊的药物治疗。
以化疗前LVEF值为基线,比较发生心脏毒性的43例患者的LVEF降低幅度,AC治疗期间LVEF降低幅度为7%(3%,10%),TH治疗期间LVEF降低幅度为14%(12%,17%),TH治疗期间LVEF降低幅度显著高于AC治疗期间(Z=-5.310,P<0.001)。
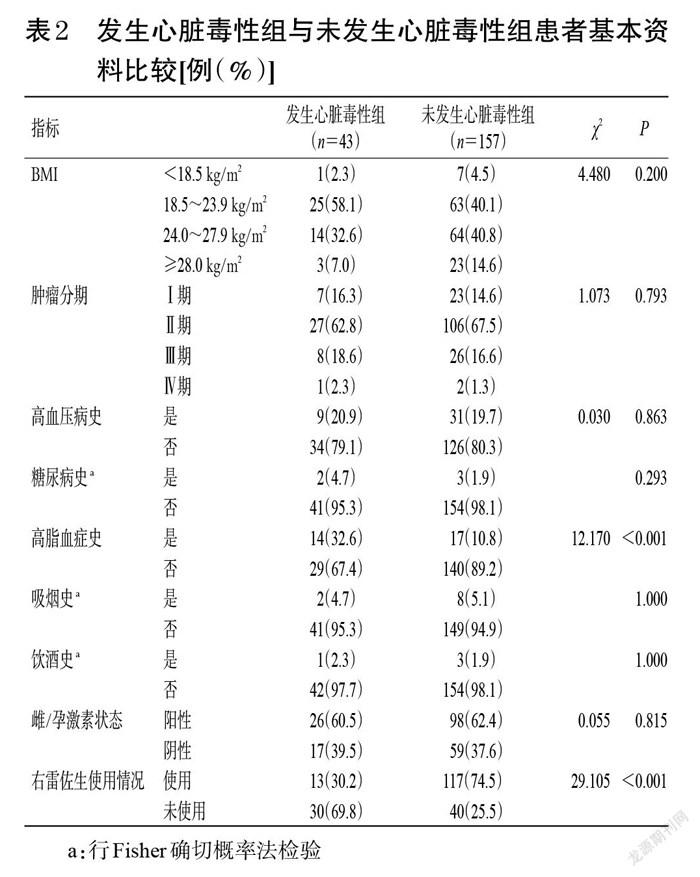
2.2 发生心脏毒性组与未发生心脏毒性组患者临床资料比较
发生心脏毒性组与未发生心脏毒性组患者的年龄分别为(52.98±7.54)岁和(51.73±8.89)岁,两者比较差异无统计学意义(t=0.843,P=0.400);吡柔比星累积剂量分别为320(320,320)、320(320,360)mg/m2,两者比较差异无统计学意义(Z=-1.274,P=0.203)。发生心脏毒性组中有高脂血症史的患者占比显著高于未发生心脏毒性组(P<0.01),使用右雷佐生的患者占比显著低于未发生心脏毒性组(P<0.01),而两组患者的BMI、肿瘤分期、高血压病史、糖尿病史、吸烟史、饮酒史、雌/孕激素状态等比较差异均无统计学意义(P>0.05),详见表2。
a:行Fisher确切概率法检验
2.3 AC序贯TH治疗方案致心脏毒性的影响因素分析
以高脂血症史(无高脂血症史=0,有高脂血症史=1)、右雷佐生使用情况(未使用右雷佐生=0,使用右雷佐生=1)为自变量,以是否发生心脏毒性为因变量(未发生心脏毒性=0,发生心脏毒性=1),进行二分类Logistic回归分析。结果显示,高脂血症史[比值比(odd rate,OR)=3.672,95%置信区间(confidence interval,CI)(1.499,8.992),P=0.004)]、右雷佐生使用[OR=0.154,95%CI(0.072,0.330),P<0.001]与AC序贯TH治疗方案致心脏毒性的发生有关,详见表3。
3 讨论
3.1 蒽环类药物与曲妥珠单抗致心脏毒性的叠加作用
蒽环类药物与曲妥珠单抗均具有心脏毒性。蒽环类药物的心脏毒性与细胞损伤有关,具有不可逆性和剂量依赖性;而曲妥珠单抗的心脏毒性主要是导致心脏功能障碍,该毒性可逆且与剂量无关[7]。在一项纳入8 812例乳腺癌患者的队列研究中,与只接受蒽环类药物化疗的一般患者相比,同时接受曲妥珠单抗治疗的HER-2阳性乳腺癌患者的心力衰竭发生风险显著增加[OR=1.9,95%CI(1.2,3.3),P=0.01][8]。有研究显示,曲妥珠单抗单药治疗组患者的心脏毒性发生率为2%~7%,曲妥珠单抗联合紫杉醇组患者的心脏毒性发生率为2%~13%,蒽环类药物联合曲妥珠单抗组患者的心脏毒性发生率为28%[9]。本研究中,AC序贯TH治疗期间患者的心脏毒性总发生率为21.5%,其中TH治疗期间患者的发生率(20.5%)显著高于AC治疗期间的发生率(5.5%),与上述文献结果一致。这提示蒽环类药物与紫杉醇和曲妥珠单抗的心脏毒性可能是有叠加的。目前,蒽环类药物致心脏毒性的机制尚未完全确定,可能与蒽醌基团产生超氧离子从而导致亚硝化应激反应和线粒体功能障碍相关,也可能与心肌细胞的神经调节蛋白1/酪氨酸激酶受体受损相关[10-11]。曲妥珠单抗导致心脏毒性的機制最可能是干扰了心肌细胞的神经调节蛋白1/酪氨酸激酶受体的信号转导,使心肌细胞的防御功能和能量代谢发生了障碍[12]。考虑到蒽环类药物和曲妥珠单抗均可对神经调节蛋白1/酪氨酸激酶受体产生影响,笔者认为这可能是两者心脏毒性叠加的原因[13]。
3.2 高脂血症史对AC序贯TH治疗方案致心脏毒性的影响
吴玉婷等[14]研究显示,高脂血症史为表柔比星化疗后乳腺癌患者发生心脏毒性的独立危险因素[OR=3.864,95%CI(2.073,7.201),P<0.001]。Kaboré等[15]研究发现,高脂血症史与蒽环类药物治疗患者心脏毒性的发生率显著相关[OR=2.46,95%CI(0.97,6.23),P<0.05]。本研究二分类Logistic回归分析显示,高脂血症史患者心脏毒性的发生率为无高脂血症史患者的3.672倍,因此高脂血症史为AC序贯TH治疗方案致心脏毒性的独立危险因素,与上述文献研究结论一致。笔者分析原因可能是既往高脂血症能够导致心血管部位的脂质沉积及心肌细胞间质的纤维化,增加患者心血管疾病的发生率[16]。
3.3 右雷佐生使用情况对AC序贯TH治疗方案致心脏毒性的影响
右雷佐生为乙二胺四乙酸的环状衍生物,是一种强效金属离子螯合剂,能够在细胞内转变为开环螯合剂,从而干扰由铁离子介导的自由基的形成[17]。右雷佐生在1995年7月获美国食品药品监督管理局(U.S. Food and Drug Administration,FDA)批准作为多柔比星治疗致心脏毒性的保护药,是目前唯一在药品说明书中明确指出能够降低多柔比星致心脏毒性发生率或减轻心脏毒性严重程度的药物,且国内外相关指南均推荐使用右雷佐生来降低蒽环类药物的心脏毒性[18-19]。王子红[20]研究显示,在吡柔比星、环磷酰胺和紫杉醇化疗方案的基础上给予右雷佐生治疗后,乳腺癌患者的心脏毒性发生率(11.5%)低于未给予右雷佐生者(24.4%)。本研究显示,使用右雷佐生者的心脏毒性发生率为未使用右雷佐生者的0.154倍,因此使用右雷佐生为AC序贯TH治疗方案致心脏毒性发生的保护因素。
本研究通过分析AC序贯TH治疗期间HER-2阳性乳腺癌患者的临床资料发现,蒽环类药物与紫杉醇和曲妥珠单抗联合应用可能会出现心脏毒性的叠加,高脂血症史为该治疗方案的独立危险因素,使用右雷佐生则为保护因素。对于HER-2阳性乳腺癌患者,若既往有高脂血症,建议选择相关指南推荐的不含蒽环类药物的一线治疗方案,并尽早使用右雷佐生进行心脏保护,从而提高患者存活率及生存质量。但本研究为单中心单臂描述性研究,样本例数较少,可能导致分析结果出现偏倚。在今后的工作中,需要进一步进行多中心和大样本量的研究。
参考文献
[ 1 ] 刘宗超,李哲轩,张阳,等. 2020全球癌症统计报告解读[J/OL].肿瘤综合治疗电子杂志,2021,7(2):1-14[2022-
03-17]. https://kns.cnki.net/kcms/detail/detail.aspx?FileName=ZLZD202102001&DbName=CJFQ2021. DOI:10.
12151/JMCM.2021.02-01.
[ 2 ] SUN Y,LI W Q,LI A J,et al. Increased systemic immune- inflammation index independently predicts poor survival for hormone receptor-negative,HER2-positive breast cancer patients[J]. Cancer Manag Res,2019,11:3153-3162.
[ 3 ] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范:2019年版[J].中国癌症杂志,2019,29(8):609-679.
[ 4 ] 孟文静,张继博,李淑芬,等.曲妥珠单抗治疗185例HER2阳性乳腺癌患者的心脏安全性评价[J].肿瘤防治研究,2018,45(2):86-90.
[ 5 ] 沈松杰,徐颖,孙强,等.曲妥珠单抗联合蒽环类药物同步应用于乳腺癌的辅助治疗[J].中华肿瘤杂志,2014,36(2):132-136.
[ 6 ] 胡志强,余文韬,姚文秀,等.抗肿瘤药物致心脏毒性及其防治措施的研究进展[J].中国药房,2020,31(2):250-256.
[ 7 ] 杨艺琦,吴昊.乳腺肿瘤心脏病学的研究现状与争议[J]. 中国癌症杂志,2020,30(6):475-480.
[ 8 ] BANKE A,FOSBØL E L,EWERTZ M,et al. Long-term risk of heart failure in breast cancer patients after adjuvant chemotherapy with or without trastuzumab[J]. JACC Heart Fail,2019,7(3):217-224.
[ 9 ] CHAVEZ-MACGREGOR M,ZHANG N,BUCHHOLZ T A,et al. Trastuzumab-related cardiotoxicity among older patients with breast cancer[J]. J Clin Oncol,2013,31(33):4222-4228.
[10] GHIGO A,LI M C,HIRSCH E. New signal transduction paradigms in anthracycline-induced cardiotoxicity[J]. Biochim Biophys Acta,2016,1863(7 Pt B):1916-1925.
[11] MCGOWAN J V,CHUNG R,MAULIK A,et al. Anthracycline chemotherapy and cardiotoxicity[J]. Cardiovasc Drugs Ther,2017,31(1):63-75.
[12] NEMETH B T,VARGA Z V,WU W J,et al. Trastuzumab cardiotoxicity:from clinical trials to experimental stu- dies[J]. Br J Pharmacol,2017,174(21):3727-3748.
[13] DOKMANOVIC M,KING K E,MOHAN N,et al. Cardiotoxicity of ErbB2-targeted therapies and its impact on drug development,a spotlight on trastuzumab[J]. Expert Opin Drug Metab Toxicol,2017,13(7):755-766.
[14] 吳玉婷,陈颖,朱小丽,等.表柔比星化疗的乳腺癌患者心脏毒性的发生及影响因素的研究[J].中国药物应用与监测,2020,17(5):292-294,309.
[15] KABORÉ E G,GUENANCIA C,VAZ-LUIS I,et al. Association of body mass index and cardiotoxicity related to anthracyclines and trastuzumab in early breast cancer:French CANTO cohort study[J]. PLoS Med,2019,16(12):e1002989.
[16] VAN NIMWEGEN F A,SCHAAPVELD M,JANUS C P,et al. Cardiovascular disease after Hodgkin lymphoma treatment:40-year disease risk[J]. JAMA Intern Med,2015,175(6):1007-1017.
[17] 黄丹,李群益,施孝金,等.右雷佐生联合榄香烯降低蒽环类药物心脏毒性疗效观察[J].中国药业,2019,28(21):65-67.
[18] 中国临床肿瘤学会,中华医学会血液学分会.蒽环类药物心脏毒性防治指南:2013年版[J].临床肿瘤学杂志,2013,18(10):925-934.
[19] VAN DALEN E C,CARON H N,DICKINSON H O,et al. Cardioprotective interventions for cancer patients recei- ving anthracyclines[J]. Cochrane Database Syst Rev,2011(6):CD003917.
[20] 王子红.右丙亚胺对乳腺癌患者术后化疗所致心脏毒性的保护作用[J].中国肿瘤临床与康复,2017,24(5):609- 612.
(收稿日期:2021-10-13 修回日期:2022-03-21)
(编辑:邹丽娟)

