类器官在妇科恶性肿瘤中的应用
吴嘉兴,汪希鹏
类器官(organoid)是在体外培养构建出的三维多功能细胞团,具有自我更新和自我组装、维持其来源组织的结构和生理功能的能力[1-2],被证实是良好的人体组织和器官体外模型。类器官具有两大优势:其一,高度模拟活体组织的细胞构成,可产生来源组织中所有主要的功能细胞系;其二,遗传与表型相对稳定,可长期培养、扩增,也可冷冻保存形成生物样本库。类器官培养技术于2013 年被《Science》杂志评选为年度科技发展十大突破之一,于2017 年被《Nature Methods》杂志评为生命科学领域的年度技术。随着以类器官为基础的肿瘤研究日益增多,及其构建技术的不断改进,类器官已成为肿瘤学和干细胞生物学研究的有力工具。妇科肿瘤异质性程度高,易发生耐药,基因变异度高,亟需适用于高通量药物筛选、能稳定维持肿瘤异质性的临床前模型。近年来,越来越多的妇科肿瘤研究使用类器官进行高通量药物筛查(包括药物敏感性、耐药机制、靶向治疗和免疫治疗等)和机制研究(包括恶性肿瘤的病因及发生发展、恶性肿瘤与宿主周围环境的关系等)[3]。现综类器官的发源发展及其在妇科恶性肿瘤研究中的应用及挑战,以期为后续妇科肿瘤类器官研究的开展提供指导。
1 类器官的发源发展
1975 年,Rheinwald 和Green 将新鲜分离的角质形成细胞与经辐照的小鼠成纤维细胞(NIH3T3 细胞)合并培养,首次产生了人类细胞的长期培养物[4]。随后,在90 年代初期,他们的同僚Lindberg 等[5]和Pellegrini 等[6]在体外培育出了人源3D 眼角膜结构,延续了Rheinwald 和Green 的设想,打开了人源性细胞类器官培养的大门。虽然在这些研究中没有使用“类器官”这一称谓,Rheinwald 和Green 却是培养人类干细胞重建3D 组织结构的开创者。到2010 年,Clevers 团队利用含表皮生长因子(epidermal growth factor,EGF)、头蛋白(Noggin)和R-脊椎蛋白(Rspondin)的3D-Matrigel 培养体系培养小鼠肠道隐窝细胞,形成类肠组织的隐窝绒毛样复合体,由此成功构建肠类器官,开启了类器官研究的新篇章[7]。利用相同的培养体系,他们对单个Lgr5+肠干细胞进行培养,也得到了类似生理形态的微型结构,进行鉴定后发现,这些类器官中仍有Lgr5+肠干细胞的存在,证实了类器官模型对肠道组织形态结构和功能均有较好的模拟性[8]。2011 年Sato 等[9]采用类器官技术培养出肠腺瘤、Barret 上皮组织和结肠癌组织,真正意义上构建出来源于患者肿瘤细胞的类器官(patientderived organoid,PDO)。上述研究成果一经公布,立刻受到了学界的广泛关注,这无疑是类器官研究路上新的里程碑,掀起了类器官研究的热潮。目前,世界各地的研究人员已经报道了许多成功培养类器官的案例,见表1。

表1 不同组织来源类器官的研究时间及方法
传统用于肿瘤研究的生物模型包括患者来源的肿瘤细胞系(patient-derived cancer cell lines,PDC)和患者来源的肿瘤异种移植(patient-derived xenografts,PDX)模型。PDC 诞生于1951 年Hela 细胞的成功建系,其具有培养条件简单、可体外无限增殖的优点,因此被广泛应用于大规模的药物筛选和实验室研究中。但是,PDC 在体外培养过程中会丢失肿瘤细胞的异质性和生理特征[4],导致无法代表一类肿瘤的所有特征。众所周知,即使是同一类肿瘤,不同细胞株之间的特异性也很明显,因此,PDC 不能完美地应用于恶性肿瘤研究,尤其是机制研究。值得一提的是,恶性肿瘤患者自带的癌细胞个体差异显著,根本无法以细胞系去表征。例如,目前常用于前列腺肿瘤的细胞系只有7 株,无法涵盖临床上最为常见的突变类型,如SPOP 突变、FOXA1 突变和CHD1 缺失[23]。即使研究人员开发出更多的肿瘤细胞系,也会损失PDC 简单易操作的特性,同时也增加了科学研究的成本。PDX是将肿瘤组织切块并移植于免疫缺陷小鼠体内而制成的人源肿瘤异种移植模型。PDX 模型完好地保留了来源肿瘤的异质性,克服了PDC 在临床应用中的瓶颈,可充分模拟肿瘤与体内环境作用的过程。目前,PDX 模型已广泛应用于实验室研究和辅助临床药物筛选中,但其仍存在移植成功率低、造模周期长和样本量难以扩大的问题。相较于PDC 和PDX,PDO 经历多次传代仍能保存绝大多数肿瘤来源组织的生物学特征,其既具备肿瘤细胞系无限增殖的特性,也维持了肿瘤的异质性,可以应用于高通量药物筛选或辅助个性化治疗方案的设定(见表2)。
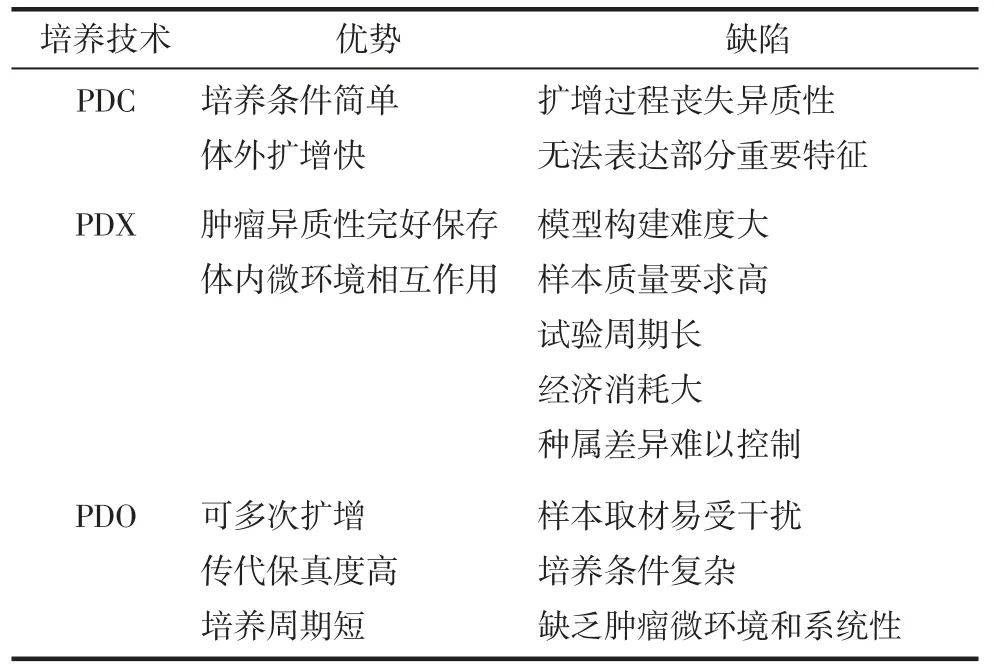
表2 各种肿瘤研究模型的优劣对比
类器官的出现为再生医学开辟了新途径,通过与新兴技术的结合,更可以在类器官水平上完成基因编辑、免疫靶标筛选和肿瘤干性探究等操作,对肿瘤研究有着极大的推动作用,是肿瘤研究新的突破点,必然也是妇科恶性肿瘤研究的有力工具[24]。
2 类器官在妇科恶性肿瘤中的研究
2.1 卵巢癌类器官应用于妇科恶性肿瘤研究的最早报道,是通过建立健康人类卵巢上皮组织的体外类器官模型,发现输卵管细胞的球形结构与卵巢皮质上皮包涵囊肿的形态类似,提示输卵管作为卵巢上皮肿瘤来源的可能[25]。类器官还曾用于研究慢性炎症与卵巢癌发生的相关性,应用肿瘤坏死因子在体外反复刺激卵巢上皮组织类器官模型,结果类器官中出现了癌前病变,表现为细胞增殖重新启动、结构紊乱、上皮极性消失、基底膜降解和细胞侵袭等。该研究不仅直观支持慢性炎症与恶性肿瘤的发生有关,也有力说明了两者的直接关系。因此,类器官模型是探究卵巢癌发生初期过程的有力工具。
2018 年,Hill 等[26]构建了来源于12 例高级别浆液性卵巢癌(high-grade serous ovarian carcinoma,HGSOC)患者的22 份肿瘤类器官,结合药物敏感性测试和全外显子组测序后发现,复制叉(replication fork)保护功能缺陷影响卡铂、细胞周期检测点激酶1(checkpoint kinase 1,CHK1)和ATR 激酶(ataxia telangiectasia-mutated and Rad3-related kinase)抑制剂的敏感性。无论DNA 修复基因突变情况如何,类器官同源重组功能缺陷都与多腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]抑制剂敏感性相关。该研究结果表明,基因组分析和类器官功能测试相结合,可以靶向识别DNA 损伤修复缺陷。这些研究结论提示源自于患者的卵巢癌类器官生长迅速且在遗传和功能上与源肿瘤匹配、吻合,类器官可用于DNA 修复功能分析和药物敏感性筛选检测,并为肿瘤同源重组功能缺陷的评估及合适治疗方案的选择提供快速、可靠的依据。
Soragni 等[27]构建了来源于卵巢恶性肿瘤的类器官,并使用这些类器官对具有抗肿瘤药物潜能的化合物及多肽进行高通量筛选,发现多肽ReACp53 具有部分恢复P53 功能的效应,经此通路发挥抗肿瘤活性。然后将该多肽注射到移植了肿瘤组织的小鼠腹腔,发现小鼠体内的肿瘤移植物体积迅速缩小,证实多肽ReACp53 具有成为治疗卵巢癌以及其他含有P53 变异肿瘤新药物的可能。该研究成功地将类器官应用于抗肿瘤药物的新药发现研究,为后续研究提供了参考。Hill 等[26]的研究中使用HGSOC 患者来源的肿瘤类器官对卡铂、Prexasertib、VE-822、吉西他滨和奥拉帕利等多种抗肿瘤药物进行高通量筛选,发现不同的传统化疗药物与DNA 损伤修复药物搭配形成的多个药物组合,在含有DNA 修复缺陷的肿瘤中有效。这些研究证实了类器官是快速测试药物组合的有用模型,类器官在针对卵巢癌的结合基因组测序和测试药物反应等方面已经显示出了巨大作用,可以预见其在针对卵巢癌的分子发病机制、转录组和生物标志物等方面的研究中也有广阔应用前景。
除药物治疗外,卵巢肿瘤类器官在免疫治疗中的应用仍有较大的探索空间。由于肿瘤类器官的培养过程中缺乏免疫系统的相互作用,将其直接应用于免疫治疗的研究还存在一些难题。目前已有学者通过将类器官与免疫细胞、基质细胞共培养解决了这一难题,如Yuki 等[28]将肿瘤类器官与树突状细胞(dendritic cell,DC)、自然杀伤(natural killer,NK)细胞共培养,可以阻断肿瘤类器官内部的程序性死亡受体1 及其配体(programmed death-1/programmed death ligand-1,PD-1/PD-L1)的识别通路,从而降低肿瘤的进展速度。可见类器官作为免疫治疗效果的预测工具,在妇科恶性肿瘤中有很大的应用价值。
2.2 子宫内膜癌子宫内膜癌是常见的女性生殖系统肿瘤,其发病与生活方式有密切关系。我国子宫内膜癌的发病率逐年升高,目前仅次于宫颈癌,居妇科恶性肿瘤第2 位。由于缺乏理想的研究模型,阐释子宫内膜癌分子机制的研究较少。近年来,模拟生理状态的子宫内膜类器官研究进展迅速[29-31]。Girda等[32]使用无血清的新型培养模式,成功对子宫内膜癌组织来源的类器官进行构建及传代,并使用雌激素类似物对其进行敏感度测试,发现子宫内膜癌类器官对雌激素产生了浓度依赖性的反应,表明子宫内膜癌类器官可用于雌激素及药物敏感性测试。此外,该研究还表明,将信号转导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)抑制剂——BBI608 用于类器官培养物及体外培养的人体组织,表现出几乎一致的抑制作用。因此,该抑制剂有可能成为治疗子宫内膜癌的一种新型靶向治疗药物。
尽管类器官培养可用于子宫内膜癌的药物敏感性检测,但类器官培养的检测结果及其与患者预后的关系,仍需大样本临床试验进行验证;类器官用于预测子宫内膜癌患者的药物反应,还需要对正在接受治疗患者的实际临床结果进行统计,从而评价类器官药物敏感性试验用于个体化临床决策的有效性。如已报道的对胃癌类器官的临床研究中,Vlachogiannis 等[33]将PDO 的原位小鼠肿瘤异种移植模型对体外抗癌剂的反应与临床试验中患者的反应进行了头对头比较研究(head to head comparative trail),证实了PDO 异种移植模型能同等水平地反映患者临床中对于体外抗癌剂的反应。
2.3 宫颈癌宫颈癌是一种常见的妇科恶性肿瘤,由高危型人乳头瘤病毒(human papilloma virus,HPV)引起。与腺上皮细胞来源的类器官不同,宫颈癌以鳞状细胞癌为主要类型,这就需要基于鳞状细胞的类器官模型,而目前尚缺乏人源培养系统来研究宫颈上皮及其衍生的恶性肿瘤。2021 年,Clevers团队率先创建宫颈模型来研究HPV 介导的宫颈癌,他们利用在临床检查期间用巴氏刷获得的有限数量的宫颈组织培育出类器官,继而利用单纯疱疹病毒1 型(herpes simplex virus-1,HSV-1)感染类器官,通过荧光染色证明了类器官可以模拟HSV-1 感染的完整过程;团队使用同样的技术利用宫颈鳞状细胞癌或宫颈腺癌患者的细胞生成了宫颈鳞状细胞癌或宫颈腺癌的类器官[34]。类器官的转录组学分析显示其与原始天然肿瘤高度相似,包括不同的HPV 致癌基因介导的基因组特征。因此,宫颈癌类器官是一种有效的工具,可以模拟宫颈癌和性传播感染的病理生理学。除人为模拟病毒感染介导的宫颈鳞状细胞癌发生过程外,通过基因编辑手段构建宫颈癌类器官将成为未来研究的新热点。另外,结合基因编辑技术,可以在类器官模型上考察恶性肿瘤驱动基因对肿瘤发生、发展的机制。Matano 等[35]使用CRISPR-Cas9系统对结肠类器官进行基因编辑,涉及结肠腺瘤性息肉病蛋白(adenomatous polyposis coli,APC)、SMAD家族成员4(SMAD family member 4,SMAD4)、肿瘤蛋白p53(tumor protein p35,TP53)、鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)及磷脂酰肌醇3 激酶催化亚单位α(phosphatidylinositol 3-kinase catalytic subunit alpha,PIK3CA)多个抑癌/原癌基因,获得了众多不同表型的结肠癌类器官模型。对于不同组织学类型的宫颈恶性肿瘤类器官的构建具有良好的借鉴意义。
Zhang 等[36]主导的一项前瞻性研究中,发现鳞状上皮(squamous epithelial)、鳞状间充质(squamous mesenchymal)和腺上皮(adenocarcinoma)3 种类型的宫颈癌中,鳞状间充质亚型肿瘤患者的生存结局较差,随之以宫颈癌类器官模型证明,宫颈癌细胞中间充质成分增多与形成类器官的能力和对辐射的抵抗力呈正相关,表现为糖酵解水平升高的宫颈癌类器官对辐射的抗性增高,导致放疗效果变差。该研究通过整合大数据集提供了一种反应预测策略,并强调了代谢指标在宫颈癌放射性治疗效果预测中的价值。
3 结语与展望
虽然类器官模型的培养已为妇科恶性肿瘤的研究带来很大进展,但仍有需要突破和改进的不足之处。第一,类器官模型缺乏体内类似环境中的多种间质细胞,如免疫T 细胞和NK 细胞、神经组织和血管内皮细胞等。间质细胞及细胞相互作用的缺失将导致一部分的肿瘤内部信息丢失,Maru 等[37]的一项病例报告提到,宫颈透明细胞癌类器官丢失了原始肿瘤细胞中TP53 双等位基因失活的重要遗传信息,无法重现原始肿瘤组织中局灶腺癌病变的表型。第二,肿瘤类器官培养技术繁复,国际上缺乏统一有效的培养准则,统一完善的类器官生物样本库的建立尚需努力。第三,目前类器官培养技术的成功率有待提高,培养周期和经济消耗方面并未达到最理想状态,也是导致大多数研究停留在基础研究及实验室阶段,不能迅速应用于临床的原因之一。这些问题需要生命科学、临床医学、生物医学工程和材料科学等多方协作以求完善。Fong 等[38]用富孔隙水凝胶替代以往的基质胶建立海绵样培养体系,并以此为基础构建了新型的肝癌类器官,这种新型的材料有望进一步应用于妇科肿瘤类器官中。
类器官为体外个性化地模拟来源组织和器官提供了选择,它的出现有利于推动临床个体化精准医疗和再生医学的发展。这种接近生理状态的3D 模型有助于准确研究一系列的体内过程,包括组织更新、干细胞功能、药物反应及突变或损伤。在妇产科领域,类器官可很好地用于妇科恶性肿瘤的发生、发展机制研究和临床前药物筛选等,也是研究免疫治疗和靶向治疗的有效工具,这些优势对于为患者进行精准化治疗和个体化治疗提供了新的思路和解决方法。因此,类器官在妇科恶性肿瘤领域具有广阔的应用前景,对于探索妇科恶性肿瘤有效的治疗策略意义重大。

