循环肿瘤细胞检测在EGFR合并TP53突变的晚期非小细胞肺癌一代EGFR-TKI治疗中的疗效评价
徐 静,何 靓,钱慧珠,马 旺,高 雯
0 引 言
肺癌的发病率和病死率均位列各类肿瘤中最高[1]。约85%的肺癌患者为非小细胞肺癌(non-small cell lung cancer,NSCLC),其中一半以上为晚期,已失去手术机会。传统的化疗疗效有限,5年生存率不足15%[2]。目前针对不同驱动基因的分子靶向药物,尤其是表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibition,EGFR-TKI)因其疗效好、安全性高,已经成为了晚期NSCLC的标准治疗[3]。但几乎所有患者在用药1年左右不可避免的出现耐药[4]。与单突变肿瘤相比,同一肿瘤中多个体细胞突变的NSCLC患者预后较差[5]。TP53是肺癌中最常见的突变基因[6-7]。EGFR与TP53共突变可能与EGFR-TKI的耐药及较短的PFS和OS有关[8-10]。
目前评价肺癌靶向治疗疗效的方法主要是影像学检查及血清肿瘤标志物等,但均有局限性。有研究表明,循环肿瘤细胞(circulation tumor cells, CTCs)与晚期非小细胞肺癌EGFR-TKI治疗疗效相关[11-12];但在EGFR/TP53共突变的晚期NSCLC患者中一代EGFR-TKI(吉非替尼、厄洛替尼、埃克替尼)疗效如何尚无定论。本研究通过分析31例EGFR/TP53共突变晚期NSCLC一线接受一代EGFR-TKI治疗期间CTCs计数,探讨CTCs在EGFR合并TP53突变的晚期非小细胞肺癌一线接受一代EGFR-TKI治疗疗效评价中的价值。
1 资料与方法
1.1 研究对象回顾性分析2012年10月至2019年5月在江苏省人民医院就诊的31例晚期NSCLC患者临床资料。纳入标准:①年满18岁,临床资料完整;②经组织学或细胞学检查证实为非鳞状IIIB期NSCLC并伴有胸腔积液或IV期NSCLC,无既往肺癌治疗史;③检测有EGFR合并TP53基因突变。排除标准:①哺乳和妊娠期患者;②有明显认知障碍患者;③不可控制的感染患者。按照CTC数量将患者分为<5 CTCs组(CTCs-d0为0-4,n=15)和不利(CTCs-d0≥5,n=16)组。
1.2CTCs检测方法采用6mL采血管,CTCs检测样本为肘正中静脉血,采血完毕立刻轻柔颠倒混匀8次,使血液与抗凝剂充分混匀。获取标本后保存,24h内检测。基于异常细胞与血细胞的尺寸大小及细胞变形能力的差异用膜过滤的方式富集异常细胞。血液样本经过前处理,转移至细胞过滤器中,通过异常细胞分离染色仪使细胞过滤器中的血液通过滤器滤膜,其中异常细胞会聚集到滤膜表面,从而完成对样本CTCs的富集。采用Romanowsky染色技术,通过异常细胞分离染色仪对分富集后的CTCs进行染色。将染色后的滤膜取出固定于载玻片上,50 ℃孵育30min,待滤膜干燥后,滴加适量中性树脂封片剂,盖上盖玻片,待封片剂固化后,在光学显微镜下观察全片,进行计数。
1.3观察指标采用一代EGFR-TKI(吉非替尼/厄洛替尼/埃克替尼)治疗,持续治疗至少1个月,最长的疗程为31个月。记录患者治疗前、治疗28d后时CTCs数目。影像学检查根据RECIST评分标准:CR和PR被认为是治疗有效;CR、PR和SD结果被认为是疾病得到了控制。从治疗的第1天到PD日期计算无进展生存期(progression-free survival, PFS)。
1.4统计学分析采用R语言4.0.2和SPSS 20.0进行数据分析。采用χ2检验评估分类变量,Kaplan-Meier和Cox回归分析用于生存分析。 以P≤0.05为有统计学意义。
2 结 果
研究共纳入31例患者,基线状态见表1。所有患者均出现疾病进展。不同的基线CTCs计数与患者其他临床特征之间差异无统计学意义(P>0.05)。
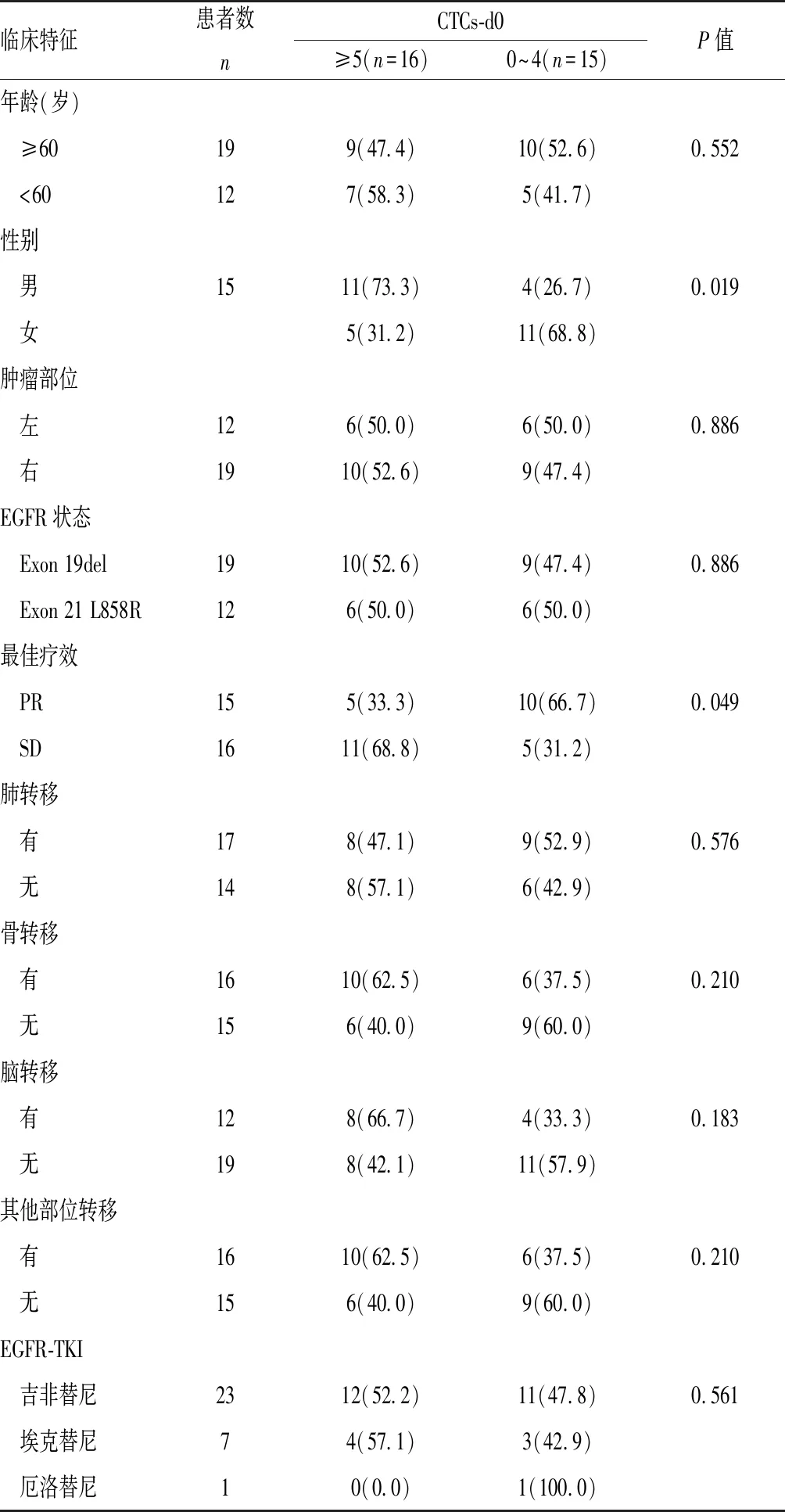
表 1 EGFR-TKI 治疗前不同数量CTCs患者临床特征[n(%)]
<5 CTCs组患者中位PFS为15个月,明显长于≥5 CTCs组(7.5个月),差异有统计学意义(HR=0.418,95%CI:0.195~0.896,P=0.0055),见图1。≥5 CTCs组患者中,2例CTCs-d28≥5,13例CTCs-d28为0~4;在16名<5 CTCs组患者中,6名CTCs-d28为0-4,而10名CTCs-d28为≥5。与≥5 CTCs组中10名CTCs未变化患者(6个月)相比,6例显示CTCs数量减少的患者的中位PFS为9个月,显著高于CTCs未变化≥5 CTCs组,见图2。对于治疗后CTCs计数与PFS分析提示,预后<5 CTCs组PFS明显高于预后不良组(7个月vs12.5个月,HR=0.317,95%CI=0.118~0.853,P=0.000 3),见图3。
在单因素分析中,CTCs-d0, CTCs-d28与PFS有关,见表2。在多因素分析中,CTCs-d28≥5是所有不良预后指标中最重要的预后因素,这表明<5 CTCs组的疾病进展风险较低(HR=0.285,95%CI:0.121~0.672,P=0.004),见表2。
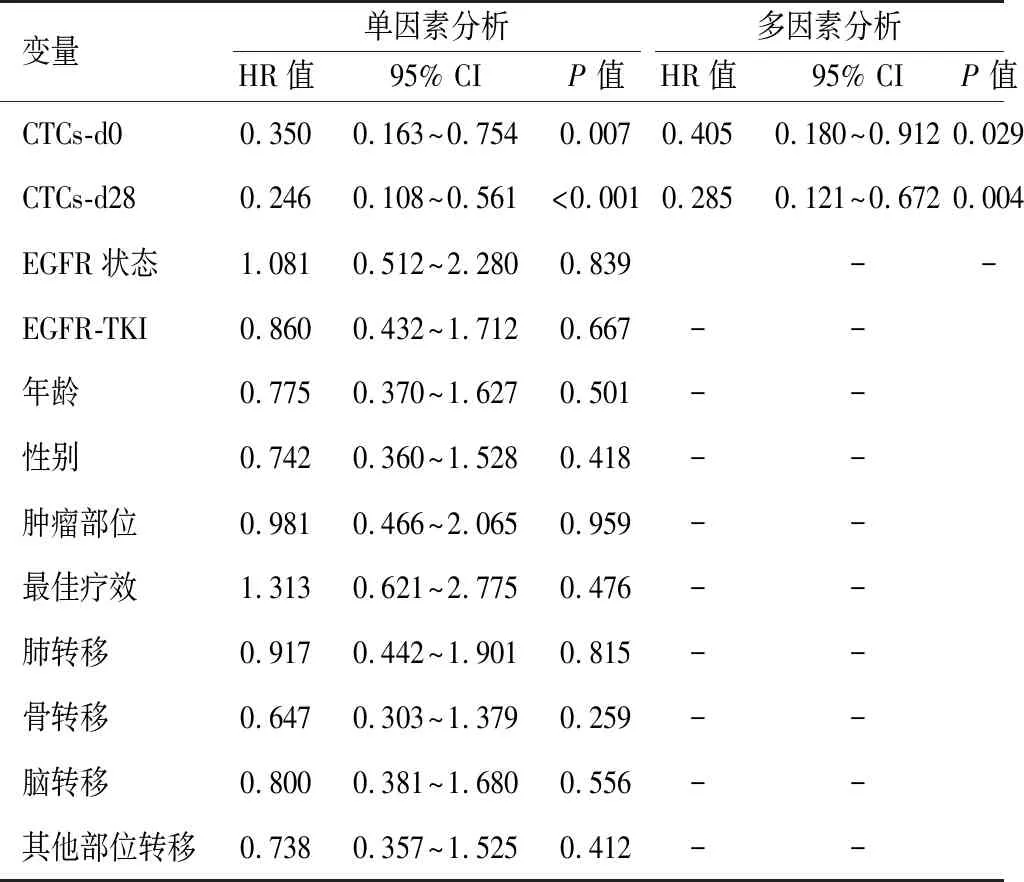
表 2 不良预后影响因素分析
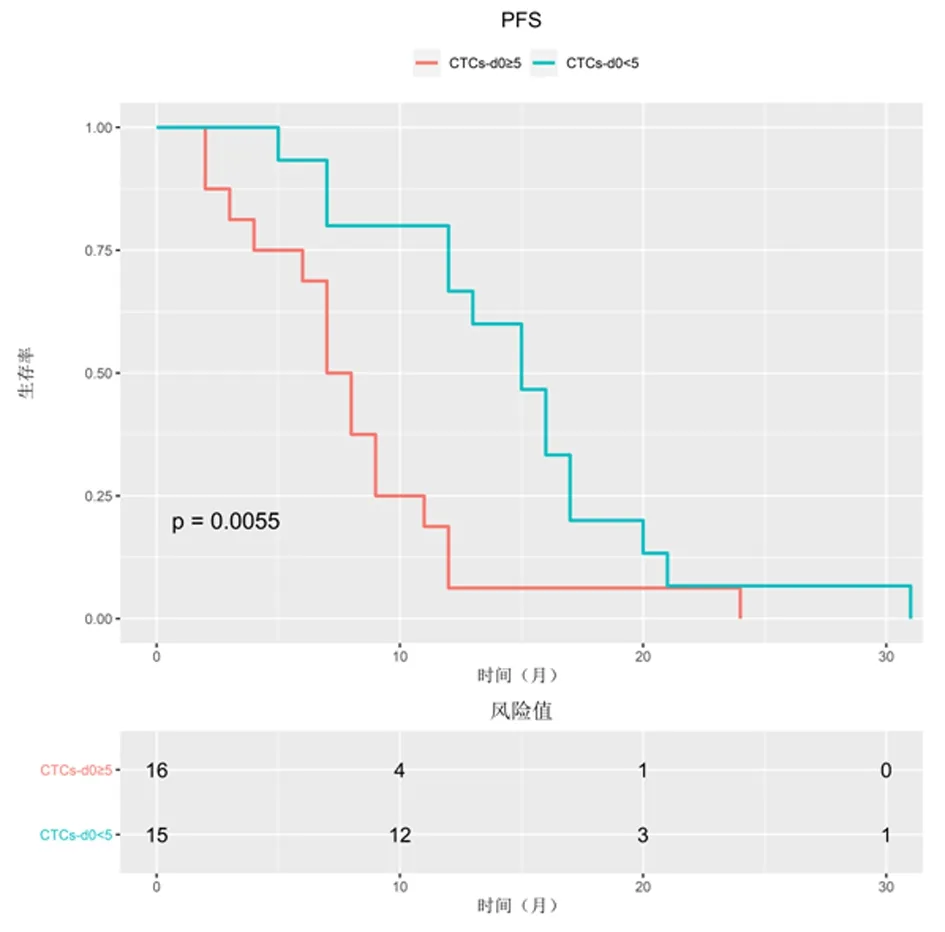
图 1 EGFR-TKI治疗前CTCs计数与PFS
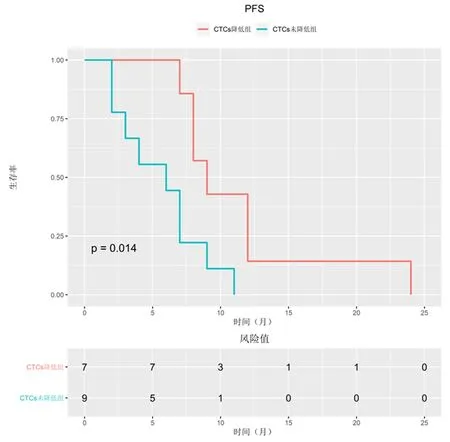
图 2 EGFR-TKI治疗后CTCs变化与PFS
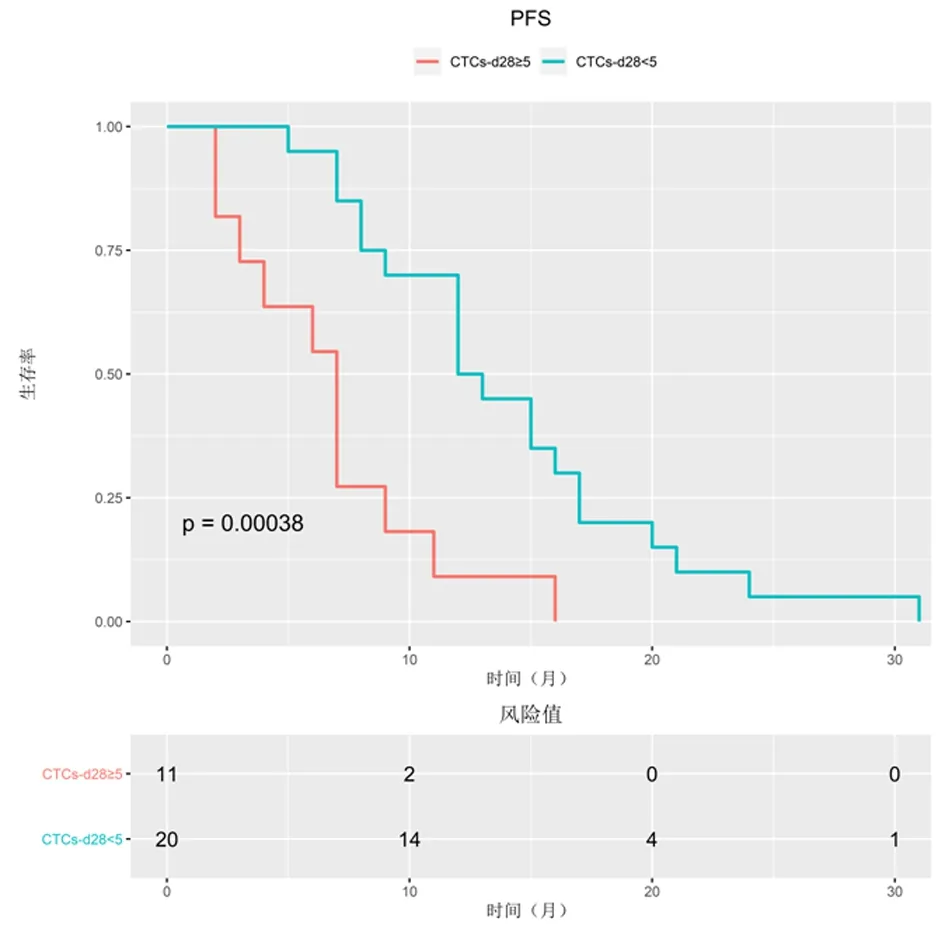
图 3 EGFR-TKI治疗后28 d CTCs计数与PFS
3 讨 论
在恶性肿瘤增殖和发展过程中,肿瘤细胞通过上皮-间质转化改变细胞表型,自原发灶或转移灶脱落并侵入外周循环以形成转移性CTCs[13]。在这项研究中,我们以每个样本5个CTCs为阈值,CTCs-d0<5的患者少于CTCs-d0≥5的患者。Krebs等[14]使用细胞搜索技术从101例III-IV期NSCLC患者中释放出CTCs,并报告IV期患者的CTCs数量高于III期患者。临界值≥5与较短的PFS和OS相关。此外,一周期的标准化学疗法后CTCs数量降低可能获得更佳的PFS和OS。Tanaka等[15]进行的另一项研究发现,转移性NSCLC患者的CTCs数量高于非转移性患者。这两项发现表明CTCs的数量可能与NSCLC患者的癌症分期有关。一代EGFR-TKI是患有EGFR突变的晚期NSCLC患者的一线治疗。但耐药性限制了一代EGFR-TKI的使用。研究表明,CTCs计数与EGFR-TKI治疗效果呈负相关。随着下一代测序平台的推出,有研究表明EGFR突变的NSCLC中TP53突变30%~60%[9]。相比于无TP53突变的晚期NSCLC患者,EGFR/TP53双重突变,尤其是错义突变的患者,采用一代EGFR-TKI治疗时,有效率低,PFS较短[8,16]。了解一代EGFR-TKI是否有效对EGFR/TP53双重突变的NSCLC患者的治疗和疾病预后至关重要。
近年来,CTCs计数和外周血基因表达数据已用于指导NSCLC的临床治疗。Punnoose等[17]报道,在EGFR-TKI治疗的NSCLC患者中,CTCs中的基因组表达与原发肿瘤组织中的基因组表达高度一致。 Maheswaran等[18-19]报道CTCs中的EGFR、EGFR T790M、MET和其他基因突变可用于评估NSCLC患者的治疗效果和预后。
常见的CTCs检测方法包括ISET方法、Cell SearchTM系统逆转录聚合酶链反应,CTCs芯片等。这些技术可以显著提高CTCs检测的灵敏度和特异性。据肿瘤细胞的体积大小的滤膜滤法分离肿瘤细胞(ISET)的方法是一种高速细胞分析和分选技术。因其简单、可靠和快速,故成为检测CTCs的主要方法[20]。
在本研究中,使用ISET对晚期NSCLC患者外周血中的CTCs进行了计数。首次发现,低CTCs计数的EGFR/TP53合并突变的NSCLC患者在一线使用一代EGFR-TKI治疗后获得了更好的PFS。尤其在治疗后CTCs降低的患者中其PFS获益更为明显。并且我们发现在治疗前男性患者的CTCs计数高于女患者。这可能与男性患者吸烟有关[21];并提示我们晚期肺癌中男性病人更容易发生转移。
一代EGFR-TKI治疗前后,低CTCs组的中位PFS均明显高于高CTCs组。这些数据表明CTCs计数与使用一代EGFR-TKI治疗的晚期具有合并EGFR/TP53突变的NSCLC患者的预后密切相关。本研究尚有一定不足,样本量很小,需要进一步的扩大样本量以证实这些结果。