绵羊肌内前体脂肪细胞CNR1和FABP4基因表达研究
闫伟, 王玉涛, 张永浩, 刘海霞*, 韩大勇, 朱爱文
(1.江苏农牧科技职业学院动物科技学院,江苏 泰州 225300;2.喀什大学生命与地理科学学院,新疆帕米尔高原生物资源与生态自治区重点实验室,新疆 喀什 844000)
在羊肉产量满足人们需求的同时,肌内脂肪(intramuscular fat,IMF)含量高的羊肉更受消费者青睐[1-2]。IMF反映了动物肌内脂肪沉积能力,目前IMF是评价羊肉质性状的重要指标之一,IMF含量的高低直接影响羊肉的风味、嫩度、适口性及多汁性[3-4],决定了羊肉的商品特性和养殖户的经济收益。为了满足消费者对高质量羊肉制品的需求,研究调控羊肉IMF含量的生物学机制逐渐成为近年来的研究热点。
研究发现,动物脂肪沉积部位包括皮下、内脏组织周围、肌肉群之间、肌纤维束间(肌内脂肪)和肌纤维内脂肪,且不同部位脂肪含量存在差异,皮下和肌间脂肪约占30%,肌内脂肪约占1%[5]。动物肌内脂肪沉积表现为肌内脂肪细胞的增殖和肥大[6],通常肌内脂肪细胞以簇的形式聚集,起初为前体脂肪细胞增殖,进而前体脂肪细胞分化为成熟脂肪细胞[7]。目前,山羊、绵羊及多种动物体内均能够分离和培养前体脂肪细胞,通过前体脂肪细胞模型开展绵羊脂肪沉积研究具有较大优势。
绵羊脂肪沉积过程受多种基因调控。大麻素受体 1(cannabinoid receptor 1)基因 CNR1主要表达于脑、脊髓、脂肪、肌肉和肝脏组织[8-9],其功能蛋白CB1受体与内源性大麻素组成的内源性大麻素系统(endogenows cannabinoid system,ECS)在动物整体能量代谢[10]和脂肪代谢中发挥核心作用[11-13]。脂肪酸结合蛋白4(fatty acid binding protein 4)基因FABP4在脂肪细胞分化期间高表达,能够结合和转运长链脂肪酸,在甘油三酯合成和分解中具有重要作用。FABP4基因高表达有利于长链脂肪酸跨膜转运[14]及肌肉组织对脂肪酸的吸收[15-16]。本研究前期通过分析采集的17个绵羊半同胞家系生长和胴体数据发现,绵羊FABP4基因变异与IMF含量等表型性状显著相关[17],推测FABP4基因变异可能影响FABP4蛋白,进而影响绵羊肌内脂肪沉积。转录因子c-Jun和活化蛋白-1(activator protein-1,AP-1)形成的异源二聚体影响小鼠FABP4基因转录及表达[18],且转录因子c-Jun受细胞内c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)调控。研究发现,小鼠中激活的CB1受体同样能够作用于细胞内激酶JNK调控转录因子c-Jun,从而影响细胞功能[19],由此表明,CNR1基因与FABP4基因间可能存在互作。
目前,前人主要对羊肌内前体脂肪细胞分化基因的表达开展研究,杜琛等[20-21]和郑竹清等[22]对绒山羊肌内前体脂肪细胞开展基因表达、转录组和LncRNA分析;崔京京等[23]和罗燕等[24]对绵羊肌内前体脂肪细胞开展分离培养及诱导分化;李戡等[25]对绵羊肌内前体脂肪细胞分化的腺苷酸激活蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)调控作用开展研究。但关于调控绵羊肌内脂肪沉积基因表达的研究非常有限。因此,本研究利用绵羊肌内前体脂肪细胞,欲揭示CNR1和FABP4基因的表达特征及差异,为进一步研究CNR1和FABP4基因间调控关系提供参考。
1 材料与方法
1.1 供试材料
1.1.1 供试动物 采购3日龄湖羊羔羊一只,羔羊全身用75%医用酒精消毒后屠宰,无菌条件下快速采取羔羊背最长肌组织保存于含100 U双抗(青霉素和链霉素)的无菌磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)中备用。
1.1.2 主要试剂 DMEM培养基、0.25%的胰蛋白酶、PBS缓冲液和青霉素、链霉素购自赛默飞世尔科技(中国)有限公司,胎牛血清(fetal bovine serum,FBS)购自北京政博伟业生物科技有限公司,Ⅱ型胶原酶、胰岛素、地塞米松和3-异丁基-1-甲基黄嘌呤购自默克化工技术(上海)有限公司,油红O染液购自北京索莱宝科技有限公司。RNA提取试剂盒和反转录试剂盒购自宝日医生物技术(北京)有限公司,Light Cycler 480 SYBR Green I Master购自瑞士罗氏公司。
1.2 试验方法
1.2.1 肌内前体脂肪细胞的分离及传代培养 3日龄湖羊羔羊背部切取倒数第2和第3肋骨间背最长肌组织,用含双抗的PBS冲洗最少3遍后移入超净工作台,无菌操作下用外科手术剪剔除背肌组织肉眼可见的血管和结缔组织,小心分离肌束膜,置于50 mL离心管中用PBS液悬浮,1 500 r·min离心5 min后去除PBS。加入0.2%的Ⅱ型胶原酶在37℃水浴锅中振荡消化90 min,加入等体积的消化终止液(10%FBS+DMEM)终止消化,2 500 r·min-1离心10 min后弃上清液。加入2 mL完全培养基(10%FBS+DMEM+双抗)重悬细胞,先后利用100和40 μm的无菌细胞筛过滤细胞。滤液2 000 r·min-1离心5 min后弃上清,沉淀加入含10%FBS的完全培养基悬浮细胞,然后将细胞接种于培养皿在37℃、5% CO2饱和湿度的培养箱中培养。细胞在培养2 h后进行观察,见少量细胞贴壁后即将未贴壁细胞培养基转移接种至新的培养皿。新培养皿中细胞在培养2.5 h后弃培养液,应用新鲜培养液冲洗贴壁细胞2次后继续培养,每3 d换1次培养液,连续培养5~7 d。原代细胞长到80%~90%丰度时用0.25%的胰蛋白酶消化,按1∶3的比例进行传代培养,每隔2 d换1次培养液,细胞长到80%丰度后继续传代培养。
1.2.2 肌内前体脂肪细胞生长曲线测定 原代细胞铺满至80%~90%时,用0.25%胰蛋白酶消化细胞、经PBS洗液洗涤后收集细胞,按每孔8.0×104CELL等量接种至6孔培养板内,随机分为8组,每组3孔。将6孔板置于37℃,5% CO2培养箱中继续培养,此时记作第0天。以后每3 d取3孔细胞消化,每孔计数3次,结果以3孔的细胞均数表示。如此至第8组结束,绘制细胞生长曲线,横坐标为观察时间,纵坐标为平均细胞数。
1.2.3 肌内前体脂肪细胞的诱导分化 前体脂肪细胞均为第3代细胞开展诱导分化,细胞接种密度为3×103CELL·cm-2,细胞长满后先换分化培养液(DMEM+10%FBS+1%双抗+1 μmol·L-1地塞米松+10 mg·L-1胰岛素+0.5 mmol·L-1IBMX)培养2 d,再换培养液(DMEM+10%FBS+1%双抗+10 mg·L-1胰岛素)培养2 d,最后换常规培养基培养8 d,期间,每2 d换1次液。
1.2.4 肌内脂肪细胞的油红O染色 分别于细胞分化的第4、8和12天弃去培养液,用预冷PBS漂洗细胞3次。用10%甲醛室温固定30 min,PBS漂洗2次,油红O染色40 min,弃去染色液后用蒸馏水漂洗剩余染色液,然后在光学倒置显微镜下观察细胞并拍照。
1.2.5 实时荧光定量PCR检测和统计分析 培养的前体脂肪细胞分别在诱导分化后的第2、4、8和12天收集细胞提取总RNA。细胞总RNA提取根据Takara MiniBEST Universal RNA Extraction Kit提取试剂盒说明书进行。总RNA去除基因组后,取RNA 1 μL用紫外分光光度计测定OD值(OD260、OD280及 OD260/OD280),计算RNA的纯度和含量。取1 μg RNA进行逆转录,开展qRT-PCR分析。3个基因qRT-PCR的扩增程序均为:95℃10 min;95 ℃ 10 s,60 ℃ 15 s,60 ℃ 15 s,40个循环。GAPDH为内参基因,根据2-ΔΔCT法计算基因相对表达量。引物信息详见表1。

表1 扩增引物序列Table 1 Sequences of amplified primers
1.3 数据分析
应用SPSS 24.0软件进行单因素方差分析,采用Duncan方法进行多重比较。
2 结果与分析
2.1 绵羊原代肌内前体脂肪细胞的形态
如图1所示,经胰蛋白酶消化的细胞在贴壁培养至第3天时,贴壁细胞数量明显增加,细胞呈梭形、不规则倒三角形或星形,呈逐渐伸展状态;细胞培养至第6天时,细胞呈长梭形且体积进一步增大,伸展状态更加明显;细胞培养至第8天时,逐步呈单层汇合状态,少部分细胞亦可自行分化,但未观察到脂滴形成。

图1 绵羊肌内前体脂肪细胞的原代培养(200×)Fig.1 Primary cultured cells of intramuscular preadipocyte in sheep(200 ×)
2.2 绵羊肌内前体脂肪细胞的生长曲线
绘制细胞生长曲线,结果(图2)表明,生长曲线呈近S型,符合体外细胞增长规律。接种至第6天细胞增长较缓慢,第6至15天进入指数增长期,第15天后逐步进入增长平台期。

图2 绵羊肌内前体脂肪细胞的生长曲线Fig.2 Growth curve of intramuscular preadipocyte cells in sheep
2.3 绵羊肌内前体脂肪细胞诱导分化及油红O染色鉴定
诱导分化剂能够促使绵羊肌内前体脂肪细胞进入快速分化阶段。如图3所示,诱导分化第4天,观察到极少数细胞生成小脂滴,生脂细胞数量非常有限;诱导分化第8天,生脂细胞数量随着细胞分化的加快明显增加,脂滴数量显著增多,多个小脂滴逐步汇合后呈串状;诱导分化第12天,成脂细胞产生大量脂滴,且脂滴体积增大。油红O将脂滴染成红色,说明前体脂肪细胞已分化为成熟的脂肪细胞。
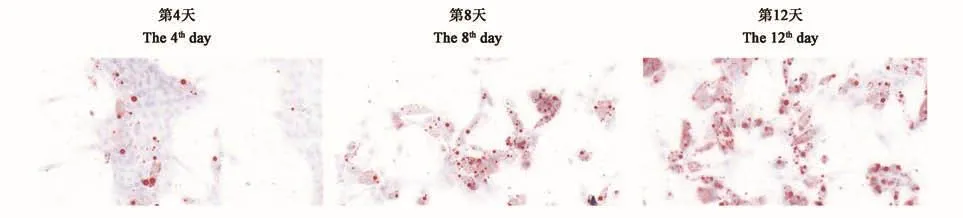
图3 绵羊肌内前体脂肪细胞的诱导分化(100×)Fig.3 Induced differentiation of intramuscular preadipocyte in sheep(100 ×)
2.4 绵羊肌内前体脂肪细胞CNR1和FABP4基因表达规律及差异
肌内前体脂肪细胞CNR1基因的相对表达量随分化时间延长逐渐增加(图4),其中,第12天的表达量显著或极显著高于第2、4、8天的表达量;第8天的表达量显著高于第2天的表达量,但与第4天表达量差异不显著;第4天表达量与第2天表达量差异不显著。FABP4基因的表达量也随分化时间呈逐渐升高趋势(图4),其中,第12天的表达量极显著高于第2、4、8天的表达量;第8天的表达量显著高于第4天的表达量,极显著高于第2天的表达量;第4天的表达量与第2天表达量差异不显著。比较CNR1和FABP4基因在相同分化时间时的表达量,结果(图5)表明,在第2、4、8天时,CNR1和FABP4基因表达量差异不显著;在第12天,FABP4基因的表达量显著高于CNR1基因。

图4 绵羊肌内前体脂肪细胞CNR1和FABP4基因的表达量Fig.4 CNR1 and FABP4 expression level of intramuscular preadipocyte

图5 CNR1和FABP4基因的表达量Fig.5 Difference of CNR1 and FABP4 Expression
3 讨论
脂肪组织在动物能量代谢中发挥重要作用。研究发现,脂肪组织源于动物胚胎中胚层分化的间充质干细胞群,而脂肪干细胞能够由间充质干细胞群差异分化形成[26],且脂肪干细胞进一步分化形成动物前体脂肪细胞。体外前体脂肪细胞能够广泛开展动物脂肪代谢等研究,是深入揭示动物脂肪沉积分子基础的首选研究对象。在特定的体外诱导和培养条件下,前体脂肪细胞最终分化为成熟的脂肪细胞,发挥脂滴合成、脂肪因子分泌和脂质储存等多种功能[27-28]。目前为止,仅从小鼠中分离出成熟的脂肪细胞系,如3T3-L1、3T3-F442A和ob17等;其他绝大多数动物只能开展原代分离培养前体脂肪细胞[23,29-33],进而诱导分化为成熟脂肪细胞。本研究从湖羊羔羊背最长肌组织中采用差速贴壁法分离原代前体脂肪细胞,其技术难度较高,因为新生羔羊背肌组织中可能混有不同的细胞,如成纤维细胞、成肌细胞等。基于细胞贴壁时间先后(成纤维细胞最早贴壁,而前体脂肪细胞贴壁早于成肌细胞),首先将细胞悬液培养2 h,贴壁较快的细胞最早贴壁,未贴壁细胞悬液转移接种至新培养皿;新培养皿细胞培养2.5 h后弃培养液除去未贴壁细胞,贴壁细胞继续培养可获得纯化的前体脂肪细胞。针对不同动物的前体脂肪细胞,不同诱导方法的诱导效率存在差异。研究发现,油酸法诱导SW872前脂细胞效率最佳[34-35];DEX+IN诱导猪前体脂肪细胞10 d观察到成熟脂肪细胞[36-37];IBMX+DEX+IN诱导山羊背肌前体脂肪细胞9 d观察到成熟脂肪细胞[20];本研究用IBMX+DEX+IN诱导绵羊背肌前体脂肪细胞效率低于李戡等[25]结果,可能是由于二次换液后胰岛素诱导剂的作用时间不同。
动物肌内脂肪沉积表现为肌内脂肪细胞的增殖和肥大。目前,前人对绵羊和山羊肌内脂肪细胞分化过程中多个基因的表达特征及调控进行了研究,如FTO、LPL、PPARγ、LIPIN、AMPK、C/EBPβ、C/EBPα、SREBP1、AP2 和 Wnt10b[20,25,38]。除肌内脂肪细胞增殖分化外,肌内脂肪细胞肥大也对肌内脂肪沉积有显著影响。研究发现,饲喂以谷物为基础的精饲料后,动物肌内脂肪细胞的尺寸和大小显著增加[38-39],因为精饲料中富含的碳水化合物能够通过脂肪合成代谢途径转变为脂肪储存于肌内脂肪细胞,有利于肌内脂肪细胞增大[40]。因此,同时从绵羊采食和能量代谢两个角度研究肌内脂肪沉积对揭示绵羊IMF含量的分子基础具有重要意义。
本研究发现,CNR1基因的表达量随着诱导分化呈逐渐升高趋势,分化后期CNR1基因表达量显著高于中前期,说明CNR1基因在肌内脂肪细胞增殖分化和体积增大中发挥重要作用。CNR1基因编码的功能蛋白CB1受体属于A级G蛋白偶联大麻素受体(G-protein-coupled cannabinoid receptor,GPCR),该蛋白在下丘脑、脂肪和肌肉组织广泛分布[8,41]。研究发现,脂肪组织分泌的内源性大麻素激活下丘脑CNR1基因高表达有利于增加小鼠食欲和食量[42],且其在脂肪组织中激活CNR1高表达有利于刺激脂肪生成[43],因此,推测绵羊肌内脂肪细胞CNR1高表达有利于肌内脂肪沉积。FABP4基因在细胞内主要结合和转运长链脂肪酸,研究证实,绵羊FABP4基因变异显著影响肌内脂肪沉积[44-47]。本研究发现,绵羊肌内脂肪细胞FABP4基因同样随诱导分化时间的延长呈逐渐升高趋势,分化后期FABP4基因表达量显著高于中前期,与前人研究结果相一致[48]。研究表明,脂肪细胞分化过程中FABP4基因转录受多种因素调控,如脂肪酸、胰岛素及过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)[49],推测绵羊生长过程中过多吸收脂肪酸引起FABP4基因高表达,从而促进肌内脂肪沉积。进一步分析发现,脂肪细胞分化后期CNR1表达量显著低于FABP4基因表达量,说明CNR1和FABP4基因可能在绵羊肌内脂肪沉积中发挥不同作用。动物脂肪组织过量分泌内源性大麻素会负向调控动物食欲[50],表明绵羊体内内源性大麻素水平可能影响肌内脂肪组织CNR1和FABP4基因表达,进而影响肌内脂肪沉积。报道发现,小鼠CNR1基因调控ACC-1和FASN基因高表达引起小鼠肥胖[12],因此,进一步研究绵羊CNR1基因与FABP4基因调控关系有助于更深入理解肌内脂肪沉积的调控机制。

