基于Auto-Planning的食管癌容积旋转调强计划的剂量学比较
王锐濠,廖煜良,张书旭,陈宗荣,莫春槐,罗松桂,周丕校
1. 广州医科大学附属肿瘤医院 放疗中心,广东 广州 510095;2. 广东省第二人民医院 设备科,广东 广州 510310
引言
放射治疗是食管癌患者的常规治疗手段之一[1]。随着放射治疗技术的不断发展,具有剂量适形度和治疗时间等优势的容积旋转调强放疗(Volumetric Modulated Arc Therapy,VMAT)技术备受有条件的放疗单位关注和应用[2-4]。然而当前仍然依靠人工经验进行放射治疗计划设计,这种模式降低了物理师的工作效率、增加了人力操作成本[5]。此外,计划设计者设置的条件参数不同可导致计划结果的不同。因此,计划设计者的经验以及设计所花费的时间很大程度上影响着计划设计的质量[6]。目前,已经有不少研究者研究如何降低人为因素导致的计划质量差异和提高剂量设计的效率[7-8]。Pinnacle3 V9.10放射治疗计划系统(Treatment Planning System,TPS)新增了自动计划模块(Auto-Planning),可实现自动化的治疗计划设计。目前Auto-Planning已运用在宫颈癌、鼻咽癌和直肠癌等病例上,结果表明自动计划比人工计划好[9-11]。但自动计划还很少应用于胸部肿瘤上,因此本研究通过比较13例食管癌患者VMAT人工计划设计和Auto-Planning 设计的剂量学差异,探讨食管癌自动VMAT计划是否具有剂量学优势,从而为食管癌临床放射治疗应用提供参考。
1 材料与方法
1.1 病例选择
随机选取本院2018年6月至2019年9月期间行同期放化疗的食管癌患者作为研究对象。纳入标准:① 入院KPS评分≥80分;② 无远处转移;③ 中上段食管鳞癌。13例患者纳入研究,其中男性9例,女性4例;Ⅱ期5例、Ⅲ期8例;年龄范围50~77岁,中位年龄64岁。本研究已获广州医科大学附属肿瘤医院伦理审查委员会批准。
1.2 CT定位及靶区勾画
患者颈胸热塑体膜固定,仰卧位双手臂上举交叉于额前,在Philips机型CT模拟定位机下分别做自由平静螺旋扫描和静脉增强扫描,扫描范围由下颌骨下缘至肝脏水平,层厚5 mm,获得CT图像在影像工作站进行三维重建,重建后CT断层图像经网络系统传输至Pinnacle3 9.10 TPS。
所有患者均由科室有经验的放疗医生根据ICRU第62号报告应用Pinnacle3 9.10计划系统在CT影像上勾画出肿瘤靶区(Gross Target Volume,GTV)、临床靶区(Clinical Target Volume,CTV)和危及器官(Organ At Risk,OAR),GTV为食管原发肿瘤病灶和局部区域肿大淋巴结,CTV由GTV前后左右外扩0.5 cm,纵轴方向外扩3 cm,包括食管旁淋巴结、纵隔淋巴结引流区等。计划肿瘤靶区(Planned GTV,PGTV)和计划临床靶区(Planned CTV,PCTV)由GTV和CTV在三维方向上分别外放0.5 cm得到,OAR包括脊髓、心脏和双侧肺组织等。靶区体积大小如表1所示。
表1 13例食管癌患者靶区的体积大小(±s)

表1 13例食管癌患者靶区的体积大小(±s)
靶区 长径/cm 横径/cm 体积/cm3 PGTV 7.68 ± 2.94 5.07 ± 3.14 70.34 ± 53.04 PCTV 12.84 ± 2.25 8.22 ± 4.75 256.93 ± 126.64
1.3 治疗计划设计
利用Pinnacle3 9.10 TPS系统对13例食管癌患者分别设计手动VMAT(Manual-VMAT)计划和自动VMAT(Auto-VMAT)计划。为方便比较,两种VMAT计划均采用360°单弧计划(机架从181°顺时针旋转至179°),选用Elekta Synergy S 加速器6 MV X线,搭配Agility 80对叶片的多叶光栅准直(Multi-Leaf Collimator,MLC)小机头,叶片宽度在等中心平面投影均为0.5 cm。
Manual-VMAT计划由本院资深物理师设计完成,首先对靶区和OAR进行外扩处理,然后物理师凭个人经验设置目标函数及其权重,经过TPS初步剂量计算后,根据当前的剂量分布情况反复调试优化,直到靶区和OAR的剂量满足临床要求。而Auto-VMAT首先利用Pinnacle3 V9.10系统中自带的Technique对靶区和OAR进行处理,对处理后的靶区和OAR进行限量后自动优化,优化过程中由系统自动生成剂量成形结构,并反复补充优化,使目标函数无限接近最优解,最终达到剂量满足临床要求。
处方剂量均为PGTV 60 Gy/30次、PCTV 54 Gy/30次。两组计划均采用相同剂量约束条件和优化参数,临床处方剂量要求:95%处方剂量线包绕至少95%靶区体积,靶区 Dmax<66 Gy。OAR 处方剂量要求 :双肺 V5<60%、V20<30%、V30<20%, 脊 髓 Dmax<45 Gy, 心 脏 V30<40%、V40<30%。优化权重设置:靶区(PGTV、PCTV)>脊髓>肺>心脏。
1.4 计划评估
通过剂量体积直方图(Dose Volume Histogram,DVH)得到Manual-VMAT和Auto-VMAT计划的靶区及OAR受照剂量-体积关系,然后两两进行对比分析。
(1)靶区。剂量分析指标为PTV的平均剂量(Dmean)、2%、95%、98%靶区体积所受到的照射剂量(D2%、D95%、D98%)、适形度指数(Conformity Index,CI)、均匀性指数(Homogeneity Index,HI)等指标,CI和HI的计算方法如公式(1)~(2)。

其中,Vt.ref为参考等剂量线面所包绕的靶区体积,Vt为靶区体积,Vref为参考等剂量线面所包绕的所有区域的体积,CI值越大,说明剂量线适形度越好,而D2%和D98%分别是2%、98%的靶区体积接受的吸收剂量,DRx是指计划设计设定的处方剂量,HI值越小,说明剂量分布越均匀。
(2)OAR。剂量分析指标为全肺分别受到不大于5、10、20和 30 Gy剂量照射的体积(V5、V10、V20和 V30),心脏的V30、V40和脊髓的最大点剂量(Dmax)等。
1.5 统计学分析
各项评估指标的均数均采用SPSS 19.0统计软件先进行正态分布分析,若满足正态分布,则行配对t检验,若不满足正态分布,则行Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 靶区剂量分布比较
两种计划的靶区剂量分布均能满足临床剂量要求,但Auto-VMAT计划在剂量分布均匀性和靶区覆盖度方面均略优于Munual-VMAT计划(图1)。对于PGTV来说,与Manual-VMAT计划比较,Auto-VMAT计划中的Dmean、D2%、D98%和 HI分别平均降低1.3%、1.8%、0.3% 和16.7%,差异有统计学意义(P<0.05);而对于PCTV来说,与Manual-VMAT计划相比,Auto-VMAT计划中的Dmean、D2%、D95%和HI分别平均降低0.9%、1.6%、0.8%和6.7%,差异有统计学意义(P<0.05);但CI增加了11.5%,差异也有统计学意义(表2)。

图1 1例食管癌患者的同一横截面CT示例
表2 两种VMAT计划靶区剂量分布比较(±s)
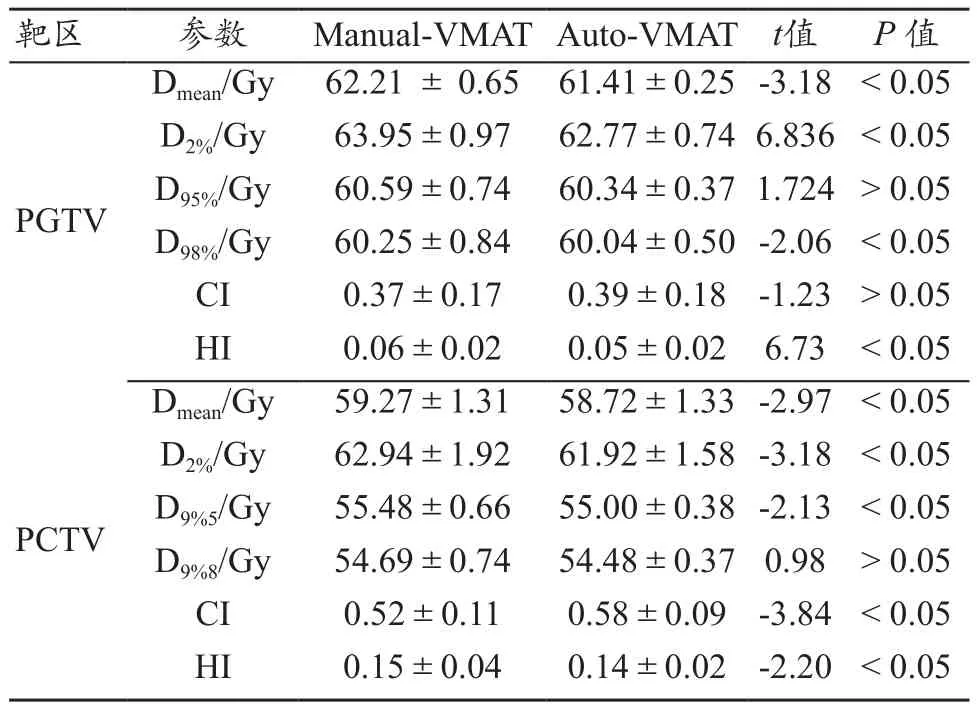
表2 两种VMAT计划靶区剂量分布比较(±s)
靶区 参数 Manual-VMAT Auto-VMAT t值 P 值PGTV Dmean/Gy 62.21 ± 0.65 61.41±0.25-3.18 < 0.05 D2%/Gy 63.95±0.97 62.77±0.74 6.836 < 0.05 D95%/Gy 60.59±0.74 60.34±0.37 1.724 > 0.05 D98%/Gy 60.25±0.84 60.04±0.50-2.06 < 0.05 CI 0.37±0.17 0.39±0.18 -1.23 > 0.05 HI 0.06±0.02 0.05±0.02 6.73 < 0.05 Dmean/Gy 59.27±1.31 58.72±1.33-2.97 < 0.05 D2%/Gy 62.94±1.92 61.92±1.58-3.18 < 0.05 D9%5/Gy 55.48±0.66 55.00±0.38-2.13 < 0.05 D9%8/Gy 54.69±0.74 54.48±0.37 0.98 > 0.05 CI 0.52±0.11 0.58±0.09 -3.84 < 0.05 HI 0.15±0.04 0.14±0.02 -2.20 < 0.05 PCTV
2.2 OAR剂量分布比较
从肺受量情况来看,与Manual-VMAT计划比较,Auto-VMAT计划中双肺的Dmean降低3.1%,V20、V30分别降低9.0%、19.1%(P<0.05);但双肺低剂量区V5、V10分别增加了5.7%、4.8%,但差异不具有统计学意义,仅V5的剂量差异具有统计学意义(P<0.05)。与Manual-VMAT计划比较,Auto-VMAT计划的心脏Dmean、V30和V40分别平均降低12.25%、23.0%和24.0%,Auto-VMAT计划中心脏、脊髓的剂量学指标均比Manual-VMAT计划中的明显偏低,剂量差异均有统计学意义(P<0.05)(图2、表3)。

图2 Manual-VMAT计划(实线)与Auto-VMAT计划(虚线)的OAR DVH比较
表3 两种VMAT计划OAR剂量分布比较(±s)
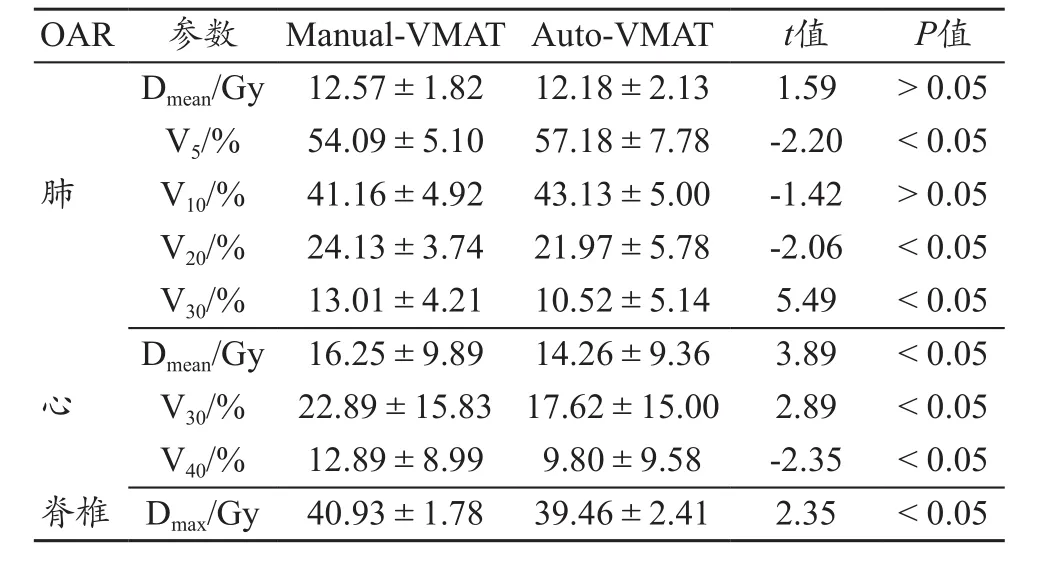
表3 两种VMAT计划OAR剂量分布比较(±s)
OAR 参数 Manual-VMAT Auto-VMAT t值 P值肺Dmean/Gy 12.57±1.82 12.18±2.13 1.59 > 0.05 V5/% 54.09±5.10 57.18±7.78 -2.20 < 0.05 V10/% 41.16±4.92 43.13±5.00 -1.42 > 0.05 V20/% 24.13±3.74 21.97±5.78 -2.06 < 0.05 V30/% 13.01±4.21 10.52±5.14 5.49 < 0.05 Dmean/Gy 16.25±9.89 14.26±9.36 3.89 < 0.05 V30/% 22.89±15.83 17.62±15.00 2.89 < 0.05 V40/% 12.89±8.99 9.80±9.58 -2.35 < 0.05脊椎 Dmax/Gy 40.93±1.78 39.46±2.41 2.35 < 0.05心
2.3 计划优化时间与机器跳数比较
计划平均优化时间包括前期各种参数的设置,以及优化到满足临床处方要求所需的全部时间。本研究入组病例中,自动计划的平均优化时间为50 min,而人工计划受到靶区与OAR位置关系以及物理师经验等因素的影响,优化时间最短约55 min,最长约100 min,平均优化时间约85 min。在机器总跳数方面,Manual-VMAT计划和Auto-VMAT计划的平均机器总跳数分别为(381.8±66.7)MU和(422.3±60.7)MU,自动计划总跳数增加了9.6%(P<0.05)。
3 讨论与总结
放疗计划的质量很大程度上取决于物理师在TPS上的优化技巧和优化时间。调强计划设计的本质就是根据目标函数和权重,TPS不断对MLC进行调制,优化子野形状,直到在一定范围内得到接近最优解的剂量分布,这是一个逆向寻优的过程[12]。因此,在Manual-Planning的优化过程中,计划设计者在寻找靶区和OAR最合理的剂量体积限值和优化权重方面需要花费大量时间。然而,物理师的计划设计思维和经验存在差异,且TPS优化结果通常具有大量的优化解,导致不同计划设计者的计划无法确定是否为临床的最优计划[13]。Auto-Planning可自动模拟经验丰富剂量师、物理师的计划设计思维,根据初始给定的射线束和处方参数,自动创建并添加额外的剂量适形辅助轮廓,修正剂量冷点、热点,并通过反复调整IMRT/VMAT目标优化函数和权重,对OAR和靶区的重叠区域进行自动补偿,从而实现最大化靶区剂量覆盖和最小化OAR剂量[14]。
本研究结果显示,两种食管癌VMAT计划的靶区剂量覆盖均能满足临床处方要求,与Manual-VMAT计划相比,Auto-VMAT计划不仅没有降低靶区剂量均匀性和适形度,而且靶区的受照剂量评估指标均整体偏低,表明自动计划更具有优势。此外,本研究结果还显示,Auto-VMAT计划明显减少了肺高剂量区(V20、V30)、脊髓、心脏的照射剂量,表明自动VMAT计划整体上降低了OAR的平均剂量,这与李凯旋等[11]的研究结果相似;这也说明在人工计划的设计过程中,计划设计者由于经验和时间有限,不能保证将每一个OAR限制到最低剂量,这或许是人工计划质量低于自动计划的重要原因。而自动计划最大的优势是在保证靶区覆盖率的前提下尽可能地收紧对所有OAR剂量的限制,同时减小各个OAR限量在相似靶区之间的变化,在有限的时间内保证治疗计划的质量[15]。
然而,本研究结果还显示,食管癌自动VMAT计划中的双肺低剂量区(V5、V10)略微升高(仅V5的剂量差异有统计学意义),但也在临床可接受的范围;升高的原因可能是 Auto-Planning计划对脊髓、心脏等其他OAR的剂量限值过于严格,计划优化时,经过该区域的VMAT调制通量减少,导致经过双肺组织区域的通量增加。在本研究中,与人工计划相比,每个计划的机器跳数平均增加了41 MU,原因可能是自动计划通过添加更多的MLC调制从而实现了更好的计划剂量分布。
本研究所选取的食管癌病例的靶区体积相对较小,因此基于Auto-Planning技术的VMAT计划能达到满意的结果;但本研究也尝试做了特别复杂或靶区体积较大的食管癌病例的研究,自动计划未能很好地达到临床处方要求,基于人工智能设计出来的放疗计划质量都不会超过资深物理师自己设计的质量。此外,Auto-Planning的局限性还在于不能自动生成多处方或多中心点的治疗计划,不具备射野角度优化功能,以及无法制作调强与适形的混合计划[16]。
综上所述,本研究显示Auto-Planning适合做大量中低档难度的、重复性高的早期病例;Auto-Planning的应用可避免人工计划设计过程中重复和烦琐的操作,缩短计划设计时间,提升计划设计效率,从而减轻物理师做计划的负担。同时,Auto-Planning的应用也有助于消除不同设计者之间计划质量差异,也可应用于计划设计初学者的训练。未来进一步的研究也将探索Auto-Planning的临床应用价值。

