形变配准法与直接叠加法用于宫颈癌内外照射累积剂量的研究
刘子成,崔相利,刘苓苓,王金云,费振乐,3
1. 安徽医科大学 生物医学工程学院,安徽 合肥 230032;2. 中国科学院合肥肿瘤医院 放疗中心,安徽 合肥 230031;3. 中国人民解放军联勤保障部队第901医院 肿瘤诊疗中心,安徽 合肥 230031
引言
宫颈癌是妇科常见的恶性肿瘤,发病率和死亡率均居世界第四位[1]。目前,宫颈癌治疗有手术、放疗和化疗三种方式,对于Ⅱ~Ⅳ期宫颈癌,体外放疗联合后装的根治性放疗是首选治疗方式[2]。在宫颈癌根治性放疗中,体外放疗后再进行近距离放疗既可提高肿瘤局部控制率,又可更好地保护周围正常组织[3]。由于宫颈癌患者内照射采用截石位且置入施源器,容易造成内照射分次间、内照射与外照射体位间较大差异,从而造成剂量评估的差异。目前,临床上普遍使用的剂量叠加方法是基于生物学效应的线性二次方程模型的直接叠加法,该方法简洁、方便,可快速给出剂量叠加的结果[4],但忽略了体位差异,无法确保剂量叠加的准确性。形变配准是一种可较大程度地削弱体位差异,提高剂量叠加精度的方法[5-6]。目前,可进行形变配准的软件有多模态图像合并(Multi-modality Image Merger,MIM)软件和Velocity软件,前人验证了MIM软件在弹性模体形变配准中的可靠性和精度[7-8]。劳峥等[9]对比分析MIM和Velocity软件之间的形变配准精度,发现两者均能满足临床应用,而MIM操作更加简便。由于MIM软件属于商业化软件,很多医院暂未配备。本研究借助MIM软件和宫颈癌患者的内外放疗计划,运用直接叠加法和形变配准法对内照射剂量和内外照射剂量进行叠加,对比分析两种叠加法的差异,评估直接叠加法评估的准确性。
1 材料与方法
1.1 病例资料
随机选取2020年1月至2020年12月在中国科学院合肥肿瘤医院行根治性放疗的10例宫颈癌患者的CT影像资料,年龄53~81岁(中位年龄为66.5岁)。根据国际妇产科联合会制定的标准[10],10例患者临床分期为宫颈癌ⅡA期3例、宫颈癌ⅡB期1例、宫颈癌ⅢB期2例、宫颈癌ⅢC期4例。所有患者均先进行体外放疗后再进行三维腔内近距离治疗。
1.2 定位CT扫描及靶区、危及器官勾画
患者扫描外照射定位CT前1 h排空膀胱,口服泛影葡胺溶液500 mL(配比为泛影葡胺40 mL:水1000 mL)。仰卧位,双手互握肘置于头顶,并拢双腿,热塑膜固定,在患者体表和体膜上做好标记。使用飞利浦公司的大孔径CT模拟定位机对患者进行CT扫描。扫描参数为:电压120 kV,曝光325 mAs,层厚5 mm。发送CT图像至Monaco 5.11计划系统。根据放射治疗肿瘤协作组指南[11],逐层勾画临床靶区(Clinical Target Volume,CTV)。CTV定义为肿瘤组织及可能浸润的亚临床病灶,包括子宫、宫颈、部分阴道、盆腔及部分腹主动脉旁淋巴结引流区。CTV边缘外放0.5 cm形成计划靶区(Plan Target Volume,PTV),并勾画出膀胱、直肠、小肠等危及器官(Organ At Risk,OAR)。
患者每次内照射定位前1 h口服泛影葡胺溶液500 mL(配比为泛影葡胺40 mL:水1000 mL),排空膀胱,截石位,在后装治疗床上使用真空垫固定体位。插入Foley导尿管,并于气囊内注入20%泛影葡胺7 mL。扫描定位CT时、治疗前膀胱中分别注入100 mL的生理盐水,其他时间排空膀胱。宫腔和阴道内同时放置施源器,同一患者均使用同一款施源器进行分次治疗。每次治疗前,使用大孔径CT模拟定位机扫描CT图像。扫描参数:电压120 kV,曝光325 mAs,层厚3 mm。发送CT图像到Varian BrachyVision后装治疗计划系统。根据欧洲放射治疗协会指南[12],放疗医师逐层勾画CTV及OAR。临床靶区定义为放化疗后残存肿瘤最大的区域,包括整个子宫颈和明显残留的宫颈和宫颈以外的肿块,OAR包括膀胱、直肠和乙状结肠。
1.3 放疗计划设计
宫颈癌患者外照射计划均采用VMAT共面双弧技术,且在Monaco 5.11计划系统中实现。处方剂量为50 Gy/25次,95%以上体积的PTV均达到处方剂量;OAR限量要求参照RTOG0418[13]。计划评估参数包括PTV的适形度(Coverage Index,CI)、剂量不均匀性指数(Heterogeneity Index,HI)、小肠、直肠、膀胱、乙状结肠、双侧股骨头接受30、40和50 Gy照射的体积占总体积的百分比(V30、V40、V50)和脊髓所受的最大剂量(Dmax)。
宫颈癌患者内照射计划均采用三维腔内近距离放疗,在Varian BrachyVision计划系统中设计放疗计划。每位患者均行5次三维腔内治疗,处方剂量为6 Gy/次,90%以上体积的CTV达到处方剂量;OAR限量要求参照Report 89号报告[14]。计划评估参数包括接受最大剂量的膀胱、直肠和乙状结肠的0.1 cm3和2 cm3体积所接受的最小剂量(D0.1cc、D2cc)。
1.4 内照射和外照射剂量叠加方法
1.4.1 直接叠加法
根据GEC-ESTRO妇科协作组推荐指南Ⅰ~Ⅳ[12,15-16]中OAR累积剂量的计算方法是假设一个“最坏情况”,即假设每次放疗的最高剂量都落在同一位置上。内、外照射累积剂量直接叠加的前提是需要将内照射中OAR的D2cc、D0.1cc利用公式(1)[15]计算为等效成2 Gy时的吸收剂量(Equivalent Dose,EQD2Gy)。因外照射为单次剂量2 Gy的分次治疗(假设外照射的肿瘤及危及器官均接受了100%的处方剂量且受照剂量均匀[14]),OAR剂量数值可与内照射计算的EQD2Gy直接相加。
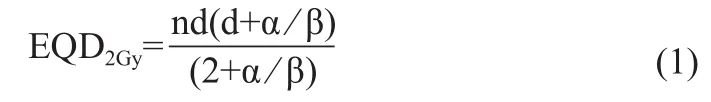
其中,n为治疗次数;d为分次剂量;α/β值中肿瘤取10,OAR取3。列举2例如下。
(1)例1:计算某例患者的三维腔内近距离放疗计划6 Gy×5次的肿瘤靶区EQD2Gy。按照公式(1)和放疗计划剂量体积直方图(Dose-Volume Histogram,DVH)中的数值,n1×d1=6.09;n2×d2=6.25;n3×d3=6.19;n4×d4=6.00;n5×d5=6.13,n1、n2、n3、n4、n5 均为 1,肿瘤 α/β 值为 10,则
(2)例2:计算某例患者的三维腔内近距离放疗计划 6 Gy×5次的膀胱D2cc的EQD2Gy。按照公式(1)和DVH中的值,n1×d1=4.84;n2×d2=4.92;n3×d3=4.97;n4×d4=4.83;n5×d5=4.69,n1、n2、n3、n4、n5均 为 1, 膀 胱 值 为 3,则
以EQD2Gy作为标准等效剂量,解决了不同分割放疗的等效剂量计算问题。直接叠加法就是将外照射剂量转换为常规2 Gy分次放射的等效剂量,再与计算后的内照射总EQD2Gy直接相加。
1.4.2 形变配准法
本研究借助MIM 6.8.4软件中的形变配准工作流对宫颈癌内照射剂量、内外照射剂量进行叠加。MIM软件中形变配准算法是利用图像灰度进行变形,通过空间变换来寻找CT图像像素之间的空间对应关系,引入多个自由度测量像素对其间的相似度使全局达到最优,从而实现较高配准度[17]。
(1)内照射分次间剂量叠加。将CT图像导入MIM 6.8.4软件中,将第一次治疗CT图像作为参考图像,第二次治疗CT图像作为目标图像。先基于盆腔骨标志进行刚性配准,再以灰度为基础进行密度形变配准,最后形成融合CT和叠加剂量参数。按照治疗顺序将内照射5次治疗的CT图像进行形变配准。
(2)内外照射剂量叠加。如图1所示,在MIM中将外照射治疗CT图像作为参考图像,5次内照射治疗配准融合新CT图像作为目标图像,同样先进行盆腔骨解剖结构的刚性配准,减少图像像素之间的位置差,提高配准速度和精度,再进行形变配准形成融合CT和叠加剂量参数。

图1 MIM软件中宫颈癌内外照射剂量叠加示意图
配准过程中用Reg Refine功能检查形变结果,配准结果运用计算融合度中的归一化互信息和平均绝对值评价[18]。
1.5 统计学分析
采用SPSS 25.0软件进行数据处理,数据用±s表示。将两种方法获得的剂量参数进行成组设计资料的t检验,当P<0.05时,差异具有统计学意义。
2 结果
2.1 内照射分次间剂量叠加
本研究应用直接叠加法和MIM软件中的形变配准法分别对每例患者5次后装放疗计划进行剂量叠加,分析结果表明:直接叠加法所得肿瘤临床靶区D90%、膀胱D2cc、直肠D2cc、直肠D0.1cc分别为6.54、1.66、4.05和9.66 Gy,且均有明显差异(P<0.05)。直接叠加法所得膀胱D0.1cc、乙状结肠D2cc和D0.1cc的平均值比形变配准法的结果分别低6.51、0.31和31.19 Gy,膀胱D0.1cc差异有统计学意义(P<0.05),但乙状结肠D2cc和D0.1cc均无明显差异(P>0.05)(表1)。
表1 内照射分次剂量叠加剂量学比较(Gy,±s)

表1 内照射分次剂量叠加剂量学比较(Gy,±s)
参数 直接叠加法 形变配准法 t值 P值临床靶区D90%40.01±5.97 33.47±7.07 -4.129 0.003膀胱D2cc 33.08±5.06 31.42±4.87 -3.236 0.010膀胱D0.1cc 38.61±6.98 45.12±10.24 4.376 0.002直肠D2cc 27.43±6.66 23.38±4.20 -4.168 0.002直肠D0.1cc 47.56±9.25 37.90±4.32 -3.405 0.008乙状结肠D2cc15.54±4.49 15.85±8.94 0.130 0.899乙状结肠D0.1cc30.43±10.27 61.62±93.74 1.038 0.326
2.2 内外照射剂量叠加
采用两种叠加方法对内、外照射剂量进行叠加,可得宫颈癌患者总照射剂量。其中,直接叠加法所得肿瘤临床靶区D90%、膀胱D2cc、直肠D2cc、直肠D0.1cc、乙状结肠D2cc的平均值比形变配准法的结果分别高5.35、0.78、6.72、10.6和1.57 Gy,临床靶区D90%、直肠D2cc、直肠D0.1cc有明显差异(P<0.05),而乙状结肠D2cc、膀胱D2cc均无统计学意义(P>0.05)。直接叠加法所得膀胱D0.1cc和乙状结肠D0.1cc的平均值比形变配准法的结果分别低7.7、31.36 Gy,膀胱D0.1cc差异有统计学意义(P<0.05),但乙状结肠D0.1cc无明显差异(P>0.05)(表2)。
表2 内外照射剂量叠加剂量学比较(Gy,±s)

表2 内外照射剂量叠加剂量学比较(Gy,±s)
参数 直接叠加法 形变配准法 t值 P值临床靶区D90% 90.01±5.97 84.66±7.28 -3.090 0.013膀胱D2cc 83.08±5.06 82.30±4.98 -0.822 0.432膀胱D0.1cc 88.61±6.98 96.31±10.52 4.296 0.002直肠D2cc 77.43±6.66 70.71±6.31 -4.321 0.002直肠D0.1cc 97.56±9.25 86.96±6.05 -3.227 0.010乙状结肠D2cc 65.54±4.49 63.97±9.74 -0.636 0.540乙状结肠D0.1cc 80.43±10.27 111.79±91.20 1.073 0.311
3 讨论
目前,外照射联合后装是宫颈癌根治性放疗的首选方式。在不超过OAR的耐受剂量前提下,提高靶区肿瘤剂量可达到根治效果[19-20]。临床上使用直接叠加法计算宫颈癌内外照射后靶区和OAR总剂量,该方法忽略了两种放疗方式的体位差异、剂量不均匀等因素[21]。梁有腾等[22]采用三种配准方法(B样条弹性配准、仿射配准和刚性配准)探讨了宫颈癌自适应外照射累积剂量及其差异,研究结果表明采用弹性配准方法能获得较准确的照射总剂量。为了探究直接叠加法应用于宫颈癌分次间内照射和内外照射剂量累积的准确性,本研究利用MIM软件中形变配准法对宫颈癌分次间内照射剂量和内外照射累积剂量进行叠加,所得结果与直接叠加法结果进行对比分析。
本研究发现宫颈癌分次间内照射剂量和内外照射剂量叠加时,直接叠加法所得临床靶区D90%比形变配准法结果高出5 Gy以上且均有明显差异(P<0.05)。直接叠加法所得OAR值比形变配准法结果高出2 Gy以上且均有明显差异(P<0.05)。导致这一结果的原因可能是直接叠加法是假设每次治疗的最高剂量都落在同一位置上,且认为内外照射时OAR所受剂量均匀且解剖位置不发生改变。直接叠加法易夸大OAR所受照剂量,不利于靶区剂量的保证,导致靶区剂量不足,降低疗效。
Brock等[23]根据AAPM-132号报告中指出形变配准过程中产生较大剂量误差的原因是将靠近OAR的肿瘤靶区剂量形变到了OAR上,导致OAR剂量增加。本研究结果中膀胱D0.1cc的形变叠加结果大于直接叠加结果,可能是MIM软件进行形变配准时将靠近膀胱的肿瘤靶区剂量形变到了膀胱壁上,造成较大剂量误差。Latifi等[24]对图像配准精度实际量化后发现在形变配准过程中引入大量自由度会导致密度矢量场产生模糊,稳定性较差,易使D0.1cc评价指标容易产生较大误差,本研究中部分OAR的D0.1cc数值不稳定。Flower等[25]研究宫颈癌近距离放疗剂量累积的形变图像配准中OAR解剖位置稳定性时发现器官运动也会导致形变配准结果产生误差,因此本研究中不同患者间乙状结肠D0.1cc的形变叠加结果差异较大。本研究发现在内外照射图像采集前保持膀胱充盈度一致,且患者分次内照射时置入同一款施源器,可以帮助提高形变配准和剂量叠加的准确性,与Abe等[26]研究结果一致。有研究发现MIM软件中Reg Refine功能可以很好地检查形变配准精度和结果,保证配准精度[27]。本研究过程中通过Reg Refine功能不断检查形变结果以确保配准精度。
4 结论
直接叠加法和形变配准法均可适用于叠加宫颈癌内外照射总剂量。直接叠加法快速简便,但可能会造成评估OAR剂量偏高,靶区剂量不足,影响治疗效果。MIM软件中的形变配准法可以相对准确地反映宫颈癌内外照射累积剂量,可为没有配备形变配准软件的医院的临床医生和物理师提供一定的参考依据。但本文也存在不足之处,研究病例数较少,之后将收集更多的病例,进一步充实本文的实验结果。

