计算网格大小对脑肿瘤立体定向放射治疗剂量学的影响
刘力闽,陈馨薇,罗静,康盛伟, 黎杰,王培,吴骏翔
1. 仁寿县人民医院 肿瘤科,四川 仁寿 620500;2. 四川省肿瘤医院(研究所)/四川省癌症防治中心/电子科技大学医学院放射肿瘤学四川省重点实验室,四川 成都 610041
引言
据统计,20%~40%的肿瘤患者会出现脑转移瘤[1]。立体定向放射治疗(Stereotactic Radiotherapy,SRT)单次高剂量、少分割次数、高等效生物剂量、靶区外剂量快速跌落等特点结合容积弧形调强放射治疗技术(Volumetric Modulated Arc Therapy,VMAT)已广泛地应用于脑肿瘤治疗[2-4]。计划系统在VMAT等调强技术的剂量计算过程中提供了多种剂量计算网格(Dose Calculation Grid Size,DCGS)的参数设置,计算网格越小结果越精确,但计算时间却成倍增长[5-6]。目前,国内外很少有关于计算网格大小对脑肿瘤SRT物理剂量和生物剂量影响的研究,需要确定一个最优的计算网格大小,在保证剂量计算精度、计划质量的同时尽可能地提高优化效率。根据美国医学物理学家学会(American Association of Physicists in Medicine,AAPM)的TG101报告[7]建议,SRT技术应使用0.2 cm或者更小的剂量计算网格,不建议使用0.3 cm或更大的计算网格。因此,本研究选取脑肿瘤患者应用SRT技术,比较0.1、0.2和0.3 cm计算网格对VMAT计划质量和优化效率的影响,为VMAT进行脑肿瘤SRT选择合适的计算网格提供数据支持。
1 材料与方法
1.1 患者资料
选择2020年1月至2020年10月本院收治的脑转移瘤患者10例(肿瘤位置:额叶4例、顶叶3例、颞叶3例),年龄48~66岁(≥55岁的6例),中位年龄51岁,男女各半,所有患者均无放疗禁忌证。患者靶区体积为2.8~37.7 cm3(<10 cm3的 4例,≥ 20 cm3的 4例),中位体积 15.2 cm3。
1.2 CT定位和靶区危及器官勾画
患者采用仰卧位,头部热塑膜固定体位,采用Philips Brilliance TM CT BigBore4 16排大孔径CT扫描机,扫描层厚0.3 cm。扫描后将患者CT数据传送至美国MIM Software公司的MIM Maestro软件由主管医生勾画计划靶区(Planning Target Volume,PTV)和危及器官(Organ at Risk,OAR)。OAR包括脑组织、脑干、眼球、晶体、视交叉、视神经以及垂体。
1.3 处方剂量和计划设计
PTV处方剂量40 Gy,5次,8 Gy/次。计划要求处方剂量,即40 Gy剂量线至少要覆盖95%的靶区体积,靶区内Dmax<125%处方剂量。采用美国瓦里安公司的Eclipse 11.0放射治疗计划系统,优化算法为PRO(Progressive Resolution Optimizer)11.0.31版本,剂量计算采用AAA(Anisotropic Analytical Algorithm)11.0.31版本。加速器采用瓦里安公司的Novalis TX,其中32对0.25 cm多叶光栅,28对0.50 cm多叶光栅。射线能量为6 MV X射线,均整器模式(Flattening Filter,FF),剂量率最大600 MU/min。计划设计采用共面、VMAT、FF,3个全弧(弧1顺时针181°~179°,弧2逆时针 179°~181°,弧 3 顺时针 181°~179°)。分别选择 0.1、0.2、0.3 cm计算网格(DCGS1、DCGS2和DCGS3组)进行VMAT设计,优化时3组PTV和OAR的条件一致。
1.4 计划评价指标
靶区评估采用95% PTV体积的剂量D95、D50、适形度指数(Conformity Index,CI)[8]以及梯度指数(Gradient Index,GI )[9]。CI=(TVPV)2/(TV×PV),其中 TVPV为处方剂量所覆盖的PTV的体积,TV为PTV的体积,PV为处方剂量线所覆盖的总体积。GI定义为50%处方剂量所包裹的体积与处方剂量所包裹的体积之比。CI值越接近1表示适形度越高。GI值越小表示剂量跌落越快。OAR的评估指标包括脑组织的V5、V10、V15、V20、V25和平均剂量Dmean;脑干最大值Dmax;眼球Dmax;晶体Dmax;视交叉Dmax;视神经Dmax;垂体Dmax;另外,还统计3组计划的机器跳数和优化时间。Vn<m表示n Gy剂量所包裹的OAR的体积小于m%。
1.5 统计学分析
采用SPSS 23.0对本研究中3组计划的剂量学参数进行配对t检验分析,数据以±s表示。P<0.05为差异有统计学意义。
2 结果
2.1 PTV和OAR剂量学比较
3组PTV和OAR剂量参数结果列于表1。3组计划得到的靶区D95和D50参数的差异无统计学意义(P>0.05)。DCGS1组得到的CI优于DCGS3组,差异有统计学意义(t=-2.34,P<0.05)。DCGS1组得到的 GI优于 DCGS2和DCGS3两组相比,分别下降了6.31%和13.45%,差异有统计学意义(t=-8.57、-6.03,P<0.05)。图1为3组计划在横截面的剂量分布图,其中图1a、1b、1c分别是0.1、0.2、0.3 cm计算网格,剂量线从1500 cGy至5000 cGy,结合3组计划得到的GI可知随着计算网格的减少,靶区外的剂量跌落更加陡峭。3组计划在脑干、眼球、晶体、视神经和视交叉等OAR的差异无统计学意义(P>0.05)。正常脑组织的剂量学参数,随着计算网格的降低而降低,其中 DCGS1组与 DCGS3组相比,V5、V10、V15、V20、V25和Dmean分别下降了3.11%、2.85%、1.25%、0.60%、0.33%以及 0.45 Gy,差异有统计学意义(t=-7.50、-5.60、-5.11、-5.62、-6.55、-9.16,P<0.05);与DCGS2组相比,V5、V10、V15、V20、V25和Dmean分别下降了1.44%、1.23%、0.52%、0.25%、0.14%以及0.20 Gy,差异有统计学意义(t=-7.66、-7.16、-4.83、-5.48、-8.15、-11.76,P<0.05)。
表1 10例患者3组PTV和OAR剂量参数结果(±s)
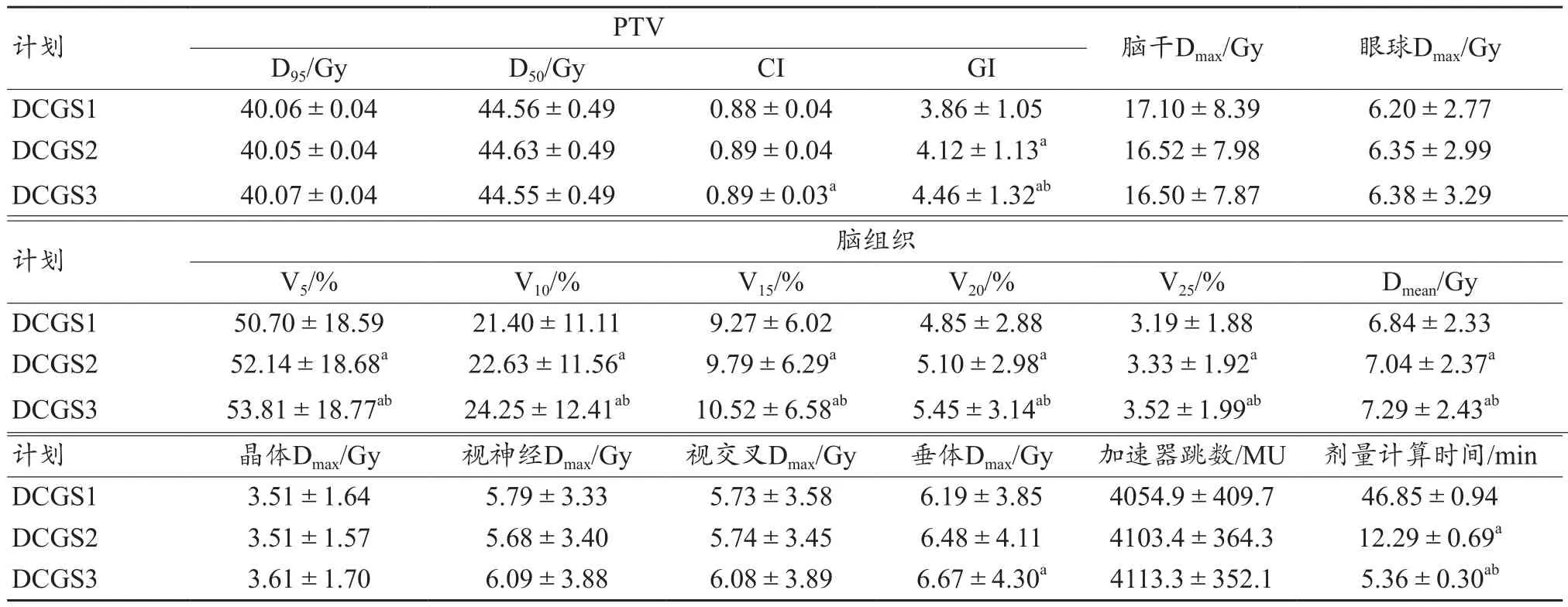
表1 10例患者3组PTV和OAR剂量参数结果(±s)
注:a与DCGS1组相比,P<0.05;b与DCGS2组相比,P<0.05。
计划PTV 脑干Dmax/Gy 眼球Dmax/Gy D95/Gy D50/Gy CI GI DCGS1 40.06±0.04 44.56±0.49 0.88±0.04 3.86±1.05 17.10±8.39 6.20±2.77 DCGS2 40.05±0.04 44.63±0.49 0.89±0.04 4.12±1.13a 16.52±7.98 6.35±2.99 DCGS3 40.07±0.04 44.55±0.49 0.89±0.03a 4.46±1.32ab 16.50±7.87 6.38±3.29计划 脑组织V5/% V10/% V15/% V20/% V25/% Dmean/Gy DCGS1 50.70±18.59 21.40±11.11 9.27±6.02 4.85±2.88 3.19±1.88 6.84±2.33 DCGS2 52.14±18.68a 22.63±11.56a 9.79±6.29a 5.10±2.98a 3.33±1.92a 7.04±2.37a DCGS3 53.81±18.77ab 24.25±12.41ab 10.52±6.58ab 5.45±3.14ab 3.52±1.99ab 7.29±2.43ab计划 晶体Dmax/Gy 视神经Dmax/Gy 视交叉Dmax/Gy 垂体Dmax/Gy 加速器跳数/MU 剂量计算时间/min DCGS1 3.51±1.64 5.79±3.33 5.73±3.58 6.19±3.85 4054.9±409.7 46.85±0.94 DCGS2 3.51±1.57 5.68±3.40 5.74±3.45 6.48±4.11 4103.4±364.3 12.29±0.69a DCGS3 3.61±1.70 6.09±3.88 6.08±3.89 6.67±4.30a 4113.3±352.1 5.36±0.30ab

图1 3组计划的横截面剂量分布图
2.2 机器跳数和剂量计算时间比较
3组计划得到的机器跳数差异无统计学意义(P>0.05)。DCGS1、DCGS2和DCGS3组的剂量计算时间分别为46.85、12.29和5.36 min。随着计算网格的增加,剂量计算时间显著降低,DCGS3组与DCGS2组和DCGS1组相比,计算时间分别降低了56.39%和88.56%,差异有统计学意义(t=10.71、51.00,P<0.05)。
3 讨论
SRT技术是脑肿瘤的主要治疗手段之一[10-11]。SRT技术是通过单次或少次(1~5次)给予靶区大剂量照射(6~30 Gy),为了最小化OAR的不良反应,需要严格控制靶区外的剂量跌落。因此,相比于常规放疗,SRT技术需要更加准确的剂量传递[7]。Dempsey等[12]通过理论和试验均证明了离散空间剂量计算网格在调强放疗剂量计算时会产生误差,应在计划优化时选择合适的剂量计算网格。在剂量计算中,使用不同的网格大小将会对剂量计算的准确性产生不同的影响,还会对剂量分布产生不同程度的影响。目前,国内外已有学者发布了关于计算网格对肺癌[13]、头颈部肿瘤[14]、宫颈癌[15]等部位计划的剂量学影响研究,而少有关于计算网格大小对脑肿瘤SRT剂量学影响的研究。随着脑肿瘤SRT技术在临床应用越来越广泛,更加需要如何选择计算网格的相关剂量学研究,以便为临床使用提供数据参考。基于此,本研究按照AAPM TG101报告[7]中推荐的SRT技术应使用不大于0.3 cm的计算网格进行剂量计算,比较了0.1、0.2、0.3 cm计算网格大小对脑肿瘤SRT剂量学参数和优化效率的影响,结果表明0.1 cm的计算网格在剂量梯度和正常脑组织保护上更具有优势,而0.3 cm计算网格在优化效率上更具优势。
改变剂量计算网格的大小会对剂量分布、计算精度和计算时间产生不同程度的影响[16-18]。乌晓礼等[16]的研究中使用PTW-VeriSoft调强验证软件得到计划验证通过率随着计算网格的减少而增加,0.3、0.4和0.5 cm计算网格时的计划通过率分别为96.7%、94.5%和91.7%。Chung等[5]研究表明使用0.15 cm和0.2 cm计算网格时的处方剂量相差2.3%,而与0.4 cm相比差异达到5.6%。本研究得到的结果表明改变剂量计算网格大小可对靶区外的剂量分布产生影响,这可能与SBRT技术靶区体积小、靶区外剂量跌落陡峭有关,计算网格的减少会最小化剂量梯度和体积平均效应的影响[19-20]。本研究中,靶区的GI值随着计算网格的增加而增加,计算网格0.3 cm与0.2 cm 和0.1 cm相比分别增加了0.34和0.60(P<0.05)。本研究中计算网格的改变对OAR的剂量体积影响较大,特别是正常脑组织。脑转移SRT治疗的放射性脑坏死的风险与肿瘤的位置、体积、处方剂量、脑组织的剂量学参数以及病理等因素有关,在计划设计中应严格控制脑组织的受照剂量。而随着计算网格的增加,脑组织的V5、V10、V15、V20、V25和 Dmean也随之增加,计算网格0.1 cm与0.2 cm和0.3 cm相比分别减少了1.44%、1.23%、0.52%、0.25%、0.14%及0.20 Gy,3.11%、2.85%、1.25%、0.60%、0.33%以及0.45 Gy(P<0.05);而计算网格的改变对OAR最大值的影响较小,3组计算网格得到的脑干、眼球、晶体、视神经和视交叉等OAR的最大值的差异均无统计学意义(P>0.05)。计算网格的减少不仅可以增加计划的精确性,还可以减少正常脑组织的受照剂量,这一结果为在脑肿瘤SRT中更好的保护正常脑组织提供了一种新的方法。
随着计算网格的减小,计算结果更加精确,但是却会显著提高剂量计算的时间,降低优化效率,特别是控制点较多的VMAT计划,需要在计算精度和计算效率之间平衡[21-22]。Mittauer等[17]研究发现,剂量计算时间随着计算网格的增加而减少,0.4 cm和0.3 cm网格的计划时间与0.2 cm相比分别减少了84.4%和69.8%。本研究中计算网格0.1、0.2和0.3 cm的剂量计算时间分别是46.85、12.29和5.36 min,0.1 cm计算网格的计算时间分别是0.2 和0.3 cm的3.81和8.74倍。0.1 cm计算网格与0.2和0.3 cm相比虽然可以提高计划质量,但是却明显降低优化效率,对于患者治疗压力较大的医院,该计算网格并不适合在临床应用。计算网格大小既影响剂量计算速度,也影响计算精度,需要根据实际情况在计划质量和优化效率之间合理选择。另外,本研究目前只比较了3种计算网格对于脑肿瘤SRT剂量分布和优化效率的影响,而对验证通过率的比较,需要进一步研究。
4 结论
综合考虑计划质量和优化效率,建议使用0.2 cm计算网格用于脑肿瘤的SRT技术,在满足剂量计算精度的同时也能保证优化效率。3组计划中,0.1 cm计算网格的计划质量最好,但优化时间较长,若只考虑计划质量则建议使用该计算网格。

