衣原体mRNA疫苗的研发对策与展望
金盈圻,王宗保,王 川
1 衣原体与mRNA疫苗
衣原体是一类具独特双相发育周期的多宿主革兰阴性胞内寄生病原体,感染人类和动物后可引发相关感染性疾病及并发症,如:沙眼衣原体(Chlamydiatrachomatis, Ct) 感染眼部粘膜可诱发眼部疾病,感染生殖道可诱发盆腔炎、不孕症和异位妊娠等严重后遗症[1];肺炎衣原体(Chlamydiapneumoniae, Cpn)感染不仅可诱发呼吸道疾病,是全球约10%的社区获得性肺炎发生的主要原因,也与反应性关节炎、哮喘以及动脉粥样硬化等许多慢性疾病密切相关[2];鹦鹉热衣原体(Chlamydiapsittaci, Cps)可引起全身性人兽共患感染性疾病——鹦鹉热[3-5],人感染能引起肺炎、急性呼吸窘迫综合征、败血性休克、脑膜炎、颅神经麻痹、心肌炎、心包炎等,鸟类及哺乳动物感染可引起呼吸窘迫、妊娠动物流产以及死产等[6]。衣原体感染常呈现轻微症状甚至无症状,抗生素治疗后常出现感染反复持续、迁延难愈现象,不仅对人类公共卫生造成威胁,家禽业、畜牧业等相关行业也遭受巨大经济损失。因此,研发安全高效的衣原体疫苗以有效预防衣原体感染性疾病的流行与暴发十分必要。
mRNA疫苗作为近年疫苗领域的研究热点,早在20世纪90年代初就有相关研究,但由于mRNA可被核糖核酸酶降解,稳定性较差,mRNA疫苗在最初阶段并未得到广泛使用[7]。经过近几十年的研究,mRNA疫苗目前已被广泛用于预防传染病以及防治癌症,在抗病毒、抗传染性疾病病原体方面也取得了长足进步。研究表明mRNA疫苗可在动物及人类感染中诱导产生安全且持久的免疫应答[8]。与灭活疫苗、减毒活疫苗、亚单位疫苗及DNA疫苗相比,mRNA疫苗在安全性、免疫性、灵活性等方面更具优势[8-13](表1):①mRNA在细胞质中转录,通过正常的细胞代谢过程降解,可避免因感染及插入诱变等因素引起的潜在基因整合风险;②部分mRNA本身具有佐剂特性,可促进免疫系统对特定抗原的免疫应答;③mRNA疫苗经酶促体外转录反应生产,无细胞扩增依赖性,具有快速、低成本以及可大量生产潜力;④mRNA疫苗可通过激活MHCI和MHCⅡ 两种途径来诱导CD4+T以及CD8+T细胞应答,而CD4+T细胞免疫应答与抗衣原体感染密切相关。因此,研发衣原体mRNA疫苗以控制衣原体感染具有极大可行性。

表1 衣原体不同疫苗类型比较Tab.1 Comparison of representative chlamydial vaccines
2 衣原体mRNA疫苗设计
mRNA疫苗的核心原理是将编码蛋白抗原的mRNA序列递送到宿主细胞中,并通过宿主细胞的表达系统合成相应蛋白,诱导宿主产生对该蛋白的免疫应答,以达到预防和治疗疾病的目的[23-25](图1A)。选择理想的候选抗原是mRNA疫苗设计研发的关键之一,因此,在设计衣原体mRNA疫苗时需保证mRNA编码的目标抗原蛋白具有较强的免疫原性及安全性。衣原体疫苗候选抗原包括质粒蛋白、主要外膜蛋白、多形态膜蛋白、热休克蛋白、蛋白酶样活性因子等[26](表2)。目前,正在研究的mRNA疫苗主要分为两类:传统的非扩增mRNA疫苗以及自扩增mRNA疫苗[8]。mRNA疫苗包括帽子结构、3′非翻译区和5′非翻译区、编码抗原蛋白的开放阅读框以及 Poly(A)尾结构等必要序列结构[27-28](图1A)。与传统的非扩增mRNA疫苗的快速表达相比,自扩增mRNA疫苗接种后会在稍长的时间里产生更高的抗原表达水平,并在体内持续数天,此外,自扩增mRNA疫苗还可在剂量较低时提供与非扩增mRNA疫苗等效的免疫保护[29]。
理想的mRNA候选疫苗应该能在减少副作用的同时将mRNA 分子的表达潜力和mRNA疫苗的免疫保护作用最大化。而mRNA的稳定性和成功翻译对于mRNA疫苗发挥良好效力至关重要。有研究表明,可以通过序列优化和修饰核苷来增强mRNA的稳定性,并提高其翻译效率,从而增强mRNA疫苗的效力[8]。除了mRNA自身稳定性问题,还有诸多因素会对mRNA疫苗接种的效用产生重要影响。我们将分别从衣原体mRNA疫苗设计的几个关键环节:目标抗原的选择、抗原递送策略、佐剂的选择以及免疫途径几个方面来总结合理设计衣原体mRNA疫苗的研发对策(图1B)。

A:mRNA疫苗原理图;B:衣原体mRNA疫苗设计流程 a: 非自扩增 mRNA 疫苗的必要结构: m7G-ppp-N结构又称为甲基鸟苷帽子结构(N:任何核苷酸);5′UTR 为5′非翻译区;3′UTR 为3′非翻译区;编码目标抗原(gene of interest,GOI)的开放阅读框; A (n)为聚腺苷酸化尾巴。b: 基于正链 RNA 病毒的自扩增mRNA疫苗的必要结构: m7G-ppp-N结构又称为甲基鸟苷帽子结构(N:任何核苷酸);5′UTR 为5′非翻译区;3′UTR 为3′非翻译区;编码目标抗原(GOI)的开放阅读框;编码病毒非结构蛋白的开放阅读框(non-structural genes, nsPs);sg Prom(subgenomic promoter)为亚基因组启动子;A (n)为聚腺苷酸化尾巴。图1 衣原体mRNA疫苗设计[8,30]Fig.1 Design of a chlamydial mRNA vaccine
2.1 衣原体目标抗原的选择
2.1.1 主要外膜蛋白(major outer membrane protein, MOMP) MOMP约占衣原体外膜蛋白成分的60%,是衣原体疫苗研究最为广泛的候选抗原。衣原体可以在宿主细胞内生存和复制,并可逃避宿主免疫应答,因此,理想的衣原体疫苗应可同时诱导T、B细胞应答[31],有研究表明针对MOMP的T、B细胞表位的单克隆抗体在体外能有效预防衣原体感染[31-33]。 但MOMP不能诱导交叉血清保护以及外源性表达MOMP不具天然构象等问题,导致MOMP使用受限[32]。然而,近来有研究发现,由多个血清型MOMP的可变域4(VD4)组成的一种亚单位疫苗Hirep1,解决了天然MOMP和重组MOMP引起的一些问题,并促进了中和抗体的产生[34]。使用以重组MOMP、Th1和Th2佐剂配制的亚单位疫苗免疫小鼠,可诱导抗鼠生殖道衣原体感染的长期免疫保护[35]。但基于MOMP构建的衣原体mRNA疫苗是否能解决重组MOMP的天然构象问题,增强交叉免疫保护仍有待确证。
2.1.2 质粒糖蛋白3(Plasmid glycoprotein 3, Pgp3) 大多数衣原体均携带一个约7.5 kb的质粒,编码8个开放阅读框(open reading frames, ORFs)。其中,ORF5编码的质粒蛋白Pgp3既可定位于衣原体外膜复合物,又能被分泌到宿主细胞的胞质,与宿主细胞相互作用,刺激宿主细胞产生体液免疫和黏膜免疫应答。此外,Pgp3中间结构域肽段可诱导黏膜免疫应答产生中和抗体,C端结构域肽段可通过与宿主TNFR1相互作用诱导输卵管炎症产生来促进衣原体清除[36-37]。也有研究表明重组Pgp3能经TLR2或者TLR4分别激活THP-1细胞和巨噬细胞诱导MAPK途径介导的促炎症因子产生[38]。此外,有研究表明小鼠接种重组Pgp3后可诱导保护性免疫应答[37]。小鼠接种以寡聚核苷酸CpG为佐剂的Cm Pgp3能诱导针对生殖道感染的免疫保护[39]。然而,Pgp3在衣原体感染以及诱发疾病过程中的作用机制尚未完全清楚。虽Pgp3为衣原体的重要毒力因子,但人抗体对识别Pgp3具有高度构象依赖性,mRNA疫苗能否解决外源性重组Pgp3与天然Pgp3间存在的蛋白质构象差异问题仍有待研究。
2.1.3 多形态膜蛋白(Polymorphic membrane proteins, Pmps) Pmps是一类位于衣原体外膜表面的蛋白,具有分子转运、黏附等相关功能,能被抗原提呈细胞识别和降解,加工并提呈给CD4+T细胞的外膜蛋白,能诱导宿主细胞免疫应答,包括通过激活转录因子NF-κB产生IL-8、IL-6和MCP-1(monocyte chemoattractant protein 1),其在衣原体感染过程中发挥重要作用[40]。有研究表明,PmpB、C、D和I能引起宿主较强的体液免疫应答;体外研究表明PmpD抗体能中和大多数血清型Ct,而PmpA、E在血清中的识别最低。此外,PmpE、H仅诱导CD4+T细胞产生较低水平的IFN-γ,因此不太适合衣原体亚单位疫苗研究[41-43]。有研究表明火鸡接种基于Cps PmpD的重组疱疹病毒疫苗后显示出PmpD特异性抗体增强,以及诱导的CD4+T细胞免疫应答水平显著升高[44]。因此在衣原体疫苗研究上,相比于其它Pmps,因能诱导中和抗体的产生及血清交叉保护效果,PmpD可能更具优势。
2.1.4 其它潜在抗原候选者 除上述候选抗原外(表2),还有其它潜在候选抗原:Ct分泌的衣原体蛋白酶样活性因子(Chlamydial proteasome-like factor,CPAF)已被证明可通过靶向宿主先天免疫效应分子来促进Ct在小鼠下生殖道定植,而单独使用重组CPAF或与其他抗原结合进行免疫,可以在各种小鼠品系和豚鼠中产生显著的抗感染免疫保护作用[48]。衣原体热休克蛋白也已被用作多种试验的抗原靶标,并已显示可诱导强烈的炎症反应[26],衣原体糖原磷酸化酶、核糖核苷还原酶和巨噬细胞感染性增强因子的诱导保护作用等还有待进一步评估[48]。
2.2 抗原的递送策略 由于将mRNA顺利递送至宿主细胞是mRNA 疫苗发挥效力的前提和基础,mRNA的配制和递送策略与抗原的表达、提呈和免疫刺激有关[24],所以选择合适的抗原递送方式对于设计理想的衣原体mRNA疫苗十分重要。总体而言,mRNA递送系统目前可大致分为脂类或类脂类递送系统和聚合物递送系统两大类。目前,脂质纳米颗粒(lipid-derived nanoparticles, LNP)是mRNA疫苗递送策略方面的研究热点,LNP递送不仅可以使mRNA避免于核酸酶降解而增强其稳定性,还可以促进细胞有效摄取,从而促进mRNA成功递送至细胞质作用位点[49-50]。阳离子脂质纳米颗粒可以通过静电吸附作用,以及与细胞膜融合特性,可将mRNA递送到细胞质中,其良好的生物相容性和易于扩大生产优势,使得阳离子脂质纳米颗粒成为较为理想的、有希望的mRNA递送系统之一[51-52]。此外,一类富含精氨酸的阳离子肽鱼精蛋白被广泛用作癌症和病毒mRNA疫苗的递送系统[8]。有研究报道由聚乳酸和阳离子穿透肽作为mRNA冷凝剂组成的纳米复合物可以被树突状细胞吸收,并且诱导蛋白质的高效表达和强烈的先天免疫应答[53]。

表2 衣原体疫苗常见候选抗原对比Tab.2 Comparison of antigens for anti-chlamydial vaccines
2.3 佐剂的选择 佐剂是一类可以与抗原结合并增强免疫反应的分子,是增强疫苗免疫效力的关键成分之一[53]。在Ct疫苗的首次临床试验结果中,分别以CAF01(Cationic Adjuvant Formulation 01)脂质体和氢氧化铝作为佐剂,与衣原体优势候选抗原CTH522一起进行接种,结果发现两种疫苗制剂安全性和耐受性均良好,均能诱导抗CTH522 IgG血清抗体产生,但是与含有氢氧化铝的制剂相比,以脂质体为佐剂的疫苗制剂具有更好的免疫原性[54]。CAF01脂质体有可能成为衣原体疫苗的候选佐剂。目前,mRNA疫苗中具有佐剂活性的分子主要分为4类[55-58]:①体外转录的mRNA,mRNA为佐剂时具有免疫刺激性,它能诱导多种细胞进行TNF-α和IFN-α的分泌[59];②直接作用的佐剂,如TLR/NOD受体激动剂、炎症小体激动剂等;③mRNA编码的免疫刺激分子,如CD40L、CD70、活性TLR4等;④RNA与特异性试剂(脂类试剂、鱼精蛋白等)的复合物。研究发现,MF59佐剂(一种水包油乳剂佐剂)与阳离子纳米乳剂配制的自我复制RNA疫苗显示出更高的免疫原性和效力[11, 22]。除此之外,还有研究发现选用TriMix(分别编码CD40L、CD70、活性TLR4的mRNA混合物)为佐剂的mRNA疫苗,可以增强mRNA的免疫原性,且与DC细胞成熟度、细胞毒性T淋巴细胞应答增加有关[60]。佐剂的使用对mRNA疫苗诱导的免疫应答的强度以及广度产生重要影响,佐剂的多样性为衣原体mRNA疫苗的佐剂选择方面提供了多种可能性(表3),也带来了许多机遇和挑战。
2.4 免疫途径 选择合适的mRNA疫苗免疫途径对抗原的表达以及免疫反应的效力十分重要[24]。有研究发现,通过粘膜途径递送疫苗可以使抗原与粘膜相关的淋巴样组织(MALT)相互作用,从而诱导粘膜免疫和全身免疫应答[66]。作为粘膜给药途径之一,鼻内接种mRNA疫苗可提供针对大流行疾病的即时免疫保护[67]。由于衣原体是粘膜相关病原体,所以,可以产生有效粘膜反应的免疫策略是衣原体疫苗研发的热点,有研究表明Ct疫苗通过鼻内或舌下给药可在生殖道上诱导强大的粘膜免疫力,虽然粘膜免疫可能是在生殖道建立免疫的最直接方法,但粘膜免疫仍然面临上皮屏障以及抗原降解等问题[68-69]。有研究表明,用紫外线灭活的Ct经黏膜免疫(子宫内或鼻内接种)后,可形成保护性CD4+Th1细胞,而Th1型细胞因子在抗衣原体感染及清除衣原体中发挥重要作用。另外,粘膜免疫的保护作用取决于组织常驻记忆T细胞和循环记忆T细胞这两种记忆T细胞亚群的协同作用,其中,组织驻留记忆T细胞能够即刻识别通过局部组织进入的病原体,并诱导强大的局部免疫反应来限
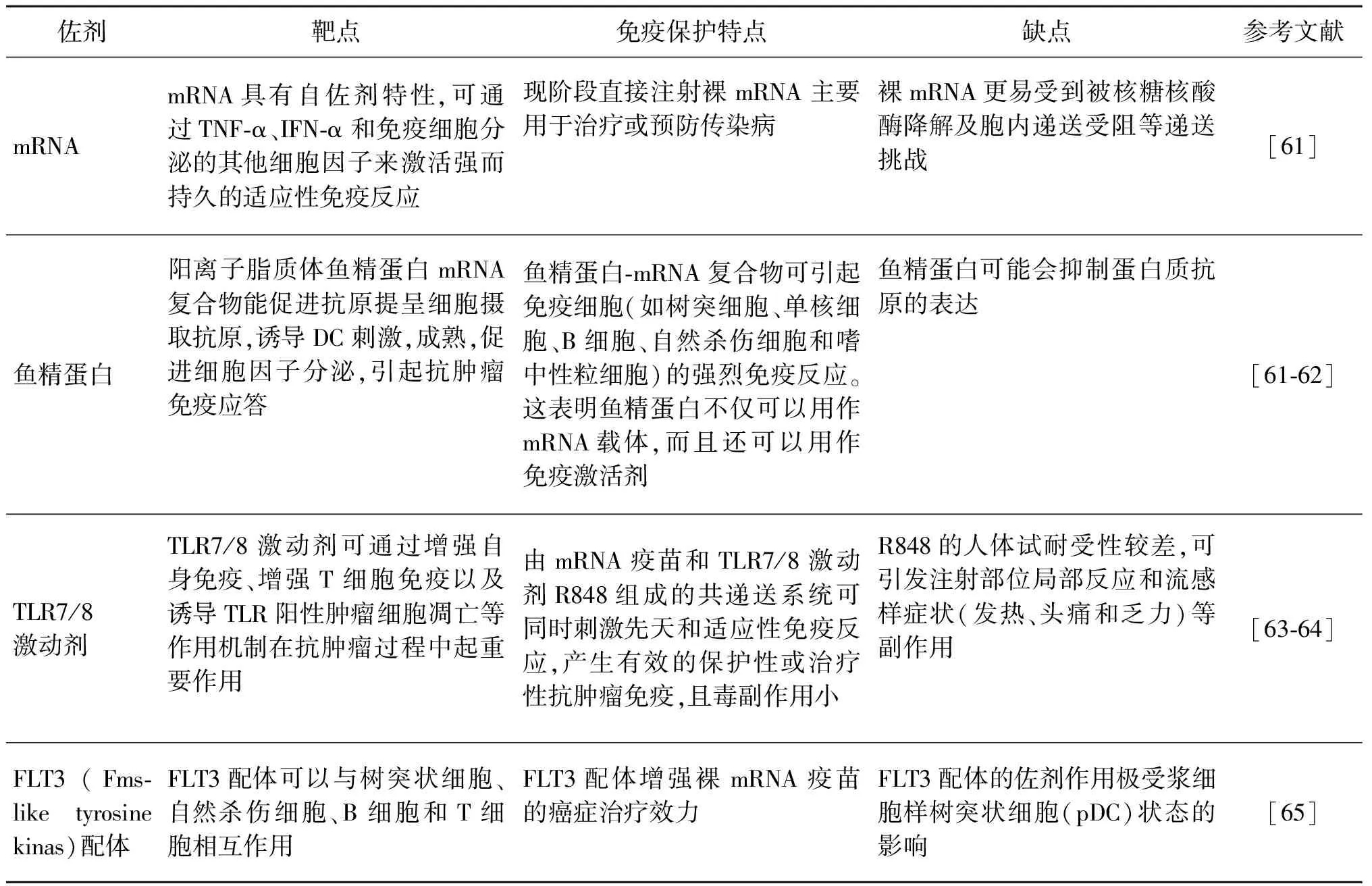
表3 mRNA疫苗常用佐剂Tab.3 Adjuvants for mRNA vaccines
制感染的扩散[70-72]。由此可见,黏膜免疫途径可成为衣原体等黏膜相关病原体mRNA疫苗重要的有效疫苗接种途径。除此之外,目前mRNA疫苗接种的途径还包括[67, 73-74]:皮内、皮下、肌内、淋巴结内以及静脉内给药等方式(表4)。其中,皮内、皮下以及肌内注射是抗感染性疾病mRNA疫苗的主要免疫途径,而静脉内、腹膜内给药常在需要抗原全身表达时选用,主要发挥治疗作用[8]。有研究表明,与皮内注射相比,皮下注射允许更大的注射量,但皮下区的吸收速率很慢,可能会导致mRNA疫苗意外降解[75]。而相比于皮内、皮下注射,肌内注射引起的局部副作用更小,所以,肌肉注射是佐剂疫苗使用广泛的给药途径[76]。

表4 mRNA疫苗主要免疫途径[24, 66]Tab.4 Major immunization routes of mRNA vaccines
3 展 望
研发安全有效的疫苗以预防衣原体感染是促进人类卫生和畜牧业健康发展的重要手段之一。虽然目前尚无衣原体mRNA疫苗相关文献报道,但有研究表明通过使用体外构建的结核分枝杆菌Ag85B-mRNA疫苗免疫小鼠,可诱导细胞免疫应答,并刺激机体产生高水平IFN-γ[18]。IFN-γ是宿主抗结核分枝杆菌及衣原体在内的胞内病原体感染的重要细胞因子。此外,COVID-19 mRNA疫苗BNT162b1可诱导宿主Th1型细胞免疫应答,而Th1型免疫应答在宿主清除衣原体感染过程中起关键作用[32, 77]。基于mRNA疫苗在抗传染性疾病方面的应用,证明mRNA疫苗在抗衣原体感染方面具有一定潜在应用价值,但衣原体mRNA疫苗是否可以获得成功仍存在一定的风险。不同衣原体菌株之间的毒力特性不一、感染途径多样、感染剂量不等以及宿主的免疫反应程度不同等众多方面的差异,可能会导致宿主发生疾病的形式、进程以及严重程度也会有所不同。此外,由于衣原体感染后能够诱导机体产生适应性免疫应答,这种特异性细胞免疫和体液免疫在机体清除衣原体过程中起一定作用,但同时也有可能会因此产生免疫病理损伤,而免疫病理损伤又有可能会促进衣原体感染引起的炎性损伤,所以,在设计预防性而非治疗性的理想抗衣原体感染mRNA疫苗时,需要对疫苗诱导的机体免疫应答程度做谨慎合理的把控,使得疫苗诱导合理适宜的保护性免疫应答,从而保证疫苗具有高效的预防性同时也具备良好的安全性。在衣原体mRNA疫苗设计过程中,目标抗原的选择、抗原递送方式、佐剂的使用以及免疫策略选择等环节均可能对mRNA的表达以及mRNA疫苗的免疫保护效力产生重要影响。所以,设计安全且有效的抗衣原体感染mRNA疫苗还面临许多风险和挑战,有待学者们继续进行探索研究。
利益冲突:无
引用本文格式:金盈圻,王宗保,王川. 衣原体mRNA疫苗的研发对策与展望[J].中国人兽共患病学报,2022,38(4):349-358. DOI:10.3969/j.issn.1002-2694.2022.00.032

