ANXA2敲除的A549细胞系的构建及其对H1N1和H9N2流感病毒复制的影响
刘永宁,马欣傲,吕思莹,李 媛,李旭勇,司振书,郭 晶,李玉保,刘 成
ANXA2是膜联蛋白家族中的一员,可以在胞浆、细胞膜以及细胞内囊泡中存在,也可以出现在细胞核中[8-9]。主要参与多种生物学过程,包括生物膜形成、调节细胞膜运输、内涵体形成和小囊泡集合、胞吐、信号转导、蛋白组装、细胞凋亡以及炎性应答等[10-12]。除此之外,ANXA2还能够参与多种病毒的入侵、复制、组装、出芽以及释放等生物进程[6]。据报道,ANXA2还参与流感病毒的入侵及成熟病毒粒子形成阶段[7,13],表明ANXA2在流感病毒感染致病过程中具有重要意义。
CRISPR/Cas9基因编辑技术是在细菌和古细菌研究中发现的,经过改造之后,是目前对基因组进行高效编辑的重要技术[14-15],具有操作简单、成本低和效率高等优点。随着CRISPR/Cas9技术的研究与发展,该技术已广泛应用于各种基因敲除细胞模型的建立中。如Wei等利用CRISPR/Cas9基因编辑技术筛选出SARS-CoV-2感染的关键宿主因子,包括受体ACE2和蛋白酶Cathepsin l[16]。Park等利用CRISPR/Cas9技术成功获得了ANP32A敲除细胞系,并发现ANP32A基因的敲除可通过降低病毒聚合酶活性来抑制流感病毒的复制[17]。为研究ANXA2在流感病毒复制过程中的功能,本研究利用CRISPR/Cas9技术构建了ANXA2敲除的A549细胞系,为在细胞水平上阐述流感病毒的复制过程和致病机制提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 病毒、细胞株和质粒 人流感病毒毒株A/WSN/1933(H1N1)简称WSN(H1N1)、禽流感病毒毒株A/chicken/Shandong/98/2018(H9N2)简称SD98(H9N2)由本实验室保存;人胚胎肾细胞(HEK293T,293T)、人肺腺癌细胞(A549)、犬肾细胞(MDCK)由本实验室购买并保存;质粒psPAX2、pMD2.G和LentiCRISPRv2均由华中农业大学张安定教授馈赠。
1.1.2 试剂 DMEM及F12培养基、胎牛血清(FBS)、胰酶均购自Gibco公司;限制性内切酶BsmBⅠ与T4 DNA连接酶购自NEB公司。转染试剂Lipofectamine 3000购自Thermo公司;大肠杆菌DH5α感受态细胞、质粒小提试剂盒、基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;无内毒素质粒提取试剂盒购自OMEGA公司;TPCK胰酶、聚凝胺(Polybrene)、嘌呤霉素(Puromycin)购自Sigma公司;PCR产物纯化试剂盒、胶回收试剂盒购自上海生工生物工程股份有限公司;CCK-8试剂盒购自GLPBIO公司;兔抗ANXA2抗体、鼠抗β-actin抗体为Proteintech公司产品。HRP标记的羊抗鼠IgG以及羊抗兔IgG抗体购自武汉戴安生物技术有限公司。
1.2 方 法
1.2.1 引物的设计与合成 根据GenBank数据库中人的ANXA2全基因序列(Gene ID号:302),标记出基因编码区。选取第3个外显子上合适的靶向位点,通过网站https://zlab.bio/guide-design-resources设计3对sgRNA,并根据sgRNA靶向区域设计特异性鉴定引物(表1)。设计的引物均由上海生工生物工程股份有限公司合成。

表1 引物序列Tab.1 Primer sequences
1.2.2 sgRNA重组质粒的构建 将成对的sgRNA寡核苷酸单链退火形成双链;载体LentiCRISPRv2经BsmBⅠ酶切后回收线性化的载体。用T4 DNA连接酶将退火后的sgRNA双链DNA与线性化的LentiCRISPRv2在16 ℃连接过夜,连接产物转化DH5α感受态细胞,分别构建质粒LentiCRISPRv2-ANXA2-sgRNA1 (简称ANXA2-sgRNA1)、LentiCRISPRv2-ANXA2-sgRNA2 (简称ANXA2-sgRNA2)和LentiCRISPRv2-ANXA2-sgRNA3 (简称ANXA2-sgRNA3)。挑取单克隆进行测序分析,测序正确后进行去内毒素质粒的提取。
2012年11月,于扬在易观国际集团第五届移动互联网博览会首次提出“互联网+”理念,他指出:“互联网+”公式应该是我们所在的行业目前的产品和服务,在与我们未来看到的多屏全网跨平台用户场景结合之后产生的这样一种化学公式[2]。
1.2.3 ANXA2基因敲除A549细胞株的筛选 将ANXA2-sgRNA1、ANXA2-sgRNA2及ANXA2-sgRNA3分别与慢病毒包装质粒psPAX2和pMD2.G(比例为:4∶2∶1)共转染至293T细胞,转染72 h后收集慢病毒备用。将状态良好的A549细胞接至6孔细胞板中,待细胞汇合度达到70%~80%时,接种上述慢病毒,并同时添加8 μg/mL polybrene。长满单层后,用嘌呤霉素进行压力筛选,观察未接慢病毒的对照组细胞全部死亡后,将实验组细胞消化成单个细胞,经细胞计数后以每孔一个细胞接种于96孔板中,培养7~10 d后挑取单克隆细胞并扩大培养,细胞系传代后冻存备用。
1.2.4 ANXA2敲除的A549细胞株的检测 收集单克隆细胞株,编号后用基因组提取试剂盒提取细胞基因组DNA作为模板。用表1中的突变鉴定引物,扩增sgRNA靶位点上下游区间的DNA序列。PCR产物经测序及序列比对,检测所获单克隆细胞株ANXA2基因的敲除效果。将经PCR鉴定为ANXA2基因敲除的单克隆细胞株(A549-ANXA2-KO)和野生型A549细胞(A549-WT)接种于6孔细胞板中,待长满后裂解细胞收集蛋白样品。用Western-blot方法检测ANXA2蛋白的敲除效果。其中目的条带孵育兔抗ANXA2抗体(1∶2 000),内参用鼠抗β-actin抗体(1∶5 000),二抗分别用HRP标记的羊抗兔IgG抗体(1∶5 000)和羊抗鼠IgG抗体(1∶5 000),通过化学发光成像仪检测ANXA2是否敲除。
1.2.5 细胞活力测定 将A549-ANXA2-KO和A549-WT细胞计数后,以1×104个细胞/孔接种到96孔板(每孔100 μL),每种细胞设置5个重复孔,置于37 ℃、5% CO2培养箱培养;分别在第12、24、36、48、60、72 h向每孔加10 μL CCK-8试剂。孵育1 h后,通过酶标仪测定A549-ANXA2-KO和A549-WT细胞的OD450值,并计算细胞活力,细胞活力(%)=[(As-Ab)/(Ac-Ab)]×100%,其中As为A549-ANXA2-KO细胞孔+CCK-8,Ac为A549-WT细胞孔+CCK-8,Ab为培养基+CCK-8。
1.2.6 敲除ANXA2对流感病毒复制的影响 将A549-ANXA2-KO和A549-WT细胞铺于6孔细胞板,待汇合度达到80%~90%,用无菌PBS洗两遍,同时接种SD98(H9N2)(感染复数MOI为0.1、0.5 μg/mL TPCK胰酶)或WSN(H1N1)毒株(MOI为0.01、0.5 μg/mL TPCK胰酶),37 ℃培养箱中培养,分别于12、24、36 h收取上清液,测定病毒的TCID50,绘制病毒在A549-ANXA2-KO和A549-WT细胞上的生长曲线。
1.2.7 数据统计分析 本研究的数据采用GraphPad Prism 8.3.0软件处理,采用t检验对数据做统计学差异分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 LentiCRISPRv2-ANXA2-sgRNA重组质粒的构建与鉴定 将退火获得的sgRNA双链克隆至LentiCRISPRv2载体,构建重组质粒ANXA2-sgRNA1、ANXA2-sgRNA2和ANXA2-sgRNA3,并测序,结果表明质粒构建成功(图1)。
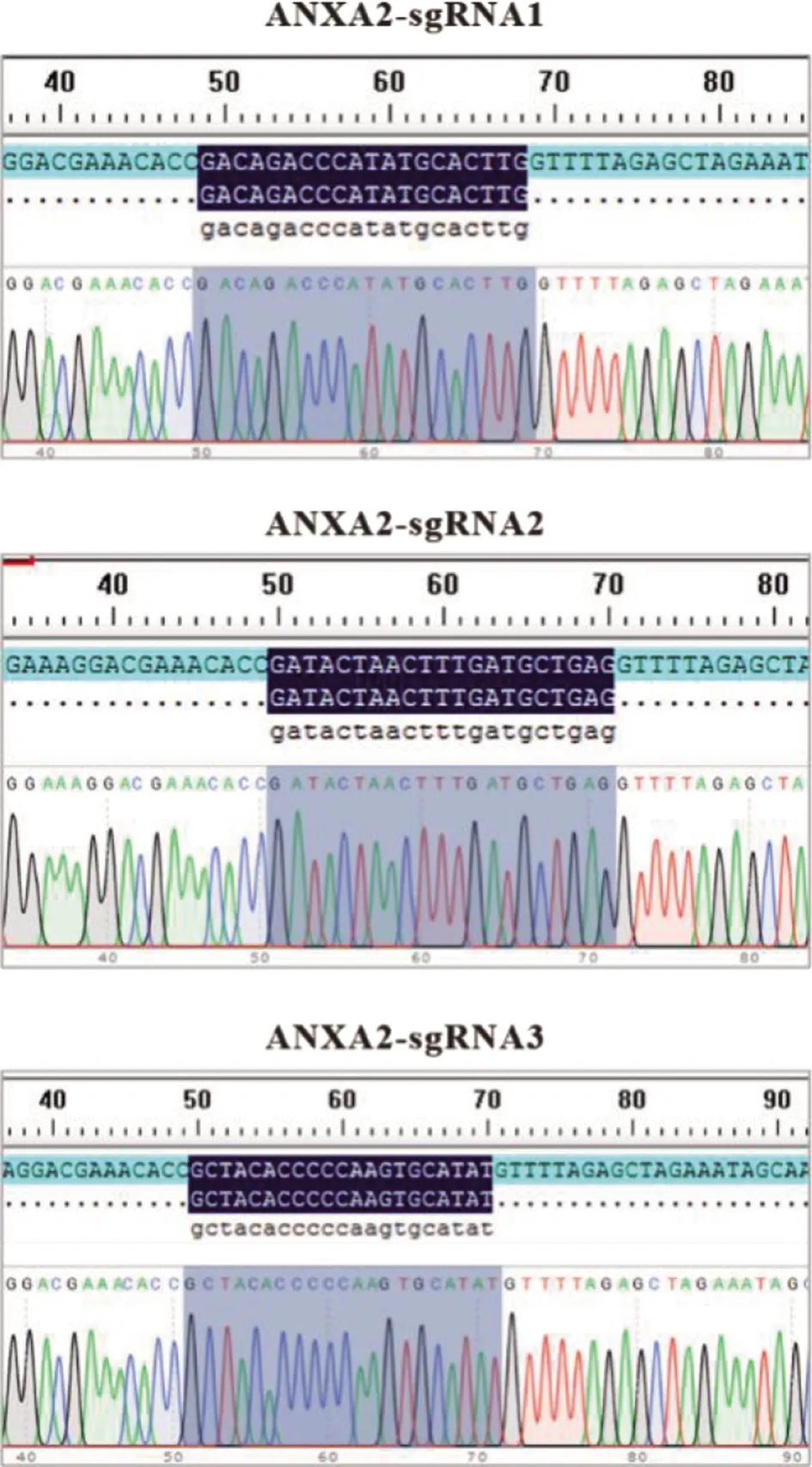
加黑部分为sgRNA序列图1 LentiCRISPRv2-ANXA2-sgRNA重组质粒测序结果Fig.1 Sequencing results for the LentiCRISPRv2-ANXA2-sgRNA recombinant plasmid
2.2 ANXA2敲除A549细胞株的筛选与鉴定
2.2.1ANXA2基因敲除细胞的筛选与测序鉴定 将测序正确的3个重组ANXA2-sgRNA质粒分别与辅助质粒psPAX2和pMD2.G共转染293T细胞,之后收集慢病毒并感染A549细胞,经嘌呤霉素加压和有限稀释法筛选出7株可能敲除ANXA2基因的单克隆A549细胞株,分别提取细胞的基因组DNA,用表1中的突变鉴定引物进行PCR扩增并测序。结果显示,有1株单克隆细胞株经测序在ANXA2基因第3外显子位置有1 bp碱基的插入突变(图2A),从基因水平表明成功构建了ANXA2基因缺失的A549细胞。
2.2.2 ANXA2敲除细胞的蛋白水平鉴定 收集A549-ANXA2-KO和A549-WT细胞的蛋白样品,经Western-blot检测结果显示,A549-WT细胞中ANXA2蛋白正常表达,而A549-ANXA2-KO细胞中ANXA2蛋白未见表达(图2B)。表明ANXA2基因的插入突变导致ANXA2阅读框移码,使得A549-ANXA2-KO不能表达ANXA2蛋白。表明本研究成功获得ANXA2敲除的A549细胞系。
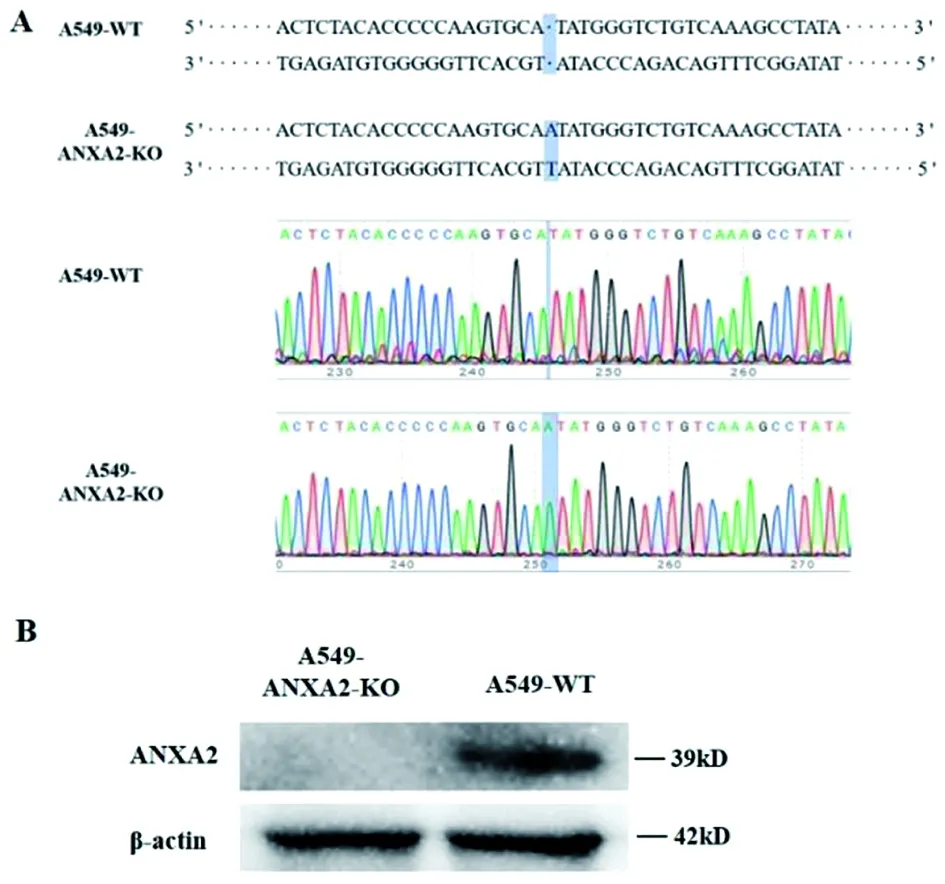
A. A549-ANXA2-KO细胞株测序鉴定结果;B. Western- blot鉴定A549-ANXA2-KO细胞株。图2 ANXA2敲除A549细胞的鉴定结果Fig.2 Identification results of ANXA2 knockout A549 cells
2.3 ANXA2敲除对A549细胞活力的影响 利用CCK-8检测敲除细胞系的细胞活力,结果如图3所示,A549-ANXA2-KO与A549-WT细胞活力相当,表明在A549细胞上敲除ANXA2后对细胞的活力没有影响(t12 h=1.744、t24 h=0.631、t36 h=0.259、t48 h=1.559、t60 h=2.074、t72 h=2.201,每个时间点敲除组与对照组两两对比,P>0.05)。
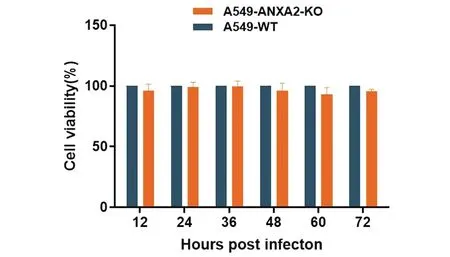
图3 敲除ANXA2对A549 细胞活力的影响Fig.3 Viability of ANXA2 knockout A549 cells
2.4 ANXA2敲除对流感病毒复制的影响 为了进一步探索ANXA2对流感病毒复制的影响,我们分别用人流感病毒WSN(H1N1)和禽流感病毒SD98(H9N2)毒株感染A549-ANXA2-KO及A549-WT细胞,并于感染后第12、24和36 h收集上清进行病毒TCID50的测定。结果显示,禽流感病毒SD98(H9N2)在A549-ANXA2-KO细胞上的复制滴度较A549-WT细胞显著升高约1.2个logs值(t=13.92,P<0.05)。人流感病毒WSN(H1N1)感染后第24 h在A549-ANXA2-KO细胞上的复制滴度较A549-WT细胞升高约1.05个logs值(t=3.790,P<0.05),在第12 h和36 h也有轻微升高但差异无统计学意义(t12h=2.658,P>0.05;t36h=2.752,P>0.05,图4)。

①P<0.05, ②P<0.01图4 ANXA2敲除对流感病毒复制的影响Fig.4 Effects of ANXA2 knockout on influenza viruses
3 讨 论
流感病毒为呼吸道病毒,具有肺组织嗜性。A549细胞作为人肺癌细胞是流感病毒作用机制研究的最佳细胞模型之一。本研究利用CRISPR/Cas9基因编辑技术成功构建了ANXA2敲除的A549细胞系,并经CCK-8分析发现ANXA2敲除并没有影响细胞活力。将流感病毒分别接种于A549-ANXA2-KO和A549-WT细胞,结果ANXA2缺失细胞的流感病毒滴度高于A549-WT细胞,表明ANXA2缺失能够促进流感病毒复制。但该作用在人流感病毒和禽流感病毒上存在一定的差异性。ANXA2敲除后,人流感病毒WSN(H1N1)病毒滴度有所升高,但在感染后第12 h和36 h差异并不显著;而禽流感病毒SD98(H9N2)感染后的第12、24、36 h,A549-ANXA2-KO细胞中的病毒滴度均显著高于A549-WT细胞。
CRISPR/Cas9基因编辑技术已广泛应用于多种动物、植物以及微生物的基因编辑中,是目前最有力的基因编辑工具[16-18]。尽管如此,对于CRISPR/Cas9系统靶点特异性问题仍存在争议。随着研究的不断深入,研究人员发现CRISPR/Cas9技术在应用的过程中存在一定的脱靶效应[19-21]。脱靶效应会引起非特异性的基因编辑,使得后续的筛选工作更繁琐,降低整个研究的可靠性,甚至一定程度上增加了实际应用中的安全隐患[22]。但也有研究表明,CRISPR/Cas9的脱靶效应问题被夸大了[23]。有证据表明大多数的Cas9脱靶效应是短暂的,并且对功能的影响很小[24-27]。面对争议,研究人员利用转录组、全基因组测序等多种方法来分析Cas9脱靶效应究竟有多大的影响,但所用方法都较繁琐,并且价格昂贵[28-29]。因此,本研究未进行脱靶验证。
Ma Yong等[30]的研究指出ANXA2对流感病毒复制具有促进作用,这与本研究的结果存在差异,原因可能是由于研究中所使用技术路径的不同以及流感病毒毒株本身的差异造成的。Ma Yong等使用RNA干扰以及过表达的方法证明了ANXA2基因对病毒复制的促进作用,而本研究是基于CRISPR/Cas9技术制备的ANXA2基因敲除A549细胞系来研究ANXA2对流感病毒复制的影响。在过去,RNA干扰技术因其操作简单、成本低等优势在基因功能缺失型研究中发挥重要作用,但同时也存在不能完全敲除、脱靶严重等缺陷[31]。近年来新兴的CRISPR/Cas9基因编辑技术因其操作简单、失活效率更高逐渐占据了主要地位,但同样也存在脱靶效应的争议。Ma Yong等的研究在RNA干扰技术之外,还利用过表达的方法做了互补试验的验证。本研究中缺乏互补试验的进一步验证,因此尚不够完善。对于ANXA2在病毒复制及与宿主相互作用过程中的功能仍需进一步更深入的研究才能阐明。Gabriel G等[32]利用siRNA的方法沉默A549细胞中内源性importin-α的表达后研究其对流感病毒复制的影响,结果显示沉默importin-α3能够抑制H7N7和H1N1亚型流感病毒的复制,但对H3N2亚型流感病毒复制具有促进作用,对H5N1亚型流感病毒复制的影响不大。Ma Yong等的研究中使用的是高致病性H5N1亚型禽流感病毒株,本研究中用的是低致病性H9N2亚型毒株和PR8病毒株。因此,病毒毒株本身的差异性也可能是导致本研究与Ma Yong等研究结果不同的原因之一。此外,病原体和宿主的相互作用是一个复杂的过程,影响禽流感病毒和人流感病毒与ANXA2相互作用的因素很多,ANXA2是否可能与流感病毒的跨种间传播有关还需做进一步研究。
ANXA2作为一个多功能蛋白,在流感病毒感染过程中,可参与流感病毒的复制[7]。在流感病毒粒子形成过程中,被整合进入流感病毒粒子[13]。此外,ANXA2还可与流感病毒NS1蛋白相互作用[30]。但ANXA2影响流感病毒复制的分子机制还不明确,还需要深入探讨。
近年来,新出现的非人流感病毒感染人的情况不断报道,给人类造成了严重威胁。因此,预防和控制流感病毒的流行具有重要的意义[33-34]。本研究利用当前流行的CRISPR/Cas9基因编辑技术建立了ANXA2敲除的A549细胞系,并证实ANXA2能够抑制流感病毒复制。本研究为进一步阐明ANXA2在流感病毒复制中的作用机理奠定了基础。
利益冲突:无
引用本文格式:刘永宁,马欣傲,吕思莹,等. ANXA2敲除的A549细胞系的构建及其对H1N1和H9N2流感病毒复制的影响[J].中国人兽共患病学报,2022,38(4):291-296,302. DOI:10.3969/j.issn.1002-2694.2022.00.039

