A20通过抑制自噬缓解实验性牙周炎牙槽骨吸收
侯黎光,叶 宇,苟惠清,周 逸,徐 艳
南京医科大学附属口腔医院牙周科,江苏省口腔疾病研究重点实验室,江苏省口腔转化医学工程研究中心,江苏 南京 210029
牙周炎是以牙周组织炎症及牙槽骨吸收为特征的慢性炎症性疾病,最终导致牙齿松动及丧失。菌斑为牙周炎的始动因素,可诱发牙周组织免疫炎症反应扰乱骨稳态[1]。牙龈卟啉单胞菌(Porphyromonas gingivalis,P.gingivalis)为牙周炎的主要致病菌[2]。成骨和破骨之间的平衡是维持牙槽骨稳态的关键。当牙周组织出现炎症时,由于破骨细胞过度激活,倾向于发生骨吸收[3]。
泛素编辑酶A20,又称肿瘤坏死因子-α诱导蛋白3(tumour necrosis factor-alpha-induced protein 3,TNFAIP3),为炎症反应和自身免疫性疾病的关键调节分子[4]。A20可基于核因子-κB(nuclear factor-κВ,NF-κB)通路抑制P.gingivalis刺激的巨噬细胞及牙龈角化细胞炎症因子释放及牙龈角化细胞凋亡[5-6]。与野生型小鼠相比,丝线结扎可诱导A20 基因半敲除小鼠出现更为严重的牙槽骨吸收[5]。以上研究表明,A20参与调控牙周组织炎症与骨代谢,但其潜在机制尚未完全明确。
自噬是维持细胞稳态的过程,可将错误折叠蛋白、受损细胞器运送至溶酶体降解并且回收利用产物[7]。自噬功能异常与神经退行性疾病、癌症、糖尿病、感染性疾病等相关[8]。自噬参与牙周炎中病原体防御、宿主免疫反应、炎症及牙槽骨代谢等过程,维持自噬稳态对控制牙周炎十分重要[9]。研究发现,牙周炎患者较牙周健康者牙周膜及牙龈组织自噬水平增高[10-11]。大鼠腭侧牙龈区域局部注射自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)或氯喹(chloroquine,CQ)可以减轻实验性牙周炎牙周组织炎症及牙槽骨吸收[12]。
A20 在多种病理生理过程中参与自噬的调控,包括CD4+T细胞的存活、强直性脊柱炎、椎间盘变性等[13-15]。我们前期研究发现,乏氧下A20基于TRAF6依赖性自噬下调人牙周膜成纤维细胞(human periodontal ligament cell,hPDLC)促破骨分化活性[16],然而自噬是否参与A20对小鼠实验性牙周炎的调控有待进一步研究。
本实验通过构建丝线结扎联合局部涂菌诱导的实验性牙周炎模型及小鼠牙龈注射A20过表达腺相关病毒(adeno-associated virus,AAV)(AAV-A20),探索A20 过表达对小鼠实验性牙周炎的治疗作用。此外,通过检测小鼠牙周组织自噬相关因子的表达变化,明确自噬在A20 对实验性牙周炎调控中的作用。结果表明A20 通过负向调控自噬,抑制破骨细胞分化,缓解小鼠实验性牙周炎牙槽骨吸收,有望成为牙周炎治疗的新靶点。
1 材料和方法
1.1 材料
SPF 级C57BL/6J 小鼠(雄性,6~8 周,体重20~25 g)购自南京医科大学实验动物中心。本研究经南京医科大学实验动物福利伦理委员会批准(伦理批件编号:IACUC-2007035)。AAV-A20及阴性对照AAV 由上海吉凯公司构建及生产。P.gingivalis(ATCC 33277)由南京医科大学江苏省口腔疾病研究重点实验室提供。
兔抗小鼠A20 抗体、兔抗小鼠LC3B 抗体(SAB公司,美国),Cy3 标记山羊抗兔IgG(H+L)、DAPI 染色液、苏木素伊红(haematoxylin and eosin,HE)染色试剂盒(上海碧云天公司),抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒(Sigma-Aldrich公司,美国),兔抗小鼠核因子-κB受体活化因子配体(receptor activator of nuclear factor-κВ ligand,RANKL)抗体(Abcam 公司,美国),兔抗小鼠Beclin-1 抗体、兔抗小鼠p62 抗体(Proteintech 公司,美国),即用型快捷免疫组化MaxVisionTM检测试剂盒、DAB显色试剂盒(福州迈新公司),Mayer’s苏木素染液(北京索莱宝公司)。
1.2 方法
1.2.1 AAV注射
参考既往研究中报道的小鼠牙龈局部AAV 注射方法[17]并加以更改。麻醉后,在小鼠上颌第二磨牙腭侧牙龈近龈缘区域,使用量程为5 μL的汉密尔顿注射器(33-G针头)注射2 μL病毒溶液(病毒颗粒5×109个/μL)或者磷酸盐缓冲液(phosphate-buffered saline,PBS)。2周之后使用A20免疫荧光染色验证AAV转染效率。
1.2.2P.gingivalis培养
将P.gingivalis接种于固体脑心浸液(brain heart infusion,BHI)血琼脂培养基,置于37 ℃厌氧培养箱内培养5 d。挑选单克隆至液体培养基内厌氧环境中孵育24 h备用。
1.2.3 实验性牙周炎模型构建
为探索A20过表达对小鼠实验性牙周炎的治疗作用,随机将20只小鼠分为4组:无牙周炎(Control)组、牙周炎及PBS注射(PBS+P)组、牙周炎及阴性对照AAV 注射(AAV+P)组、牙周炎及AAV-A20 注射(A20+P)组。PBS 或者AAV 溶液注射2 周后,丝线结扎结合局部涂菌构建小鼠实验性牙周炎模型。在第14 天,用5-0 无菌丝线紧密缠绕小鼠上颌第二磨牙颈部1 圈并于颊侧打结,保持到第24 天,期间丝线如有脱落立即重新结扎。将P.gingivalis(1×109CFU/mL)重悬于包含2%羧甲基纤维素钠(carboxymethylcellulose sodium,CMC)的PBS 溶 液中。在第15~17天,用无菌棉棒将100 μLP.gingivalis菌悬液涂抹于小鼠上颌第二磨牙牙齿周围,连续涂抹3天。第24天处死小鼠,取上颌组织用于后续实验。
1.2.4 微计算机断层扫描(microcomputed tomography,Micro-CT)
组织用4%多聚甲醛固定24~48 h 后,自来水冲洗过夜,并储存于70%酒精中。保鲜膜包裹组织置于软泡沫中以防止扫描过程中组织干燥或者移位。Micro-CT(vivaCT80,SCANCO Medical 公司,瑞士)扫描样本,应用Skyscan软件进行3D重建及数据测量。根据先前文献报道方法[12]测量小鼠上颌第二磨牙腭侧釉牙骨质界(cemento-enamel junction,CEJ)到牙槽嵴顶(alveolar bone crest,ABC)的距离。通过测量上颌第二磨牙腭侧5个不同区域CEJ-ABC的距离并计算均值用于统计分析。
1.2.5 免疫荧光染色
小鼠上颌组织用4%多聚甲醛溶液固定后于20%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)溶液中4 ℃下脱钙3~4 周。脱钙液每2~3 d更换1次。OCT包埋剂包埋组织并使用切片机沿第二磨牙长轴近远中方向将组织加工成厚度6 μm 的冰冻切片。抗原修复及封闭后,切片上滴加兔抗小鼠A20 一抗4 ℃下孵育过夜。PBS 冲洗后,滴加有山羊抗兔二抗的切片于室温下避光孵育1 h。DAPI显色液被用于细胞核染色。
1.2.6 形态学检测
石蜡包埋组织并使用切片机沿第二磨牙长轴近远中方向将连续切割组织为厚度4 μm 的切片。石蜡切片经脱蜡至水后按照试剂盒说明书进行HE染色及TRAP染色。
1.2.7 免疫组织化学染色
石蜡切片经脱蜡至水后进行热抗原修复。通过3%H2O2抑制内源性过氧化物酶活性,使用山羊血清降低非特异性染色。组织与一抗(兔抗小鼠RANKL、兔抗小鼠Beclin-1 抗体、兔抗小鼠LC3B抗体、兔抗小鼠p62 抗体)反应4 ℃过夜。PBS 冲洗3 次后,切片与快捷型酶标羊抗兔IgG 聚合物37 ℃共同孵育15 min,DAB 显色液显色,Mayer’s 苏木素染液用于复染。应用Image-Pro Plus 6.0对免疫组化图片进行半定量分析。
1.3 统计学方法
采用GraphPad Prism 8.0 软件进行数据统计分析。所有定量数据表示为均值±标准差()。多组间数据比较使用方差分析,进一步两两比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 AAV-A20上调小鼠牙周组织A20表达
通过在小鼠上颌第二磨牙腭侧牙龈近龈缘区域注射AAV-A20 与阴性对照AAV 来探索A20 过表达对实验性牙周炎的影响。与注射PBS及阴性对照AAV 相比,注射AAV-A20 有效上调小鼠上颌第一、第二磨牙之间牙周组织A20的表达(图1)。
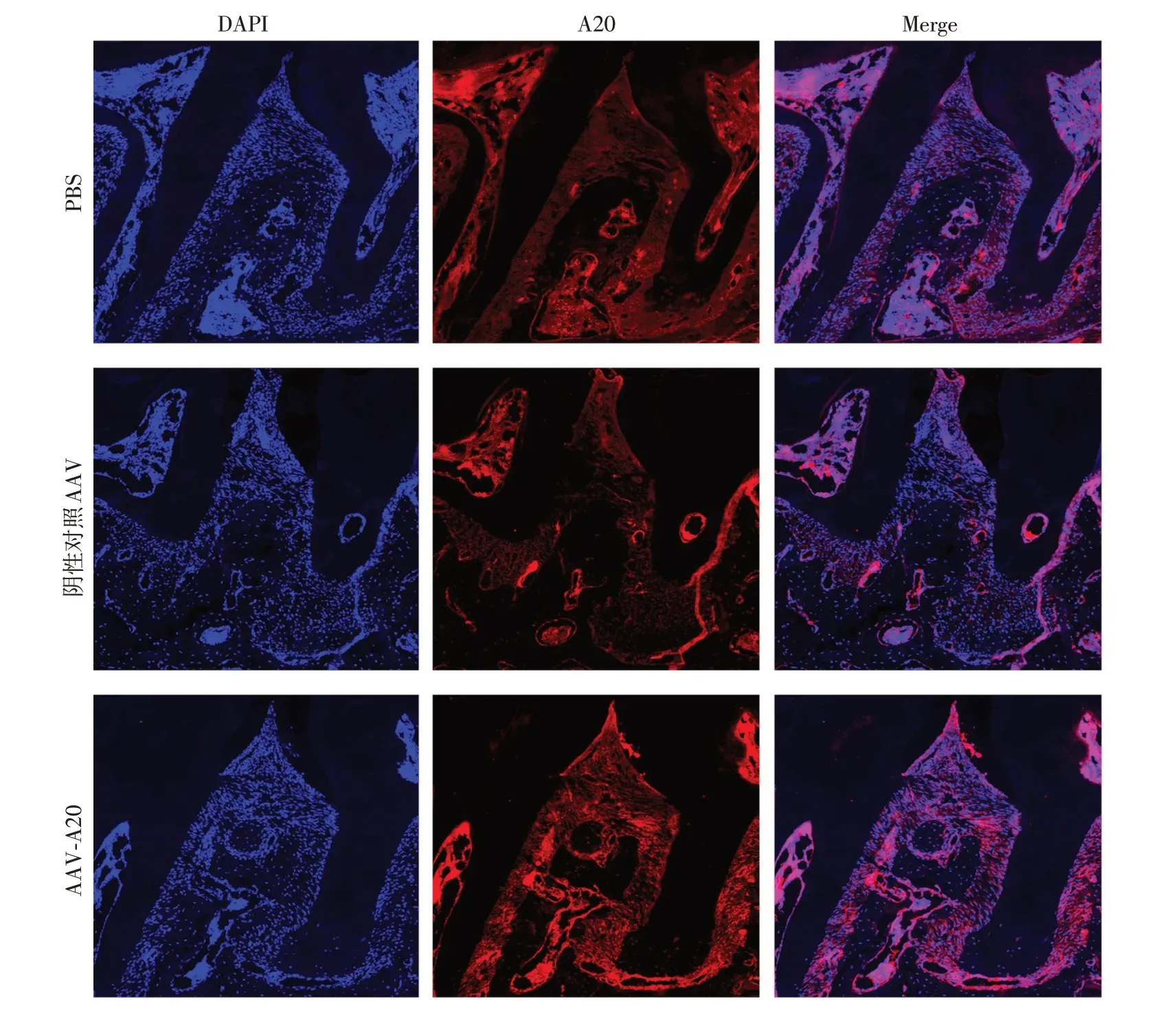
图1 各组小鼠上颌第一、第二磨牙之间牙周组织代表性A20免疫荧光图(×400)Figure 1 Representative immunofluorescence images of A20 in periodontal tissue between the maxillary first and second molar of mice in each group(×400)
2.2 小鼠牙周组织内A20 过表达减轻实验性牙周炎所致牙周组织炎症及牙槽骨吸收
小鼠上颌扫描Micro-CT 后,3D 及2D 重建图显示:与Control 组相比,PBS+P 组及AAV+P 组出现牙槽骨吸收,CEJ-ABC 距离增加,表明实验性牙周炎模型的成功构建;与PBS+P 组及AAV+P 组相比,A20+P 组腭侧牙槽骨吸收减轻,CEJ-ABC 距离减小(图2A、B)。小鼠上颌HE染色显示:与Control组相比,PBS+P组及AAV+P组小鼠牙周组织出现大量炎症细胞浸润、牙龈结合上皮向根方移位、牙周袋形成及牙槽骨破坏;与PBS+P 组及AAV+P 组相比,A20+P 组牙周组织炎症及牙槽骨破坏有明显缓解(图2C)。
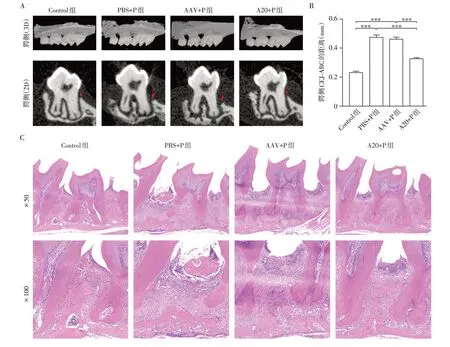
图2 各组小鼠牙周组织炎症及牙槽骨吸收情况Figure 2 Periodontal inflammation and alveolar bone resorption in each group of mice
2.3 小鼠牙周组织内A20 过表达抑制破骨细胞生成及RANKL表达
采用TRAP 染色来标记小鼠上颌第一、第二磨牙之间的破骨细胞。与PBS+P组及AAV+P组相比,A20+P组破骨细胞数目减少。Control组与A20+P组破骨细胞数目差异无统计学意义(图3A、C)。小鼠上颌第一、第二磨牙之间牙周组织RANKL 染色及半定量分析显示:PBS+P 组及AAV+P 组RANKL 表达较Control组及A20+P组增加(图3B、D)。
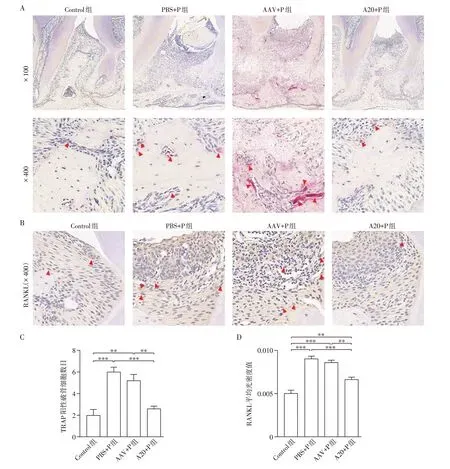
图3 各组小鼠上颌第一、第二磨牙之间破骨细胞数目及RANKL表达情况Figure 3 Number of osteoclasts and RANKL expression between the maxillary first and second molar of mice in each group
2.4 小鼠牙周组织内A20过表达抑制自噬
与Control组相比,PBS+P组及AAV+P组小鼠上颌第一、第二磨牙之间牙周组织Beclin-1、LC3B表达上升,p62表达下降,自噬水平增高。与PBS+P组及AAV+P 组相比,A20+P组Beclin-1、LC3B表达下降,p62表达上升,提示自噬被抑制(图4A、B)。
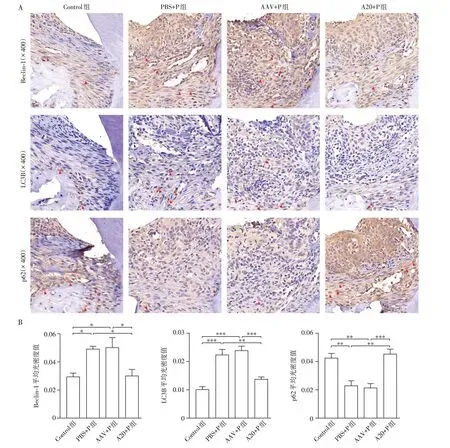
图4 各组小鼠上颌第一、第二磨牙之间牙周组织自噬相关因子表达情况Figure 4 Expressions of autophagy⁃related molecules in periodontal tissue between the maxillary first and second molar of mice in each group
3 讨论
本研究探索了A20对小鼠实验性牙周炎的调控作用及潜在机制。牙龈局部注射AAV-A20 的实验性牙周炎小鼠牙周组织自噬水平降低,破骨细胞数目减少,牙槽骨破坏程度减轻。A20 可基于自噬发挥对小鼠实验性牙周炎牙槽骨吸收的缓解作用,过表达A20对小鼠实验性牙周炎有一定的治疗意义。
AAV 作为一种新型、有效的基因传递工具,由于其非致病性、低免疫原性、靶基因稳定表达等特点,被广泛应用于动物实验和基因治疗[18-19]。小鼠牙周病变区域局部应用AAV-shRNA-Atp6i 下调牙周组织T 细胞数目、破骨细胞标志基因表达及炎症因子释放,缓解P.gingivalis感染诱导的小鼠牙槽骨吸收[17]。一项关于AAV 介导血管内皮生长因子C(vascular endothelial growth factor C,VEGFC)在小鼠牙周组织过表达的研究支持了该基因治疗方法在牙周炎中的应用[20]。本研究发现AAV 介导的小鼠牙周组织A20过表达可以缓解实验性牙周炎牙周组织炎症及牙槽骨吸收,提示局部应用AAV-A20对小鼠实验性牙周炎具有一定的治疗作用。
RANKL 作为肿瘤坏死因子(tumor necrosis factor,TNF)超家族的一员,可与破骨细胞前体细胞上的核因子-κB 受体活化因子(receptor activator of nuclear factor-κВ,RANK)结合,刺激破骨细胞前体细胞分化并融合为成熟破骨细胞[21]。目前已证实,炎症相关的骨破坏为RANKL 表达异常所致的病理状态[22]。本研究中,小鼠牙周组织A20 过表达使RANKL 表达降低,第一、第二磨牙之间TRAP 阳性破骨细胞数目减少。有文献报道在小鼠关节炎模型中应用A20 腺病毒可降低关节组织RANKL 等促炎因子的表达,减轻局部炎症反应及组织破坏[23]。
小鼠实验性关节炎模型中可观察到自噬通路的激活,且自噬可能介导其中的破骨细胞分化及骨吸收[24]。本研究发现实验性牙周炎小鼠牙周组织自噬水平与牙槽骨吸收程度及破骨细胞数目趋势相同。自噬过程不仅参与破骨细胞的生成与分化,也调控其骨吸收能力。Beclin-1参与调节RANKL诱导的破骨细胞分化,破骨细胞条件性敲除Beclin-1基因小鼠出现破骨细胞功能障碍,皮质骨厚度增加[25]。自噬相关蛋白(ATG5、ATG7、ATG4B、LC3)对破骨细胞皱褶缘的产生及调节分泌溶酶体内组织蛋白酶K(cathepsin K,CatK)和其他基质降解分子定向释放至细胞间隙非常重要[26]。脂多糖(lipopolysaccharide,LPS)基于自噬促进破骨细胞的分化与活性[27]。山奈酚可通过下调自噬破坏破骨细胞形成与功能,减轻骨丢失[28]。
A20通过调控TRAF6 E3连接酶活性或者直接去泛素化Beclin-1下调Beclin-1泛素化,抑制自噬[29]。A20与ATG16L1 WD40域结合,控制自噬反应及NF-κB信号通路激活,维持肠道稳态[30]。1α,25-二羟维生素D3 或者TX 527 处理卡波西肉瘤细胞可上调A20 表达,抑制Beclin-1 表达[31]。本研究利用小鼠实验性牙周炎模型进一步验证了A20对自噬的负向调控。
课题组前期体外实验中通过乏氧条件模拟牙周炎症微环境,发现转染A20 过表达病毒的hPDLC自噬水平、RANKL/骨保护素(osteoprotegerin,OPG)比值降低。乏氧条件下,通过转染A20 过表达病毒的hPDLC与破骨细胞前体细胞间接共培养,可以减少破骨细胞数目、体积,骨吸收面积及破骨相关基因的表达[16]。本研究首次提出小鼠实验性牙周炎模型中,A20 可通过负向调控自噬,下调牙周组织RANKL 表达,抑制破骨细胞分化,从而减轻牙槽骨丢失,通过体内实验验证了A20 基于自噬对牙周炎骨破坏的调控。一项应用骨髓巨噬细胞(bone marrow macrophage,BMM)及大鼠实验性牙周炎模型的研究发现IL-17A 上调自噬活性,促进破骨细胞生成;自噬抑制剂3-MA 减轻IL-17A 介导的破骨细胞分化及骨吸收[32]。小鼠神经生长因子受体作用黑色素瘤抗原基因同源蛋白(neurotrophin receptorinteracting melanoma antigen-encoding gene homolog,NRAGE)基因敲除后上调自噬相关基因表达,促进破骨细胞分化,加重实验性牙周炎[33]。
综上所述,本研究证实牙周组织局部注射AAVA20对小鼠实验性牙周炎导致的牙槽骨吸收具有保护作用,其机制可能与抑制自噬水平有关,提示A20有望成为牙周炎防治的新靶点。

