葡萄耐铝毒基因STOP1的克隆与表达分析
张永福,徐仕琴,陈 姣,杨砚斌,任 禛
(昆明学院农学与生命科学学院,昆明 650214)
【研究意义】在pH值于5.0的酸性土壤中,大量的活性A13+被释放出来,A13+所产生的铝毒严重抑制植物生长,使其产量大幅度降低[1-2]。pH小于5.0的酸性土壤,广泛存在于世界热带和亚热带地区[3],铝毒已成为抑制这些地区植物生长的主要因素之一[4-5]。随着现代工业的发展,大量生理酸性化肥的施用和酸雨的高频率发生,使中国南方地区原本呈酸性的土壤酸度进一步加剧[6]。葡萄是一种世界广泛栽培的大宗果树,由于其口感极佳和营养丰富而深受广大消费者的喜爱,由于葡萄种植能够取得较高的经济效益,因此葡萄栽培在我国南方酸性土壤地区增长迅速[7],且随着栽培年限的增加,葡萄根际对土壤养分的富集作用越来越弱,园土pH呈明显的下降趋势[8]。然而,葡萄在铝毒胁迫下,根系活力下降,氧自由基产生速率和丙二醛含量上升,过氧化物酶和超氧化物歧化酶活性亦上升,植株生长受到抑制[9]。为解决此问题,在提高土壤pH的同时,挖掘葡萄自身的耐铝毒基因,获得耐铝毒能力强的种质资源是一条行之有效的途径。为此,课题组从26份葡萄种质中筛选出了耐铝毒能力较弱的山葡萄(Vitisamurensis)和耐铝毒能力较强的小叶葡萄(V.sinocinerea)[10]作为STOP1基因克隆与表达分析的试验材料。【前人研究进展】STOP1(sensitive to proton rhizotoxicity 1)是一个含有4个锌指蛋白结构域的C2H2型锌指转录因子,在拟南芥(Arabidopsisthaliana)中,该转录因子能调控下游耐铝关键基因表达,如柠檬酸转运蛋白AtMATE1(multidrug and toxic compound extrusion)基因[11]、ABC通道蛋白AtALS3(aluminum sensitive 3)基因[12]及铝激活苹果酸转运子AtALMT1(aluminum-activated malate transporter 1)基因表达[13]。当这些基因表达受到抑制时,与H+毒害耐受机制相关基因的表达、柠檬酸及苹果酸的分泌也会被抑制[14]。拟南芥的STOP1突变体对Al3+的毒害极为敏感,在铝胁迫中根系生长受阻严重[13]。随后,在烟草(Nicotianatabacum)[15]、水稻(Oryzasativa)[16]、大豆(Glycinemax)[17]、柱花草(Stylosanthesguianensis)[18]和桉树(Eucalyptusrobusta)[19]中也相继克隆了与AtSTOP1同源的基因。可见,在调控植物对铝毒的耐受中,STOP1基因具有重要作用。【本研究切入点】山葡萄原产于中国东北,其果实可酿酒和鲜食,由于其生长旺盛和耐寒性强,目前在葡萄栽培中主要用作砧木。小叶葡萄分布于我国云南、浙江、福建等南方地区,目前还处于野生状态,其果实可用于酿制葡萄酒,其植株可用作葡萄耐铝毒砧木。小叶葡萄具有较强的耐铝性,而山葡萄的耐铝性相对较弱,二者是研究葡萄在酸性土壤中耐铝毒胁迫机制的重要试材。目前,尽管葡萄种质资源的耐铝性评价已有报道[10],但并不清楚相关的分子机制。【拟解决的关键问题】以山葡萄和小叶葡萄为研究材材,分别克隆出锌指转录因子VaSTOP1和VsSTOP1,并利用生物信息学对这两个锌指转录因子进行基因的表达分析,为以后进一步揭示葡萄耐铝性相关基因的调控机制提供参考。
1 材料与方法
1.1 材料及铝胁迫处理
研究材料山葡萄(Vitisamurensis)为砧木品种‘通化-3’的1年生扦插苗,收集于云南省弥勒市;小叶葡萄(V.sinocinerea)为野生种的1a生压条苗,收集于云南省罗平县。收集到的试验材料保存于昆明学院果树资源圃大棚,取成熟健壮的叶片进行STOP1基因克隆。叶片摘下后立即投入液氮中进行速冻,然后用超低温冰箱在-80 ℃下保存。
用PVC管进行铝胁迫处理,管分两层,相隔80 cm,分别用直径3 cm的PVC管连接两层管的两端,然后安装抽水泵在其中一端,开启水泵后营养液就能在两层管中循环流动。栽培用的管长200 cm、18 cm内径,栽培孔间隔40 cm,直径10 cm。把1年生的试验材料根系从栽培孔中放入,再用陶粒固定,装入2/3管的1/2 Hoagland’s营养液(pH=4.5)。15 d后,加入5 mmol/L Al2(SO4)3·18H2O(pH = 4.5)于1/2 Hoagland’s营养液(pH=4.5)中进行铝毒胁迫处理。然后分别在铝毒胁迫的第0、7、14、21、28天进行采样,采取成熟健壮的叶片,并立即置于液氮中冷冻,然后用超低温冰箱在-80 ℃下保存,用于STOP1基因的表达分析和测定生理指标。
1.2 提取RNA及合成cDNA
称0.1 g样品,放入有1 mL TPIzol提取液的研钵中磨成匀浆,再加氯仿0.2 mL,然后在室温中放置5 min,16 099 r/min离心10 min(4 ℃)。取上清,加入异丙醇0.5 mL,摇匀后室温放置10 min,16 099 r/min离心10 min(4 ℃)。弃上清,75%乙醇漂洗沉淀,把乙醇倒去,风干沉淀后再加入100 μL DEPC水溶解RNA。参照说明书用PrimeScript 1stStrand cDNA Synthesis Kit试剂盒(TaKaRa公司生产)进行逆转录,合成cDNA第1链。
1.3 克隆STOP1全长cDNA
根据模式植物拟南芥的AtSTOP1蛋白序列进行Blastp搜索,得到葡萄同源基因的cDNA及氨基酸序列,然后根据cDNA序列设计引物(表1),设计好的引物送生物技术公司进行合成。基因扩增用高保真酶PrimeSRAHS DNA Polymerase完成。扩增程序为预变性2 min(98 ℃);变性10 s(98 ℃),复性10 s(58 ℃),延伸25 s(72 ℃),循环35次;延伸2 min(72 ℃)后扩增结束。用1.2%琼脂糖凝胶电泳检测所得扩增产物,用从Axygen公司购买的回收试剂盒进行切胶回收目的条带,然后跟pMD19-T Vector连接,转化大肠杆菌感受态细胞,挑出阳性克隆进行测序(北京擎科新业生物技术有限公司)。

表1 引物序列
1.4 生物信息学分析
利用NCBI在线分析软件ORFfinder把STOP1基因翻译成蛋白质序列,利用ProtParam tool(http:// web.expasy.org/protparam/)预测理论等电位和蛋白质分子量。蛋白质的二级结构预测使用GOR4 (https://npsa-prabi. ibcp.fr/cgi -bin/npsa_automat.pl?page=npsa_ gor4. html);蛋白质的三级结构预测使用SWISS-MODEL (https://www. swissmodel.expasy.org/interactive)。使用NCBI的Blastn对比核酸序列、Blastp对比氨基酸序列;使用DNAMAN 8.0比对氨基酸多序列和MEGA 7.0软件构建系统进化树。
1.5 基因表达分析
对葡萄叶片铝胁迫的不同时期的STOP1基因表达量进行荧光定量分析,方法参照TSE202[2×T5 Fast qPCR Mix(SYBR Green I),擎科]说明书,内参基因为GAPDH和UBQ,引物序列见表1。反应体系:2×T5 Fast qPCR Mix(SYBR Green I)10 μL、各0.8 μL上下游引物、1.0 μL cDNA模板、加Nuclease-free Water到20 μL。反应条件:预变性1 min(95 ℃);10 s(95 ℃),5 s(60 ℃),10 s(72 ℃),循环40次;熔解阶段:15 s(95 ℃),1 min(60 ℃),15 s(95 ℃),20 s(0.3 ℃)。反应结束后进行溶解曲线以及荧光值变化曲线分析。
1.6 测定生理指标
丙二醛含量利用双组分光光度法测定,通过硫酸钛—浓氨水显色法测定H2O2含量,通过盐酸羟胺法测定氧自由基产生速率[20]。试验重复3次。
2 结果与分析
2.1 葡萄STOP1基因ORF序列的克隆
使用核酸蛋白检测仪测定从山葡萄和小叶葡萄叶片中提取的总RNA,结果浓度分别为638.1和598.6 μg/mL,A260/A280分别为1.83和1.79,可见RNA纯度能够满足后续试验的要求,将其保存于-80 ℃冰箱中备用。用逆转录获得的山葡萄和小叶葡萄的cDNA为模板,用特异引物扩增出长度均为1800 bp左右的条带(图1)。对山葡萄和小叶葡萄的克隆产物进行测序(北京擎科新业生物技术有限公司),得到cDNA的大小分别为1782和1800 bp。转录组获得的序列与电泳的基因序列基本一致,通过DNAMAN 8.0分析发现其分别编码593和599个氨基酸,及各1个终止密码子(图2~3)。
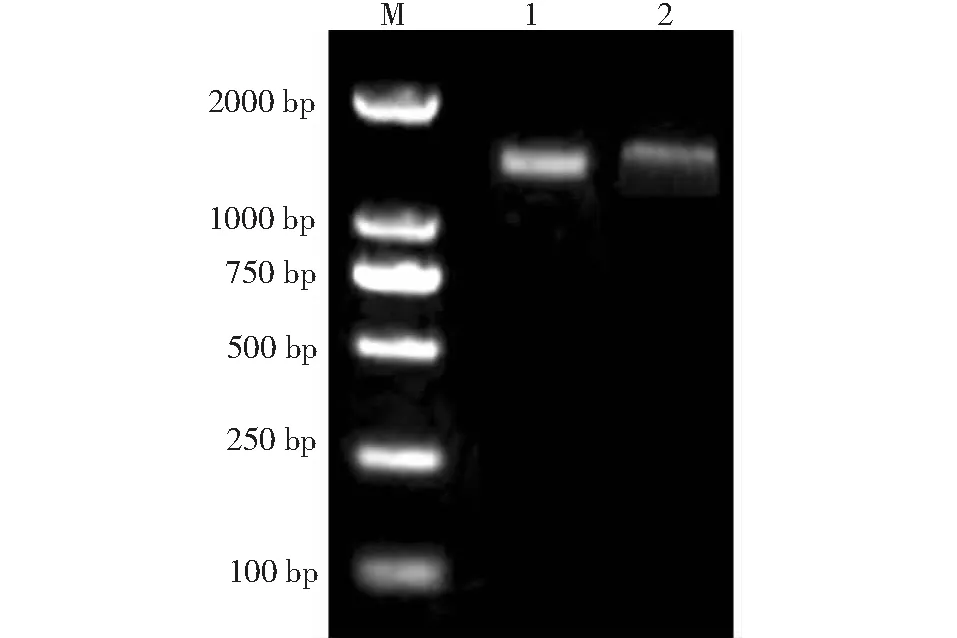
M:Marker DL 2000;1:山葡萄STOP1基因PCR产物;2:小叶葡萄STOP1基因PCR产物M: Marker DL 2000; 1: PCR products of STOP1 gene of V. amurensis; 2: PCR products of STOP1 gene of V. sinocinerea图1 STOP1基因PCR产物电泳图Fig.1 The gel electrophoresis PCR product of STOP1

图2 山葡萄STOP1的cDNA和氨基酸序列Fig.2 STOP1 gene cDNA and amino sequence of V.amurensis

图3 小叶葡萄STOP1的cDNA序列及预测氨基酸序列Fig.3 STOP1 gene cDNA and amino sequence of V.sinocinerea
2.2 STOP1氨基酸序列的理化性质
用ProtParam tool在线工具对山葡萄和小叶葡萄的STOP1多肽链氨基酸数目、分子式、等电点、相对分子量等进行预测发现:山葡萄的STOP1基因共编码593个氨基酸,分子式C2976H4620N826O919S25,相对分子量67.48 kD,理论等电点(pI)5.21,含9366个原子;小叶葡萄中STOP1基因共编码599个氨基酸,分子式C2958H4610N832O876S37,相对分子量67.03 kD,理论等电点(pI)6.42,含9313个原子。
2.3 预测STOP1蛋白结构
利用GOR4预测蛋白的二级结构,结果见图4。在组成山葡萄STOP1蛋白中,无规则卷曲(Cc)占61.89%、α-螺旋(Hh)占21.42%、折叠延伸链(Ee)占16.69%;在组成小叶葡萄STOP1蛋白中,无规则卷曲(Cc)占52.59%、α-螺旋(Hh)占24.37%、折叠延伸链(Ee)占23.04%。二者的二级结构均有无规则卷曲>α-螺旋>折叠延伸链的规律,其中无规则卷曲是蛋白多肽链的结构元件,大量散布于整个肽链中,决定了蛋白的功能,α-螺旋(Hh)则主要对蛋白骨架起到稳定作用。
用SWISS-MODEL在线工具进行预测后发现,葡萄STOP1蛋白的三维结构由α-螺旋、β-折叠片、β-转角和锌指结构等组成。山葡萄STOP1蛋白的三级结构含有α-螺旋1个、β-折叠片2个、β-转角3个和锌指结构4个;小叶葡萄含有α-螺旋1个、β-折叠片2个、β-转角3个、锌指结构4个(图5)。
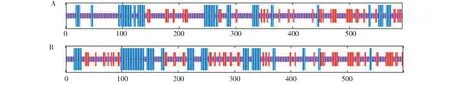
A: 山葡萄;B: 小叶葡萄;蓝色代表α-螺旋、红色代表折叠延伸链、紫色代表无规则卷曲A: V.amurensis; B: V. sinocinerea. Blue represents alpha helix, red represents folding extension chain,purple represents irregular curl图4 STOP1蛋白的二级结构预测Fig.4 Secondary structure prediction of the STOP1 protein
2.4 STOP1系统进化关系结果
利用生物分析软件MEGA 7.0构建了山葡萄、小叶葡萄、野生茶(Camelliasinensis)、黑杨(Populusnigra)、烟草(Nicotianatabacum)、水稻(Oryzasativa)、桉树(Eucalyptusrobusta)、可可(Theobromacocao)、棉花(Gossypiumarboretum)、小麦(Triticumaestivum)、甜橙(Citrussinensis)、柑橘(C.clementina)、拟南芥(Arabidopsisthaliana)等的STOP1同源蛋白的系统进化树。发现山葡萄和小叶葡萄的STOP1蛋白在氨基酸序列上具有高度相似性(相似度达96%);此外,与山葡萄和小叶葡萄同源性在80%以上的有野生茶、黑杨、烟草、桉树等,另外几个种与山葡萄和小叶葡萄的同源性均在44%~76%。此外,从系统进化树上可见,山葡萄与小叶葡萄在同一个分支上,说明二者STOP1基因的亲缘关系极近;二者与野生茶、黑杨、烟草、桉树、可可、棉花等的STOP1基因进化关系较近,与拟南芥、小麦、水稻、甜橙、柑橘等的STOP1基因进化关系较远(图6)。

A:山葡萄;B:小叶葡萄A: V.amurensis; B: V. sinocinerea图5 STOP1蛋白三级结构模型预测Fig.5 Prediction results of the tertiary structure model of the STOP1 protein
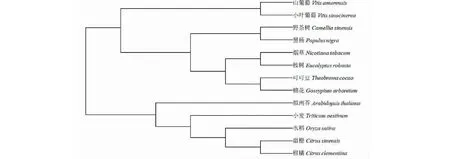
图6 葡萄STOP1蛋白与其他植物STOP1蛋白的系统发育树Fig.6 Phylogenetic tree of STOP1 protein and other plant STOP1 proteins
2.5 STOP1基因的相对表达量及生理指标
通过qRT-PCR分析发现,铝胁迫前,山葡萄和小叶葡萄的STOP1基因相对表达量均在400以下,且相差不大;但在铝胁迫的第7天,二者相对表达量均有不同程度的上升,其中山葡萄上升到1600以上,比小叶葡萄高3倍,此时山葡萄的相对表达量达到峰值;从铝胁迫的第7~28天,小叶葡萄的相对表达量一直呈逐渐上升的趋势,而山葡萄则呈逐步下降的趋势,到第28天,小叶葡萄上升至接近1600,比下降到最小值的山葡萄高9.5倍(图7)。可见,铝胁迫下耐铝性强的葡萄种质STOP1基因上升幅度平稳,且峰值出现的晚。
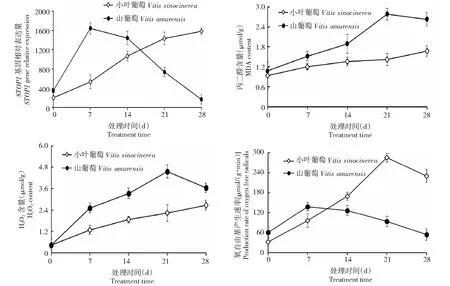
图7 铝胁迫期间STOP1基因的相对表达量及生理指标的变化Fig.7 Relative expression of STOP1 gene and changes of physiological indices during aluminum stress
脂过氧化的产物丙二醛的含量与膜脂受氧化破坏的程度呈正相关;而H2O2和氧自由基均会对膜脂造成氧化破坏,且其含量越高,氧化破坏程度越大。由图7可见,铝胁迫前,山葡萄与小叶葡萄的丙二醛和H2O2含量相差均不大;从铝胁迫开始至第21天,2个种均呈上升趋势,且山葡萄的上升幅度大于小叶葡萄,到第21天时,山葡萄的丙二醛和H2O2含量均达到峰值,此时山葡萄这2项指标均高于小叶葡萄2倍左右;从铝胁迫的第21~28天,山葡萄的丙二醛和H2O2含量均呈下降趋势,但小叶葡萄呈平稳的上升趋势。此外,铝胁迫前山葡萄与小叶葡萄的氧自由基产生速率相差不大;在铝胁迫的第7天,山葡萄的氧自由基产生速率达到峰值,比小叶葡萄高1.4倍,之后便呈下降趋势;而小叶葡萄从铝胁迫开始至第21天均呈上升趋势,在第21天达到峰值,此时比山葡萄高3倍左右。可见,铝胁迫下,耐铝性强的葡萄种质丙二醛、H2O2含量、氧自由基产生速率上升平稳,峰值出现较晚,细胞膜受到不可逆的损伤也较晚,而耐铝性弱的葡萄种质这些指标在铝胁迫早期就大幅度上升,峰值出现较早,细胞膜较早就受到不可逆损伤。这些指标的变化趋势与STOP1基因相对表达量的变化趋势一致,说明铝胁迫下,STOP1基因的相对表达量与葡萄耐铝性密切相关。
3 结 论
3.1 作物耐铝性与STOP1基因
铝元素在土壤中含量丰富,在中性或碱性土壤中,并不会对作物造成危害,但在酸性(pH<5)土壤中,由于产生大量Al3+而抑制作物的生长发育[5]。不同种植物或同种植物的不同基因型对铝毒的耐受性差异较大[21]。一般认为,起源于热带亚热带酸性土壤地区的植物适应铝毒能力更强[22]。通过挖掘耐铝毒基因,利用现代生物技术来提高作物耐铝毒能力,是解决酸性土壤地区铝毒问题最有效的方法。山葡萄是起源于中国东北中性或微碱性土壤地区的一个种,目前已有驯化栽培,其耐铝性较弱;小叶葡萄是起源于中国南方酸性土壤地区的一个野生种,目前还处于野生状态,其耐铝性较强。植物下游耐铝毒基因的表达可被具有高度保守的C2H2锌指结构域的STOP1蛋白调控,如在烟草[15]和桉树[19]中均发现STOP1蛋白可通过调控MATE基因和ALS3基因表达来提高其耐铝性,在拟南芥中[13-14]发现AtSTOP1蛋白可通过调控AtALMT1、ALS3和AtMATE基因表达来提高其耐铝性,此外,水稻(Oryzasativa)OsMATE基因在其耐铝性中也起着重要的作用[16]。这为探究葡萄STOP1基因提供了研究思路和理论依据。
3.2 葡萄与其他植物的STOP1基因同源性
在探明了山葡萄和小叶葡萄耐铝性的基础上,克隆出了二者的锌指转录因子,分别命名为VaSTOP1和VsSTOP1基因。STOP1基因在植物耐铝毒中起着重要作用,这在拟南芥[13]和高粱(Sorghumbicolor)[23]中均有报道。此外,亦有研究表明,赤小豆(Vignaumbellata)的VuSTOP1基因可调控VuMATE1基因的表达[24],高粱的SbSTOP1蛋白定位于细胞核中,可调控与耐铝毒相关基因SbSTAR2和SbMATE的表达[23],进而增强其耐铝毒能力。罗佳佳等[18]发现,STOP1蛋白为典型的锌指结构蛋白,能够调控下游基因的表达,可推测本研究中,VaSTOP1和VsSTOP1蛋白亦有此结构和功能。进化分析发现,山葡萄VaSTOP1蛋白与小叶葡萄VsSTOP1蛋白的亲缘关系最近,同源性达96%,二者与同一分支的野生茶CcSTOP1、黑杨PnSTOP1、烟草NtSTOP1、桉树ErSTOP1的同源性均在80%以上,与另一分支的拟南芥AtSTOP1、小麦TaSTOP1、水稻OsSTOP1等的同源性在44%~76%,说明STOP1蛋白在不同物种间具有较高的保守性。
3.3 STOP1基因的表达量及膜脂过氧化指标与葡萄的耐铝性
拟南芥AtSTOP1基因[13]、大豆(Glycinemax)GmSTOP1基因[17,25]、柱花草(Stylosanthesguianensis)SgSTOP1基因[18]、高粱SbSTOP1基因[23]和赤小豆(Vignaumbellata)VuSTOP1基因[24]在Al3+处理后表达量均显著增加。然而,Al3+处理后,与STOP1基因同源的水稻OsART1基因表达量并没有显著增加,说明Al3+不能调控该基因的表达,但下游耐铝基因OsSTAR的表达量却增强了。在本研究中,铝胁迫的前7 d,VaSTOP1和VsSTOP1的表达量均大幅度上升,但从胁迫的第7~28天,耐铝性弱的山葡萄VaSTOP1表达量大幅度下降,而耐铝性强的小叶葡萄VsSTOP1则一直处于平稳的上升趋势;通过对山葡萄和小叶葡萄膜脂过氧化指标测定后发现,其变化规律与STOP1表达量的变化规律基本相似,即铝胁迫下,二者的膜脂过氧化物质均呈先上升后下降的趋势,其中耐铝性弱的山葡萄峰值出现的时间早于耐铝性强的小叶葡萄。可见,铝胁迫下,耐铝性强的小叶葡萄的VsSTOP1基因可长时间持续大量表达,其细胞存活的时间较长,可持续产生并积累氧自由基及膜脂过氧化产物,而耐铝性弱的山葡萄的VaSTOP1基因表达量在铝胁迫短时间内就达到高峰,随后便开始下降,此时其细胞已经逐渐开始死亡,细胞内的氧自由基和膜脂过氧化产物亦随着细胞的死亡而逐渐下降。
4 结 论
本研究克隆了山葡萄和小叶葡萄的VaSTOP1和VsSTOP1基因,二者的序列长度分别为1782和1800 bp,分别编码594和600个氨基酸,相对分子量分别为67.03和67.48 kD,理论等电点分别为5.21和6.42。二者二级结构的规律是折叠延伸链<α-螺旋<无规则卷曲;由α-螺旋、β-折叠片、β-转角和锌蛋白等组成二者的三级空间结构。系统进化树分析发现,VaSTOP1与VsSTOP1的同源性高达96%,二者与CcSTOP1、PnSTOP1、NtSTOP1、ErSTOP1的同源性均在80%以上。铝毒胁迫下,VaSTOP1基因表达量先上升后下降,峰值较早出现,而VsSTOP1基因表达量则稳定上升,这与二者的膜脂过氧化物质的变化规律基本一致。

