蛋白聚糖与小鼠牙周炎牙槽骨吸收的相关性
牙周炎作为口腔常见疾病,以牙齿松动,牙槽骨丧失为主要特征。牙槽骨吸收的主要原因为牙周炎时成骨细胞、活化的T 细胞、牙周膜成纤维细胞和牙龈成纤维细胞高表达核因子κB 受体活化因子配体(receptor activator of nuclear factor-κB li-gand,RANKL),RANKL 与破骨细胞前体表面的核因子κB 受体活化因子(receptor activator of nuclear factor-kappa B,RANK)相互作用后,激活多个调控破骨细胞发生的转录因子,进而刺激破骨细胞的形成和分化。此外,蛋白酶如组织蛋白酶K(ca-thepsin K,CTSK),基质金属蛋白酶-9(matrix metal-loprotein-9,MMP-9)以及浸润型白细胞产生的炎症介质如白介素-1(interleukin-1,IL-1)和前列腺素E2(prostaglandin E2,PGE2)也可促进破骨细胞生成,加重牙周炎牙槽骨吸收
。
近年研究发现在炎症性疾病中,蛋白聚糖也发挥调控作用
。蛋白聚糖是一类糖链与肽链以共价键结合的生物大分子,广泛存在于细胞内外及细胞表面
。蛋白聚糖中的糖链可分为半乳糖胺聚糖和葡萄糖胺聚糖,前者包括硫酸软骨素、硫酸皮肤素,后者包括肝素、硫酸乙酰肝素、硫酸角质素以及透明质酸。以核心蛋白为基础的蛋白聚糖包括聚集蛋白聚糖、多能蛋白聚糖、饰胶蛋白聚糖、双链蛋白聚糖、纤调蛋白聚糖和凝胶蛋白聚糖。此外,近来发现牙本质细胞外基质中含有大量新型蛋白聚糖,例如牙本质基质蛋白1(dentin matrix protein 1,DMP1)的糖基化形式DMP1-PG
。
牙周组织中含有多种蛋白聚糖,如神经胶质抗原-2、血栓调节蛋白、小亮氨酸蛋白聚糖等,参与细胞增殖、迁移、黏附等多种生物学过程,影响牙周组织的发育和创伤应答
。研究表明,在炎症期间,蛋白聚糖对长骨及关节软骨有调控作用,如DMP1 的糖基化形式可以促进长骨缺损后的骨重建以及髁突骨关节炎中软骨修复。多配体蛋白聚糖4(syndecan4, SDC4)可以促进骨折后长骨愈合
。然而,蛋白聚糖在牙周炎牙槽骨吸收中作用尚未报道,基于此笔者选取与破骨形成以及炎症发展密切相关的细胞外蛋白聚集蛋白聚糖(ag-grecan,ACAN)、双链蛋白聚糖(biglycan,BGN)、饰胶蛋白聚糖(decorin,DCN)和多能蛋白聚糖(versi-can,VCAN),通过建立小鼠牙周炎模型,观察小鼠牙槽骨内蛋白聚糖的变化,以及蛋白聚糖与破骨、炎症之间的相关性,探讨蛋白聚糖在牙周炎牙槽骨吸收中的作用。
师:细读“勘测线路”部分,文中哪一处你最感动,你想对詹天佑说些什么?并把自己的体会用点评形式写在书上。
1 材料和方法
1.1 实验动物
本实验使用SPF 级C57BL/6J 小鼠(实验动物合格证号:[2021]-DW-034,上海南方模式动物研究中心,中国),所有小鼠饲养于同济大学附属口腔医院SPF 级动物房(12 h 光照/12 h 无光饲养环境,室内温度保持25 ℃,相对湿度55%),本实验经同济大学伦理委员会批准(批准号:TJLAC-017-027)。
1.2 主要试剂和仪器
例1 (2018年四川达州)如图1,二次函数y=ax2+bx+c的图象与x轴交于点A(-1,0),与y轴的交点B在(0,2)与(0,3)之间(不包括这两点),对称轴为直线x=2.下列结论:①abc<0;②9a+3b+c>0;③若点点是函数图象上的两点,则y1
1.3 实验方法
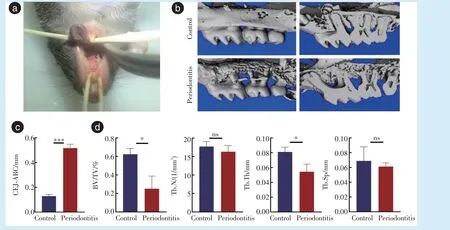
相较对照侧,牙周炎侧颊侧牙槽骨吸收增多,吸收形成筛网状,牙根暴露,牙槽嵴高度降低,釉牙骨质界到牙槽嵴顶的距离增大(
= 20.09,
<0.001),骨体积分数下降(
= 4.295,
= 0.013),骨小梁厚度下降(
= 3.839,
= 0.019),差异具有统计学意义,见图1。
1.3.1 Micro-CT 分析 Micro-CT 扫描小鼠上颌骨。Mimics 13.0 软件分析图像,选取上颌骨第二磨牙颊侧牙槽骨面3D 重建。Image 软件计算上颌第二磨牙釉牙骨质界到牙槽嵴顶的距离。
1.3.3 RT-qPCR 提取小鼠上颌第一磨牙与第二磨牙牙槽骨,放入Trizol 震碎,使用逆转录试剂盒将RNA 逆转录成cDNA,RT-qPCR 检查蛋白聚糖合成相关基因(ACAN、BGN、VCAN、DCN)以及破骨相关基因(CTSK、MMP-9、RANKL)与炎症相关基因白介素-1β(interleukin-1β,IL-1β),白介素-6(inter-leukin-6,IL-6),肿瘤坏死因子-α(tumor necrosis fac-tor α,TNF-α)的变化。以GAPDH 作为内参,引物序列见表1。10 μL 反应体系:2 倍Master mix 5 μL,正、反向引物各0.5 μL,cDNA 0.5 μL,PCR 级水3.5 μL。扩增程序:50 ℃120 s,95 ℃600 s;95 ℃15 s,60 ℃20 s,72 ℃30 s,60 个循环;95 ℃10 s;65 ℃60 s;97 ℃1 s。2
法计算目的基因相对表达量。
1.3.2 组织学染色 14 d 收样后用4%多聚甲醛灌流固定,4%多聚甲醛4 ℃浸泡上颌骨24 ~ 48 h 后取出,放入10%EDTA 室温脱钙2 ~ 4 周,脱钙液每1 ~ 2 d 更换一次。脱钙完成之后,脱水浸蜡,包埋,石蜡切片(厚度:4 μm),进行HE 和TRAP 染色。直立显微镜下观察并拍照。
2.融入EOP后原高职公共英语教学生态失调现象引发的影响研究。高职公共英语融入EOP后,由于教学内容的改变,势必会引起其教学生态中的各因子不再平衡,这种失调现象会引发各种不良影响,分析其不良影响可能带来的后果,提出消除不良影响的必要性。

1.4 统计学分析
使用SPSS 20.0 与GraphPad Prism 8.0 软件进行分析,两组间比较采用独立样本
检验,
<0.05 认为差异具有统计学意义。通过Pearson 相关系数分析检验相关性,
<0.05 认为具有相关性。
90°,进而得△FMK∽△DFA,则由于DA=4,AF=2,所以问题转化为求即的值.而所以得故M点的坐标为至于求点N的坐标又体现了建立平面直角坐标系的优越性了,若仿照点E、M的坐标求法,向坐标轴作垂线,坐标相当难求.但注意到点F、D的坐标分别为(2,0),(0,4),根据待定系数法易求直线EF、DM的解析式分别为y=3x-6和y=-x+4,联立解方程组便可轻而易举地求得点N的坐标为再由两点之间的距离公式,得问题迎刃而解.
6-0 无菌缝线(上海元象生物公司,中国);HE染色试剂盒(上海生工生物公司,中国);TRAP 染色试剂盒(Sigma 公司,美国);逆转录试剂盒(Taka-ra 公司,日本);TRIZOL 试剂(Thermo Fish,美国);QPCR SYBR Green Master Mix(上海翊圣生物公司,中国);PCR 引物(上海生工生物公司,中国);Micro-CT 系统(μCT50,Scanco Medical 公司,瑞士);直立显微镜(尼康公司,日本)。
2 结 果
2.1 牙周炎模型构建
选取12 只8 周龄雄性小鼠,采用丝线结扎法构建小鼠牙周炎模型
:1%戊巴比妥钠腹腔注射麻醉,将小鼠仰卧位固定于手术台,暴露口腔,选用6-0 无菌缝线建模,绕右侧第二磨牙颈部一圈,在颊侧打三重结,左侧不建模作为对照。术后密切观察小鼠生存率以及丝线是否滑脱,建模后14 d收样。
SPWM是调制波与载波在交点时刻产生的控制信号,控制功率器件的通断,得到一系列等幅不等宽的脉冲序列[6]。调制波在微控制器中是正弦函数,载波是通用定时器的寄存器加减产生虚拟三角波[7],SPWM波形的算法采用规则采样法[4],如图6所示。
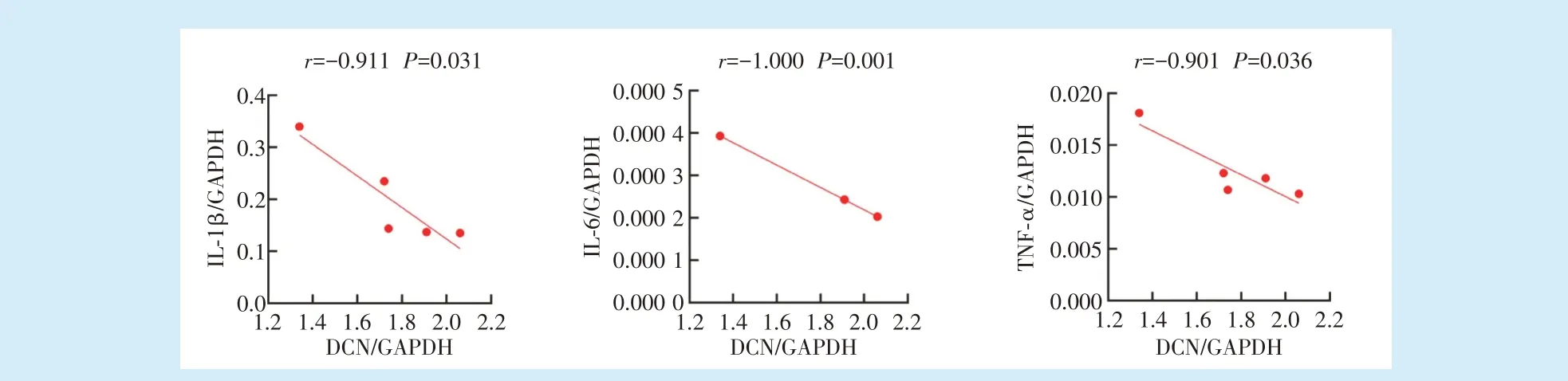
2.2 牙周炎牙槽骨吸收活跃,破骨与炎症相关基因上调
通过对牙周炎牙槽骨组织中的蛋白聚糖合成相关基因ACAN、BGN、VCAN、DCN 及炎症相关基因IL-1β、IL-6、TNF-α 的表达水平分别进行相关性分析,结果发现ACAN 与IL-1β(
= 0.094)、IL-6(
= 0.227)、TNF-α(
= 0.137)、BGN 与IL-1β(
=0.129)、IL-6(
= 0.209)、TNF-α(
= 0.540)、VCAN与IL-1β(
= 0.056)、IL-6(
= 0.162)、TNF-α(
= 0.069)的表达均无相关性。而DCN 与IL-1β(
=-0.911,
=0.031)、IL-6(
=-0.1000,
=0.001)、TNF-α(
=-0.901,
= 0.036)的表达具有负相关性,见图5。
随着“二孩儿”政策的落地,许多家庭都增加了新的成员,然而问题来了,原本已经可以安享晚年的老人,有可能需要再次“上岗”……
2.3 牙周炎牙槽骨组织中的蛋白聚糖含量改变
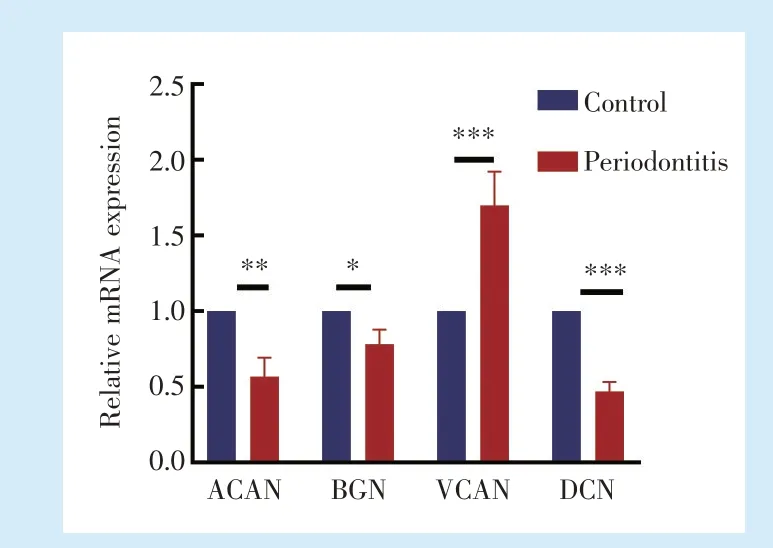
通过提取上颌骨RNA 检测多种与蛋白聚糖合成相关基因,发现相较对照侧,牙周炎侧ACAN(
= 5.984,
<0.001)、BGN(
= 5.984,
<0.001)、DCN(
= 14.73,
<0.001)表达下调,而VCAN(
=6.233,
<0.001)的表达上调,差异具有统计学意义,见图3。
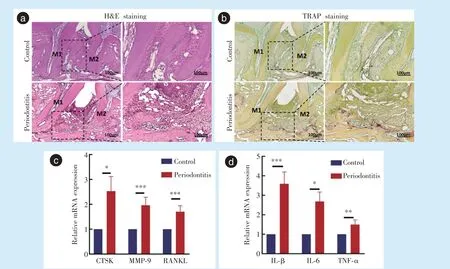
牙周炎侧CTSK(
= 4.507,
= 0.011)、MMP-9(
= 6.652,
<0.001)、RANKL(
= 6.730,
<0.001)等破骨细胞相关基因表达明显上调,差异具有统计学意义(图2c)。牙周炎侧炎症相关基因IL-1β(
= 7.874,
<0.001)、IL-6(
= 5.996,
=0.04)、TNF-α(
= 4.642,
= 0.002)表达也明显上升,差异具有统计学意义(图2d),说明牙周炎模型构建成功。
2.4 牙周炎牙槽骨组织中的蛋白聚糖与破骨相关基因的表达具有负相关性
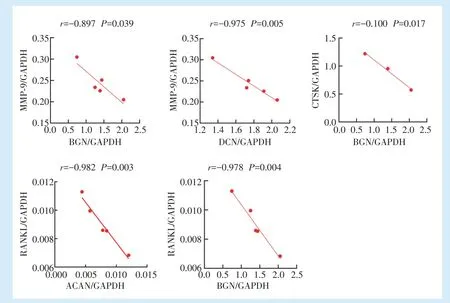
通过对牙周炎牙槽骨组织中的蛋白聚糖合成相关基因ACAN、BGN、VCAN、DCN 及破骨相关基因CTSK、MMP-9、RANKL 的表达水平分别进行相关性分析,结果发现ACAN 与RANKL(
=-0.982,
= 0.003)的表达具有负相关性,与CTSK(
=0.179)、MMP-9(
= 0.677)的表达无相关性。BGN与CTSK(
=-0.100,
=0.017)、MMP-9(
=-0.897,
= 0.039)、RANKL(
= 0.004)的表达均具有负相关性。VCAN 与CTSK(
= 0.173)、MMP-9(
=0.164)、RANKL(
= 0.432)的表达均无相关性。DCN 与MMP-9(
=-0.975,
=0.005)的表达具有负相关性,与CTSK(
=0.085)、RANKL(
=0.106)的表达无相关性,见图4。
2.5 牙周炎牙槽骨组织中的蛋白聚糖与炎症相关基因的表达具有负相关性
HE 染色结果显示,相较对照侧,牙周炎侧牙龈乳头形态破坏、退缩,牙周韧带排列紊乱,纤维组织腔隙增多。第一磨牙远中根与第二磨牙近中根之间炎症细胞浸润增多,牙槽骨高度下降,吸收增多(图2a)。通过TRAP 染色,发现牙周炎侧牙槽骨中TRAP 阳性的破骨细胞数目明显增加(图2b)。
3 讨 论
牙周炎是一种不可逆的非特异性炎性疾病,起因为牙菌斑入侵牙周组织,其代谢产物刺激机体免疫应答并引起牙周组织破坏
。通过丝线结扎法在7 d 后可引发急性牙槽骨丢失,是研究牙周炎的重要模型
。在牙周炎中,牙周组织的破坏与大分子蛋白例如细胞外基质蛋白、蛋白聚糖等的表达变化密切相关
。蛋白聚糖作为可以介导炎症过程的大分子蛋白,参与炎症介质的浓度梯度形成、白细胞募集和细胞外基质重塑,进而调节牙周炎的病理进程
。
其中,细胞外基质蛋白聚糖在骨代谢或炎症发展中至关重要。研究表明,ACAN 可以激活关节伤害感受器中的Toll 样受体-2(Toll-like receptors-2,TLR-2),从而调控骨关节炎发展
。BGN 与纤调蛋白聚糖由成骨细胞生成并分泌,以剂量依赖性的方式直接结合TNF-α,抑制其激活RANK,从而抑制破骨细胞形成
。VCAN 间接通过透明质酸或者直接通过CD44,P-选择素糖蛋白配体-1(P-selectinglycoproteinligand-1,PSGL-1)以及TLR 受体与炎症因子相互作用,激活炎症因子IL-6、TNF-α和NF-κB
。DCN 通过调节干扰素影响淋巴细胞进入炎症组织,从而调控免疫过程中的迟发性超敏反应,并且DCN 的过表达会抑制小鼠血管的炎症性病变
。本实验发现在小鼠牙周炎牙槽骨中ACAN、BGN、DCN 表达下调,而VCAN 的表达上调,提示上述4 种蛋白聚糖与牙周炎的发展可能相关。
虽然前期研究发现蛋白聚糖可调控炎症时牙周组织的代谢,但其在牙周炎牙槽骨吸收中的作用尚不明确。活化的T 细胞表达的MMP-9、RANKL 以及破骨细胞表达的CTSK 促进骨吸收。笔者发现牙周炎中ACAN 与RANKL 的表达具有负相关性,BGN 与CTSK、MMP-9、RANKL 的表达具有负相关性,DCN 与MMP-9 的表达具有负相关性,提示牙周炎中蛋白聚糖ACAN、BGN 与DCN 与牙周炎牙槽骨吸收可能相关,以及BGN 对CTSK、MMP-9、RANKL 可能潜在的负调控作用。
IL-1 和IL-6 促进多型核白细胞和单核细胞/巨噬细胞黏附内皮细胞,刺激前列腺素E2 的产生和溶酶体酶的释放,进而促进牙周组织破坏
。TNF-α 通过上调可以降解基底膜的金属蛋白酶,加速牙周炎进展或者通过激活RANK,参与骨代谢和破骨细胞分化
。此外,研究表明炎症因子白介素会下调DCN 在成纤维细胞中的表达
。本实验结果显示,DCN 与IL-1β、IL-6、TNF-α 的表达具有负相关性,提示牙周炎中DCN 的表达与牙槽骨吸收及牙周组织破坏有相关性,以及IL-1β、IL-6、TNF-α对DCN 可能潜在的负调控作用。
综上,本实验结果表明蛋白聚糖在小鼠牙周炎牙槽骨内的表达量改变,并且与破骨相关因子、炎症相关因子的表达量具有负相关性。为从蛋白聚糖的角度了解牙周炎的致病机制提供实验基础,以及对控制牙周炎牙槽骨吸收的临床问题给予新思路。然而本实验对蛋白聚糖ACAN,DCN 的下降与牙周炎牙槽骨吸收的作用机制尚无具体论证,以及蛋白聚糖ACAN、BGN、ACAN 和DCN 在牙周炎侧牙槽骨吸收,牙周组织破坏中的作用机制和关键信号通路还需进一步探究。
Wang SY performed the experiment and wrote the article. Zhang F peformed the experiment and revised the arti-cle. Wang XK and Sun Y designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
[1] Tsukasaki M. RANKL and osteoimmunology in periodontitis[J]. J Bone Miner Metab,2021,39(1):82-90.doi:10.1007/s00774-020-01165-3.
[2] Schaefer L, Tredup C, Gubbiotti MA, et al. Proteoglycan neofunc-tions: regulation of inflammation and autophagy in cancer biology[J].FEBS J,2017,284(1):10-26.doi:10.1111/febs.13963.
[3] Schwartz NB, Domowicz MS. Proteoglycans in brain development and pathogenesis[J]. FEBS Lett, 2018, 592(23): 3791-3805. doi:10.1002/1873-3468.13026.
[4] Iozzo RV, Schaefer L. Proteoglycan form and function: a compre-hensive nomenclature of proteoglycans[J]. Matrix Biol, 2015, 42:11-55.doi:10.1016/j.matbio.2015.02.003.
[5] Chen Y,Guan Q,Han X,et al.Proteoglycans in the periodontium:a review with emphasis on specific distributions,functions,and po-tential applications[J]. J Periodontal Res, 2021, 56(4): 617-632.doi:10.1111/jre.12847.
[6] Bertrand J, Stange R, Hidding H, et al. Syndecan 4 supports bone fracture repair, but not fetal skeletal development, in mice[J]. Ar-thritis Rheum,2013,65(3):743-752.doi:10.1002/art.37817.
[7] Weng Y, Liu Y, Du H, et al. Glycosylation of DMP1 is essential for chondrogenesis of condylar cartilage[J]. J Dent Res, 2017, 96(13):1535-1545.doi:10.1177/0022034517717485.
[8] Xue H, Niu P, Liu Y, et al. Glycosylation of DMP1 promotes bone reconstruction in long bone defects[J].Biochem Biophys Res Com-mun,2020,526(4):1125-1130.doi:10.1016/j.bbrc.2020.04.020.
[9] Li J, Jin F, Cai M, et al. LncRNA nron inhibits bone resorption in periodontitis[J].J Dent Res,2021.doi:10.1177/00220345211019689.
[10] Hajishengallis G. Periodontitis: from microbial immune subver-sion to systemic inflammation[J]. Nat Rev Immunol, 2015, 15(1):30-44.doi:10.1038/nri3785.
[11] Lin P, Niimi H, Ohsugi Y, et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of peri-odontal disease[J].Int J Mol Sci,2021,22(16):8900.doi:10.3390/ijms22168900.
[12] Zhang Z, Yang X, Zhang H, et al. The role of extracellular matrix metalloproteinase inducer glycosylation in regulating matrix metal-loproteinases in periodontitis[J]. J Periodontal Res, 2018, 53(3):391-402.doi:10.1111/jre.12524.
[13] Gopal S. Syndecans in inflammation at a glance[J]. Front Immu-nol,2020,11:227.doi:10.3389/fimmu.2020.00227.
[14] Miller RE,Ishihara S,Tran PB,et al.An aggrecan fragment drives osteoarthritis pain through Toll-like receptor 2[J]. JCI Insight,2018,3(6):e95704.doi:10.1172/jci.insight.95704.
[15] Kram V, Kilts TM, Bhattacharyya N, et al. Small leucine rich pro-teoglycans, a novel link to osteoclastogenesis[J]. Sci Rep, 2017, 7(1):12627.doi:10.1038/s41598-017-12651-6.
[16] Wight TN,Kang I,Evanko SP,et al.Versican-a critical extracellu-lar matrix regulator of immunity and inflammation[J].Front Immu-nol,2020,11:512.doi:10.3389/fimmu.2020.00512.
[17] Neill T,Sharpe C,Owens RT,et al.Decorin-evoked paternally ex-pressed gene 3 (PEG3) is an upstream regulator of the transcrip-tion factor EB (TFEB) in endothelial cell autophagy[J]. J Biol Chem, 2017, 292(39): 16211 - 16220. doi: 10.1074/jbc.M116.769950.
[18] Oh E, Choi IK, Hong J, et al. Oncolytic adenovirus coexpressing interleukin-12 and decorin overcomes Treg-mediated immunosup-pression inducing potent antitumor effects in a weakly immunogen-ic tumor model[J]. Oncotarget, 2017, 8(3): 4730 - 4746. doi:10.18632/oncotarget.13972.
[19] Binderman I,Gadban N,Yaffe A.Extracellular ATP is a key mod-ulator of alveolar bone loss in periodontitis[J]. Arch Oral Biol,2017,81:131-135.doi:10.1016/j.archoralbio.2017.05.002.
[20] Plemmenos G,Evangeliou E,Polizogopoulos N,et al.Central regu-latory role of cytokines in periodontitis and targeting options[J].Curr Med Chem, 2021, 28(15): 3032 - 3058. doi: 10.2174/0929867327666200824112732.
[21] Hashimoto-Uoshima M, Noguchi K, Suzuki M, et al. Effects of in-terleukin-4 on proteoglycan accumulation in human gingival fibro-blasts[J]. J Periodontal Res, 2002, 37(1): 42-49. doi: 10.1034/j.1600-0765.2002.00642.x.

