逆境胁迫和植物生长调节剂对甘草种子萌发的影响
刘长乐,寇佩雯,许祎珂,张永生,高 静,贺壮壮,李帅帅,黄文静*
(1.陕西中医药大学/陕西中药资源产业化省部共建协同创新中心/秦药特色资源研究开发国家重点实验室(培育)/陕西中药产业技术研究院,陕西 咸阳 712083;2.陕西海天制药有限公司,陕西 咸阳 712046;3.陕西中医药大学药学院,陕西 咸阳 712046)
种子发芽是种子植株完成其生活史和繁殖下一代的重要生理过程和关键阶段[1],是植物适应环境变化以保持自身繁衍的重要特性[2],对植物的定居、群落演替与动态起着决定作用[3]。因此深入研究种子发芽对探索植株的分布、进化、保护及合理利用具有重要意义。种子发芽受温度、水分、盐碱、pH 等多种环境因子影响,是一个复杂的生理过程[4-6]。大量研究证明,植物种子发芽在受到非生物胁迫(如干旱、低温、盐渍等)时可对种子抗逆酶、渗透调节物质、细胞膜的结构和功能等造成影响或伤害[7-8],如温度是影响种子的主要生态因子之一,通过影响种子内部酶活性和物质代谢进程直接或间接影响种子发芽[9]。
植物种子发芽受外部环境和内源激素的共同调节。近年来,外源植物激素在提高植物抗逆方面取得较多成果[10]。外源植物激素不仅能调节和控制作物生长发育,而且能调控植物体细胞基因的表达,协调植株的生长与外界条件的关系,对提高植株抗逆性和产量具有重要意义[11]。褪黑素(Melatonin,MT)作为一种新型植物生长调节剂,可有效缓解逆境胁迫对种子发芽造成的损伤,增强植株抵抗逆境胁迫的能力[12]。向警等用MT 处理盐胁迫下的水稻种子发芽与幼苗生长,发现MT 能够增强水稻幼苗抗氧化与渗透调节能力,提高幼苗的耐盐性[13]。萘乙酸(Naphthalene acetic acid,NAA)是一种广谱型外源植物激素,可促进植物细胞分裂,提高植物抗氧化酶,促进植物发芽[14]。吲哚乙酸(Indole acetic acid,IAA)是植株内最丰富的内源生长素,一定的浓度外源IAA 可促进种子发芽和幼苗的形成[15]。NAA 和IAA 浸种可以显著提高种子活力指数,促进根茎的伸长,增加植株体内丙二醛和可溶性糖含量等[16]。
甘草为豆科植物甘草(Glycyrrhiza uralensisFisch.)、胀果甘草(Glycyrrhiza inflataBat.)或光果甘草(Glycyrrhiza glabraL.)的干燥根和根茎,性甘、平,具有调和诸药、清热解毒、祛痰止咳等作用,用于缓解药物毒性、烈性脾胃虚弱,倦怠乏力,心悸气短等,素有“国老”之称[17]。甘草采挖历史悠久,但由于过度采挖、种群迁徙及退化和生态环境改变,野生甘草资源濒临枯竭,野生抚育和人工种养相结合的资源产业是甘草中药资源发展的必经之路[18]。甘草种子发芽特性研究是甘草中药材质量形成的起点和建立甘草种子种苗标准的基础,对甘草中药资源种群建构具有重要意义[19]。本实验通过对野生乌拉尔甘草种子进行不同处理,探讨提高乌拉尔甘草种子发芽率的最适条件,以期为甘草人工育苗、栽培过程及甘草规范化种植提供参考。
1 材料与方法
1.1 材料
供试野生乌拉尔甘草种子于2020 年3 月采自新疆乌鲁木齐县(东经87°40′83",北纬43°47′06"),经陕西中医药大学药学院王继涛高级实验员鉴定为豆科植物甘草(G. uralensis)种子。收获净种后,经打磨后放入编织袋内,于2~8℃冷柜贮藏。试验在陕西中药资源产业化省部共建协同创新中心,于2020年9月-2021年6月份进行。
1.2 主要仪器与试剂
RTOP-400Y 智能人工气候箱(浙江托普云农科技股份有限公司)、90 mm 玻璃培养皿、聚乙二醇-6000(PEG-6000)、氯化钠(NaCl)、碳酸钠(Na2CO3)、30%双氧水(H2O2)、盐酸(HCl)、氢氧化钠(NaOH)、萘乙酸(NAA)、3-吲哚乙酸(IAA)、褪黑素(MT)均为分析纯。
1.3 方法
采用纸皿法,选取大小一致,籽粒饱满的野生乌拉尔甘草种子消毒(7.5% H2O2浸泡30 min,蒸馏水冲洗4~5 次至无味),用无菌滤纸吸干水分备用。将消毒后的甘草种子置于铺有双层无菌滤纸的培养皿中,每个培养皿30 粒种子,加10 mL 溶液。温度、pH、NaCl、PEG-6000 和双重胁迫及MT、NAA 和IAA 实验置于人工气候箱中培养,光照12 h/黑暗12 h,光照强度3000 lx,湿度60%,以种子胚根突出种皮的长度为种子长度的1/2 为标准,3 次重复,记录发芽率、发芽势和发芽时滞。计算公式如下:
发芽率(%)=7 d 内发芽的总粒数/供试种子总数×100%
发芽势(%)=3 d 内发芽种子数/供试种子总数×100%
发芽时滞(d)=第1 粒种子发芽时间-种子种植的时间
1.3.1 种子形态特征观察及千粒测重
采用四分法随机挑选6 粒的乌拉尔果甘草种子,用体视显微镜对其形态特征进行观察。千粒测重采用五百粒法[20],四分法随机取500粒,放到培养皿上称重,重复5次,计算种子质量。
1.3.2 温度对种子发芽的影响
将乌拉尔甘草种子分别置于5、10、15、20 和25℃人工气候箱中培养,计算发芽率、发芽势和发芽时滞。
1.3.3 pH对种子发芽的影响
用稀盐酸和NaOH 溶液调整蒸馏水pH 值为2、4、6、8、10,分别将乌拉尔甘草种子置于不同pH 的溶液中,在25℃人工气候箱中培养。
1.3.4 水分胁迫对种子发芽的影响
在25℃光照培养箱中,将乌拉尔甘草种子置于0(CK)、0.05、0.10、0.15、0.20、0.25 g/mL 不同浓度的PEG-6000溶液中进行发芽试验。
1.3.5 盐胁迫对种子发芽的影响
将乌拉尔甘草种子置于0(CK)、0.1、0.15、0.2、0.3、0.4 mol/L 不同浓度的NaCl 溶液中,在25℃光照培养箱中培养。
1.3.6 干旱和盐双重胁迫对种子发芽的影响
将乌拉尔甘草种子置于NaCl 浓度为0.1、0.15、0.2 mol/L 和PEG-6000 浓度为0.05、0.10、0.15 g/mL共九个处理组(见表1),蒸馏水组为对照,在25℃人工气候箱中培养。
表1 双重胁迫实验设计Table 1 Double stress experiment design
1.3.7 覆土厚度对种子发芽的影响
将乌拉尔甘草种子播于育苗盘,分别覆盖细沙土0、0.5、1、1.5、2 cm,在组织培养室内光照12 h/黑暗12 h进行种子出苗试验。
1.3.8 褪黑素对种子发芽的影响
将乌拉尔甘草种子分别置于0、50、100、300、500 μmol/L 的褪黑素溶液中浸泡24 h,用蒸馏水洗净,水分挥干后,在0.2 mol/L 的NaCl溶液中培养,于25℃光照培养箱中培养。
1.3.9 萘乙酸对种子发芽的影响
将种子分别置于0、5、50、100、300、500 mg/L 的萘乙酸溶液中浸泡24 h 后,用蒸馏水洗净,水分挥干后在25℃光照培养箱中进行发芽试验。
1.3.10 3-吲哚乙酸对种子发芽的影响
将乌拉尔甘草种子分别置于0、5、50、100、300、500 mg/L 的3-吲哚乙酸溶液中浸泡24 h,用蒸馏水洗净,水分挥干后在25℃光照培养箱中进行发芽试验。
1.4 数据处理
采用Microsoft Excel 2019 整理原始数据,DPS7.05 统计软件进行方差分析(ANOVA)和多重比较。
2 结果与分析
2.1 乌拉尔甘草种子形态特征及千粒重
野生乌拉尔甘草种子呈圆肾形,表面黄绿色或褐色,表面光滑,种脐周边有一微隆起暗色环,种脊棕色条状隆起,千粒重为8.0042 g±0.1722 g。

表2 乌拉尔甘草种子形态特征观察Table 2 Morphological characteristics of G. uralensis seeds
2.2 温度对乌拉尔甘草种子发芽的影响
由表3可知,不同温度条件下,乌拉尔甘草种子发芽存在显著差异。随着温度的升高,乌拉尔甘草种子发芽势和发芽率逐渐增加,发芽时滞减少。20℃和25℃时发芽势和发芽率无显著差异,15℃时种子发芽势降低至26.67%,发芽时滞增长至4 天,5℃时种子发芽时滞达10 天,可见低温对乌拉尔甘草种子发芽具有明显抑制作用。
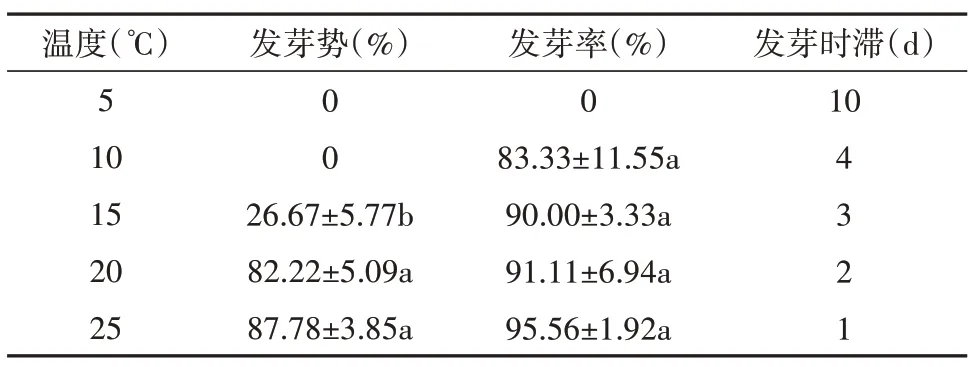
表3 温度对乌拉尔甘草种子发芽的影响Table 3 The effect of temperature on the germination of G.uralensis seeds
2.3 pH对乌拉尔甘草种子发芽的影响
由表4 可知,乌拉尔甘草种子在pH 值为2~10之间均能发芽,pH 值为4、6 和8 时乌拉尔甘草种子发芽势无显著差异,发芽率较高且差异性较小,说明乌拉尔甘草种子在pH 值为4~8 的环境中发芽能力较强。pH 值为2 时发芽势和发芽率显著降低,说明pH较低的环境可抑制乌拉尔甘草种子发芽。

图1 乌拉尔甘草种子Fig. 1 Pictures of G. uralensis seeds
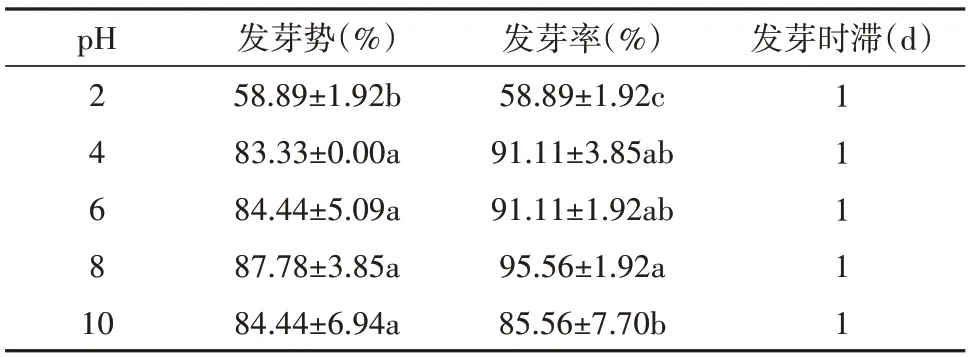
表4 pH对乌拉尔甘草种子发芽的影响Table 4 The effect of pH on the germination of G. uralensis seeds
2.4 水分胁迫对乌拉尔甘草种子发芽的影响
由表5可知,随着PEG 浓度的升高,乌拉尔甘草种子发芽率和发芽势逐渐降低,发芽时滞增加。从发芽势分析,当PEG 浓度≤0.15 g/mL 时,乌拉尔甘草种子发芽势均保持在68.89%以上,当浓度增加至0.2 g/mL 时发芽势显著降低至38.89%;从发芽率分析,当PEG 浓度为0.05 ~0.15 g/mL 时,乌拉尔甘草种子发芽率无显著性差异,当浓度增加至0.25 g/mL时发芽率显著降低至27.78%,较0.15 g/mL 下降50%。由此可知,PEG-6000 溶液的浓度为0.2 g/mL时是种子发芽能力显著降低的转折点,高于此浓度时种子发芽受到显著抑制。
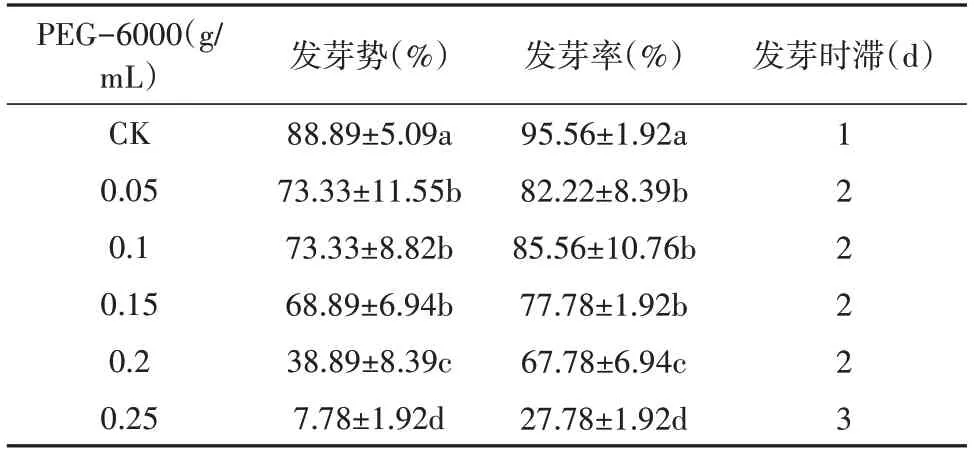
表5 水分胁迫对乌拉尔甘草种子发芽的影响Table 5 The effect of water stress on the germination of G. uralensis seeds
2.5 盐胁迫对乌拉尔甘草种子发芽的影响
由表6 可知,随着NaCl 浓度的升高,乌拉尔甘草种子发芽率和发芽势呈逐步降低的趋势,发芽时滞增加。当NaCl浓度≤0.15 mol/L时,甘草种子发芽势保持在75.56%以上,发芽率为83.33%以上,当浓度增加至0.2 mol/L 时发芽势和发芽率显著降低;当NaCl浓度增加至0.4 mol/L时,发芽势仅为1.11%,发芽率为12.22%,表明乌拉尔甘草具有一定的抗盐碱能力,但NaCl浓度>0.2 mol/L时乌拉尔甘草种子发芽会受到明显抑制。
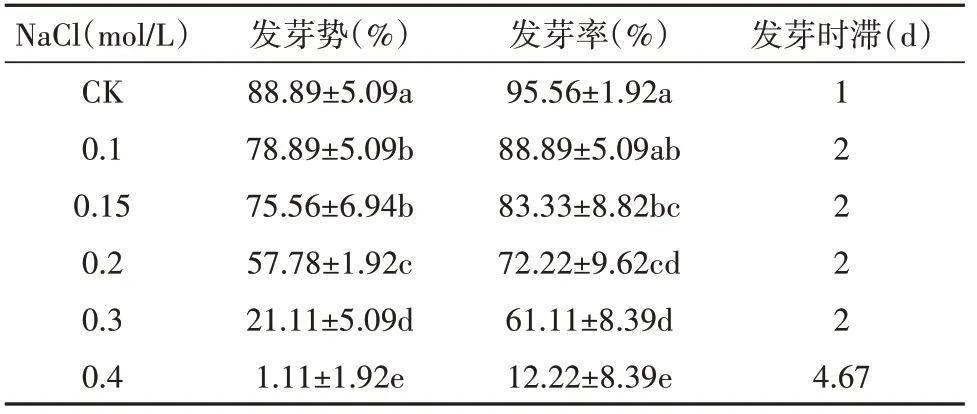
表6 NaCl对乌拉尔甘草种子发芽的影响Table 6 The effect of NaCl on the germination of G. uralensis seeds
2.6 干旱和盐双重胁迫对乌拉尔甘草种子发芽的影响
由表7 可知,乌拉尔甘草种子发芽势和发芽率随着双重胁迫的加剧总体呈下降趋势,双重胁迫处理下乌拉尔甘草种子发芽势和发芽率显著降低,发芽时滞增加。在轻度胁迫(N1P1)下乌拉尔甘草种子发芽率较CK 组差异较小。在中度胁迫下,随着PEG-6000 浓度增加(N2P1、N2P2、N2P3)乌拉尔甘草种子各处理较CK 组发芽势显著下降,发芽率差异较小;随着NaCl 浓度增加(N1P2、N2P2、N3P2)乌拉尔甘草种子发芽势和发芽率较CK 组显著下降。重度胁迫(N3P3)下,乌拉尔甘草种子发芽势仅为8.89%,发芽率仅为46.67%,表明乌拉尔甘草种子具有一定的耐旱和耐盐碱特性,但较高浓度下的干旱和盐交互胁迫会抑制拉尔甘草种子发芽,且盐胁迫对甘草种子发芽影响更强。
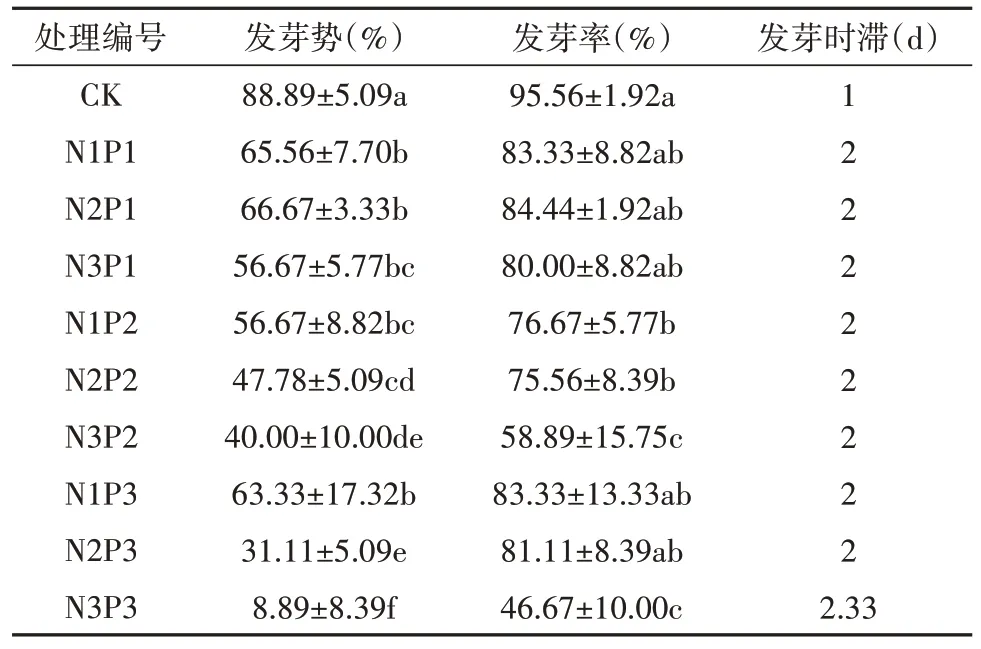
表7 PEG-6000和NaCl双重胁迫对种子发芽的影响Table 7 The effect of PEG-6000 and NaCl dual stress on the seed germination of G. uralensis seeds
2.7 覆土厚度对乌拉尔甘草种子发芽的影响
覆土厚度对乌拉尔甘草种子发芽率和发芽势有一定的影响(表8),在不同覆土厚度下乌拉尔甘草种子均可发芽,其中最适覆土厚度为0.5 cm,出苗率为62.22%;覆土厚度为0 cm 时,发芽时滞仅为1.67 d,发芽率与0.5 cm 覆土厚度无显著差异,但由于出苗后胚根裸漏于空气中,存在死苗现象。随着覆土厚度增加,乌拉尔甘草种子发芽率和发芽势呈下降趋势,发芽时滞增加。
2.8 褪黑素对盐胁迫下乌拉尔甘草种子发芽的影响
由结果2.5 可知,0.2 mol/L NaCl 浓度下乌拉尔甘草种子发芽率和发芽势显著降低,褪黑素预处理可显著缓解0.2 mol/L NaCl 处理(CK 组)下对乌拉尔甘草种子发芽率和发芽势的抑制作用。50 ~500 μmol/L 褪黑素预处理的发芽势比CK 组的发芽势显著提高了22.22% ~28.89%,发芽率显著提高11.11%~17.78%,这说明褪黑素处理可显著提高盐胁迫下乌拉尔甘草种子的发芽率和发芽势,降低发芽时滞,其中100 ~300 μmol/L预处理效果最佳。
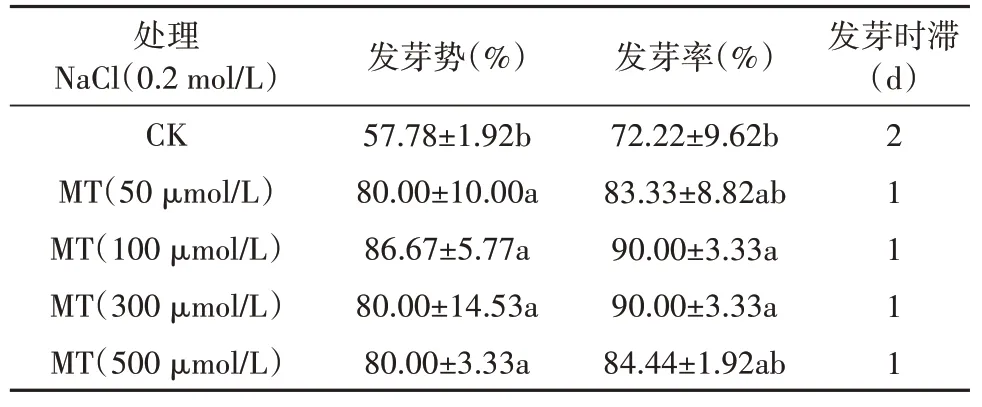
表9 褪黑素对盐胁迫下乌拉尔甘草种子发芽的影响Table 9 The effect of melatonin on the germination of G. uralensis seeds under salt stress
2.9 萘乙酸对乌拉尔甘草种子发芽的影响
由表10 可知,NAA 预处理后,随着NAA 浓度增加乌拉尔甘草种子发芽势和发芽率均表现出逐渐降低的趋势。当NAA 浓度为5 mg/L 时乌拉尔甘草种子发芽势和发芽率与CK 组无显著差异;当NAA浓度>50 mg/L时乌拉尔甘草种子发芽与CK组相比发芽势和发芽率显著降低;当NAA 浓度为300 mg/L时较空白组发芽势和发芽率下降幅度为63.33%和45.56%,表明NAA 浓度≥50 mg/L 时可抑制乌拉尔甘草种子发芽。
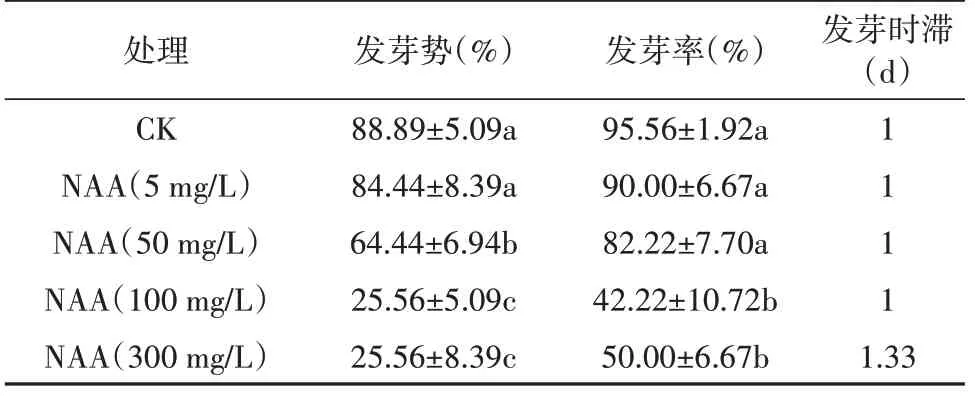
表10 萘乙酸对乌拉尔甘草种子发芽的影响Table 10 The effect of naphthaleneacetic acid on the germination of G. uralensis seeds
2.10 3-吲哚乙酸对乌拉尔甘草种子发芽的影响
由表13 可知,乌拉尔甘草种子发芽率和发芽势呈先上升后下降的趋势。在IAA浓度为50 mg/L时,乌拉尔甘草种子发芽率和发芽势最高,与CK 相比发芽势增加4%,发芽率则无显著性差异。高浓度的IAA 对甘草发芽具有抑制作用,当IAA 浓度大于300 mg/L 时,乌拉尔甘草种子发芽势和发芽率呈下降趋势。
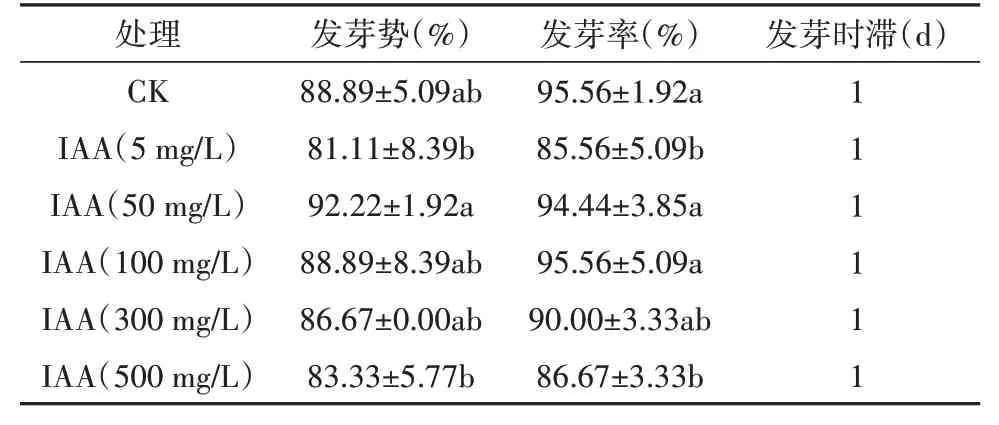
表11 3-吲哚乙酸对乌拉尔甘草种子发芽的影响Table 11 The effect of 3-indoleacetic acid on the seed germination of G. uralensis seeds
3 结论与讨论
种子是药材生产最基本、最重要的生产资料,种子质量的优劣是决定植株生长发育好坏、产量高低的关键因素,也是决定药材质量和品质的先决条件,而发芽势、发芽率和发芽时滞是检验种子质量的重要指标[21-23]。本研究发现,乌拉尔甘草种子在10℃以上发芽时滞较短,在20 ~25℃发芽势和发芽率较高,种苗状态好。甘草可适应pH 范围较宽,可在pH 值为4~8 的环境中生长。不同浓度盐胁迫、干旱胁迫和盐干旱双重胁迫处理下甘草种子发芽率和发芽势呈持续下降的趋势,低浓度胁迫处理下对种子发芽影响不显著,高浓度则会明显抑制甘草种子发芽,说明甘草种子具有一定的抗盐和抗旱能力,这与王妍等[24]研究结果相似。覆土厚度在0.5 cm 左右时,甘草种子出芽率高,发芽时滞短,不覆土不利于甘草幼苗生长,覆土过厚则不利于甘草种子发芽。
植物在逆境胁迫下体内多种酶的平衡被打破,从而积累有害物质[25]。植物激素是调控种子休眠与发芽的最重要因素,可以打破种子的休眠状态,加快细胞分裂,缓解或解除种子胁迫,为种子发芽创造条件[26-27]。100 ~300 μmol/L 褪黑素浸种预处理可显著提高盐胁迫下甘草种子的发芽率和发芽势,低浓度和高浓度的褪黑素处理则对甘草种子发芽影响较小。这可能是因为盐胁迫下,种子内部渗透系统失衡,细胞内Na+剧集过多,产生过多氧自由基进而对细胞膜造成损害[28],植物为缓解氧化胁迫带来的伤害,通过提高自身抗氧化酶的含量,从而减少氧自由基的积累[29]。褪黑素为吲哚类化合物,具有抗氧化作用[30],可直接消除氧自由基及后续产物,同时激活种子抗氧化系统,清除组织内多余氧离子,维持细胞氧化系统平衡[31]。大量研究指出褪黑素还可缓解干旱胁迫[32]、镉胁迫[33]和低温胁迫[34]等对豆科植物种子发芽和生理特性的影响。萘乙酸对乌拉尔甘草种子发芽表现出抑制作用,且浓度越高,抑制作用越明显。可能是发芽阶段的种子组织内乙烯含量较高,乙烯抑制生长素的合成与运输,NAA 又可诱导乙烯合成,进而加速种子器官衰老和降低种子活力[14]。IAA 具有双重作用,低浓度可促进种子发芽,高浓度则阻碍种子水分吸收,抑制种子发芽[35]。
在甘草人工种植过程中,甘草宜在3 ~4 月春播,选择灌溉便利,土壤微碱性为宜,如砂质土壤等。播种前可考虑用外源植物激素预处理甘草种子,以提高种子发芽率,降低发芽时滞,提高甘草的抗逆能力,但需注意植物生长调节剂的种类和浓度。播种时将甘草种子均匀地播于平地表面,以盖住种子为宜,耱平即可。

