补肾益气化瘀冲剂对去卵巢骨质疏松模型大鼠血管形成的影响及机制研究
王 君吴滨滨王晓东赵 璇张 鑫王若霖修晓光*
(1.青岛市中医医院(青岛市海慈医院)血管外科,山东 青岛 266033;2.青岛市中医医院(青岛市海慈医院)关节外科,山东青岛 266033;3.黄岛区人民医院创伤、手足外科,山东 青岛 266400;4.黄岛区人民医院呼吸内科,山东 青岛 266400;5.青岛颐生键中西医结合骨伤医院骨科,山东 青岛 266100;6.烟台大学药学院,山东 烟台 264005)
随着人口老龄化的加剧,中老年群体高发疾病受到更多关注,其中骨质疏松症(osteoporosis,OP)中多发于绝经妇女和老年群体,据流行病学调查,我国64.6%老年人患者有骨质疏松症[1]。 骨质疏松症主要表现为以骨密度(bone mineral density,BMD)降低、骨量减少、骨微结构破坏导致骨脆性增加,骨骼质量下降,骨折发生风险提高的骨代谢性疾病[2]。 女性停经后骨密度急速下降,绝经后骨质丢失情况加剧,绝经5 年内丢失骨量达到总骨量的10%,出现绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)[3]。 PMOP 的致病机制是研究的热点,主要集中于雌激素的下降和骨-血管的耦联[4]。 血管的形成能为骨骼发育以及再生修复提供所需营养,在减缓骨质疏松症中起到了重要作用[5]。
Toll 样受体(Toll-like receptor,TLRs)是一类I 型跨膜蛋白,通过特异性识别病原体,参与机体的非特异性免疫反应,并进行跨膜转运,产生级联信号反应,活化下游转录因子,介导免疫应答[6]。 核因子κB(nuclear factor kappa-B,NF-κB)是细胞内影响成骨细胞和破骨细胞分化形成的转录因子,其所在信号通路对成骨细胞的增殖和分化有重要调控作用[7]。 TLRs/NF-κB 通路参与调解机体的炎症反应和免疫反应,并通过影响成骨细胞和破骨细胞介导骨质疏松症的发展。 已有研究发现补肾类中药方剂对OP 有较好疗效[8]。 本研究利用卵巢去势大鼠构建骨质疏松模型,从血管形成的角度看来探究补肾益气冲剂基于TLRs/NF-κB 通路对骨质疏松症的作用。
1 材料和方法
1.1 实验动物
60 只9 周龄SPF 级健康雌性SD 大鼠,购自上海斯莱克实验动物有限责任公司[SYXK(沪)2017-0008],平均体重(220±15)g,饲养于青岛汉德森生物科技有限公司[SYXK(鲁)2019-0010],饲养室保持良好通风,温度(24±2)℃,湿度(50±10)%,12 h明/12 h 暗,标准饲料,自由饮水,饲养1 周以适应环境,第2 周开始进行实验。 动物实验已通过本院实验动物伦理与管理委员会审批(2019050802),严格按照3R 原则给予人道关怀。
1.2 主要试剂与仪器
补肾益气化瘀冲剂制于青岛市中医医院药剂科(生产批号:201932);阿仑磷酸钠片购于中国扬子江药业集团;Microfil 硅胶灌注显影剂购于美国Flow Tech 公司;EDTA 脱钙液购自上海如吉生物科技发展有限公司;BCA 蛋白定量试剂盒购于上海恒远生物公司;兔抗CD31 单克隆抗体、HE 染色试剂盒和DAPI 染色液购自上海碧云天公司;血管内皮生长因子(vascular endothelial growth factor,VEGF)和低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)ELISA 检测试剂盒购于上海晶抗生物工程有限公司。
台式低温高速离心机(济南来宝医疗器械有限公司);恒冷切片机(德国徕卡公司);SktScan1176 Micro-CT 扫描仪(德国Bruker 公司);双能X 线骨密度测试仪(美国GE 公司);光学显微镜(日本奥林巴斯公司);倒置荧光显微镜(德国徕卡公司);Western blot 垂直电泳仪(北京六一生物科技有限公司)。
1.3 实验方法
1.3.1 分组和骨质疏松症模型构建
60 只大鼠根据体重分层随机化原则分为4 组:假手术组、模型组、冲剂组、阳性对照组,每组15 只。大鼠禁食24 h 后,造模大鼠行双侧卵巢摘除术。 对所有大鼠进行称重,根据体重腹腔注射40 mg/kg 的戊巴比妥钠进行麻醉,碘伏消毒后,经背部中线纵行1.5 cm 切口,依次分离进入腹腔,假手术组大鼠仅进行手术,不切除双侧卵巢,其余3 组大鼠沿输卵管,找到桑葚状卵巢组织,轻提出卵巢并分离周围脂肪组织,严密结扎输卵管,切除双侧卵巢,逐层缝合,术后连续肌肉注射10 万U 青霉素3 d,预防感染。
1.3.2 给药处理
造模2 周后,各组大鼠分别进行给药处理:冲剂组给予5 g/kg 补肾益气化瘀冲剂灌胃处理;阳性对照组给予0.5 mg/kg 阿仑磷酸钠片灌胃处理;假手术组和模型组大鼠给予等量生理盐水灌胃处理。各组大鼠每天灌胃给药1 次,连续给药12 周。 各组大鼠统一饲养环境条件,自由饮水和进食标准饲料,分笼饲养,定期消毒和通风。
1.3.3 样本处理
最后1 次灌胃给药后禁食24 h,腹腔注射10%戊巴比妥钠麻醉,每组15 只大鼠中选取10 只处死,打开腹腔,腹腔主动脉采血5 mL,转速3000 r/min,离心15 min,取上层血清1.5 mL,-20℃保存备用。剥离大鼠双侧股骨并剔除周围软组织,0.9% NaCl冲洗1 min,右侧股骨用PBS 浸湿的纱布包裹放入-20℃的冰柜中保存,用于骨密度检测、Micro-CT 分析、骨组织冷冻切片;左侧股骨用于提取组织蛋白。每组另外5 只大鼠采取麻醉后腹主动脉放血法处死[9],用于硅酮橡胶(MicroFil)灌注。
1.3.4 HE 染色观察
取右侧股骨,放入液氮中速冻10 s,OCT 包埋胶固定,使用冷冻切片机进行切片,取股骨组织冷冻切片,固定,经苏木素-伊红染色,乙醇脱水,二甲苯透明,干燥,中性树胶封片,光学显微镜下观察大鼠股骨组织细胞形态并拍摄照片。
1.3.5 骨密度检测、Micro-CT 和血管灌注成像
取大鼠右侧股骨,在双能X 线骨密度测试仪行BMD 测量,分辨率设为1.0 mm×1.0 mm,扫描速度设为60 mm/s,以股骨头中心区域2. 0 mm×1.5 mm为扫描兴趣区域,分析BMD(g/cm2),连续测量5次,并记录。
使用Micro-CT 分析四组大鼠远端股骨,分辨率为10 μm,管电压为50 kV,管电流为400 μA,曝光时间300 ms,360°扫描股骨近端部位,使用Micro View 和Med Project 4.1 软件对大鼠股骨标本进行三维重建,并测量骨小梁厚度(trabecular thickness,Tb.Th)和骨小梁间距(trabecular spacing,Tb.Sp),每组图片3 D 重建条件一致。
每组用于血管灌注的5 只大鼠麻醉后,打开腹腔,在腹主动脉近心端结扎,结扎线远端置入留置针,并连接至生理盐水瓶中,排出血液,灌10%甲醛溶液,使血管硬化,小鼠双腿和尾巴出现抖动后灌注MicroFil 溶液,大鼠后肢足趾出现黄色造影剂,说明灌注成功,大鼠标本在4℃冰箱过夜,次日收集股骨,10%甲醛溶液室温固定,10% EDTA 脱钙液进行脱钙5 周,使用Micro-CT 检测股骨组织微血管形态。
1.3.6 免疫荧光染色分析
取大鼠右侧股骨冷冻切片,PBS 漂洗,室温封闭1 h,加入CD31 单抗4℃孵育过夜;加入二抗37℃避光孵育1 h;PBS 漂洗;DAPI 避光复染5 min;PBS 漂洗,封片后荧光显微镜观察并拍摄照片。
1.3.7 ELISA 检测血清VEGF 和HIF-1α 浓度
取大鼠血清,按照VEGF、HIF-1α ELISA 试剂盒及BCA 蛋白定量试剂盒说明书进行操作。 用酶标仪在波长450 nm 处测定吸光度(OD 值),通过标准曲线计算4 组大鼠血清样本中VEGF、HIF-1α 的浓度。
1.3.8 Western blot 分析p-p50/p50 和p-p65/p65蛋白的表达
分别称取4 组大鼠的左侧股骨组织90 mg,加入液氮研磨成粉状,加入蛋白裂解液制得组织匀浆液,用TRIzol 法提取组织总蛋白,采用BCA 法对蛋白进行定量,上样进行凝胶电泳30 min,转膜,室温下5% BSA 封闭3 h,加入一抗4℃孵育过夜,洗膜,室温孵育二抗,显色成像,用Image-Lab 分析灰度值,GAPDH 作为内参对照。
1.4 统计学方法
采用Graphpad 5.0 软件分析实验数据,定量数据用平均数±标准差(¯x±s)表示,实验数据进行正态性和方差性检验,骨密度比较采用重复测量资料的方差分析,VEGF、HIF-1α 浓度及p50/p-p50、p65/pp65 的表达采用单因素方差分析进行组间比较,两两比较采用SNK 法,P<0.05 表示差异显著,结果具有统计学意义。
2 结果
2.1 4 组大鼠骨密度检测结果比较
各组大鼠股骨远端骨密度检测结果比较见图1,与假手术组比较,模型组股骨BMD 明显降低,冲剂组和阳性对照组较模型组股骨BMD 明显增加,差异具有统计学意义(P<0.05)。 通过模型组BMD 再次说明本次骨质疏松大鼠模型制备成功(P<0.05)。
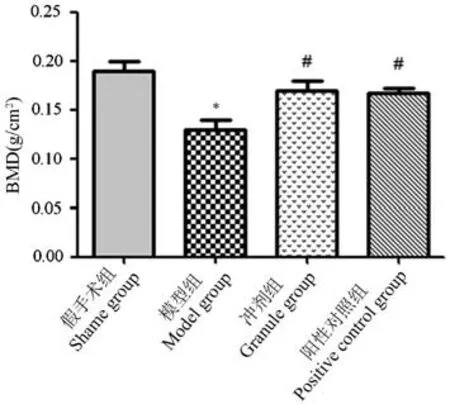
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05。
2.2 4 组大鼠股骨组织形态观察结果比较
4 组大鼠股骨组织HE 染色观察结果见图2,假手术组大鼠股骨有大量新生血管形成,骨小梁排列致密;模型组新生血管少,骨小梁生长稀疏;冲剂组新生血管较模型组多,有部分骨小梁生长,排列有序;阳性对照组新生血管情况与冲剂组相近,骨小梁生长良好。
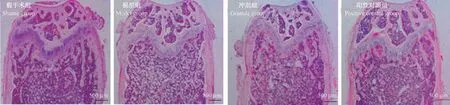
图2 4 组大鼠股骨组织HE 染色形态观察比较Figure 2 HE staining morphology comparison of femur tissues among four groups rats
2.3 4 组大鼠MicroFil 血管灌注结果比较
4 组大鼠MicroFil 血管灌注结果见图3,与假手术组比较,模型组血管数量少,冲剂组和阳性对照组血管数量明显比模型组多。
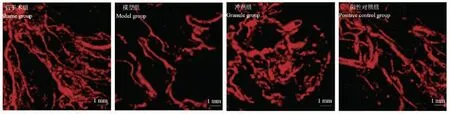
图3 大鼠股骨的MicroFil 血管造影Figure 3 MicroFil angiography of rat femur
2.4 4 组大鼠Micro-CT 分析结果比较
Micro-CT 的三维重建图像和定量分析结果见图4,可看出模型组大鼠骨量和骨小梁厚度明显低于假手术组,骨小梁间距明显高于假手术组;冲剂组和阳性对照组大鼠的股骨骨量及骨小梁厚度与假手术组相近,较模型组明显增多,骨小梁间距明显低于模型组,差异具有统计学意义(P<0.05)。
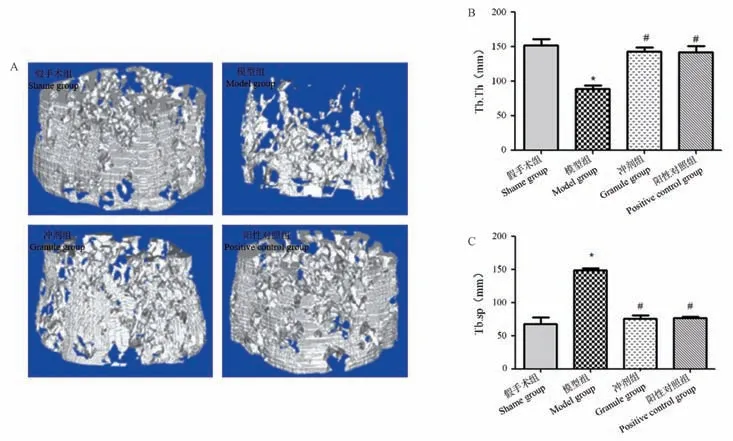
注:A:股骨扫描图像比较;B:Micro-CT 定量分析Tb.Th 比较;C:Micro-CT 定量分析Tb.Sp 比较析。 与假手术组相比,*P<0.05;与模型组相比,#P<0.05。
2.5 4 组大鼠CD31 免疫荧光分析结果
大鼠股骨组织冷冻切片CD31 的免疫荧光结果见图5,与假手术组比较,模型组CD31 荧光数目明显减少,冲剂组和阳性对照组荧光数目减少,但明显多于模型组。
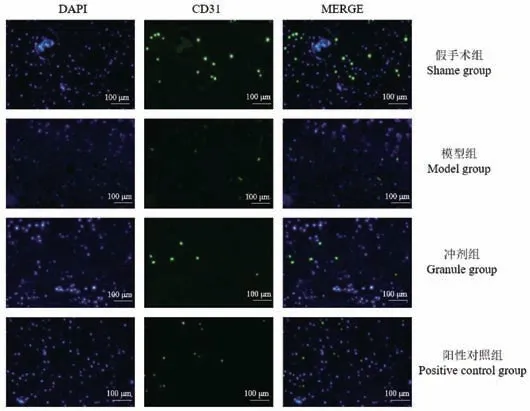
图5 4 组大鼠股骨组织中CD31 和DAPI 的免疫荧光结果Figure 5 Immunofluorescence results of CD31 and DAPI in the femur tissues among four groups rats
2.6 4 组大鼠血清VEGF 和HIF-1α 含量比较
4 组大鼠血清VEGF 和HIF-1α 浓度比较见图6,模型组大鼠血清VEGF 与HIF-1α 浓度较假手术组明显降低,冲剂组和阳性对照组与假手术组差异不显著,较模型组浓度明显升高,差异有统计学意义(P<0.05)。

注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05。
2.7 p-p50/p50 和p-p65/p65 蛋白表达情况比较
与假手术组比,模型组p-p50/p50 和p-p65/p65蛋白表达比值上升,冲剂组和阳性对照组蛋白表达比值上升不明显;与模型组比,冲剂组和阳性对照组蛋白表达比值明显下降表达水平明显上升,差异具有统计学意义(P<0.05),4 组大鼠股骨组织Western blot 电泳图和蛋白表达量比较结果见图7。
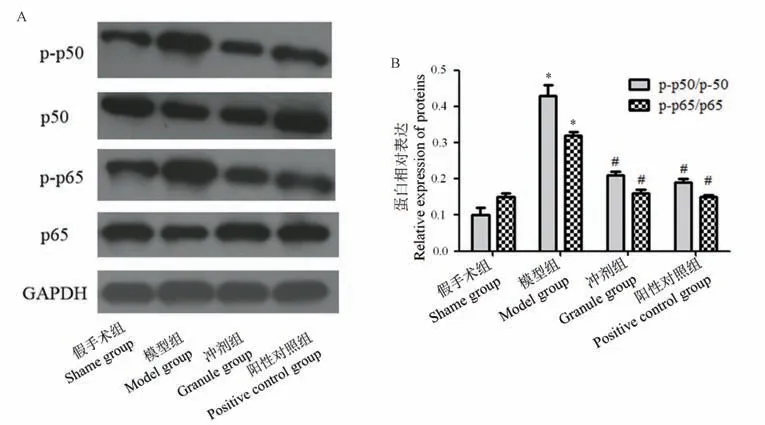
注:A:四组大鼠p-p50/p50 和p-p65/p65 凝胶电泳图;B:4 组大鼠p-p50/p50 和p-p65/p65 蛋白表达水平定量比较。 与假手术组相比,*P<0.05;与模型组相比,#P<0.05。
3 讨论
PMOP 发病率在绝经女性中高达40%,BMD 下降速度为绝经前的3 倍,骨折风险随之增加,严重影响女性身心健康和生活[10]。 OP 是多阶段的复杂氧化应激过程,对体内细胞有毒性作用,会引起内皮细胞受损或者细胞坏死,OP 的发生受到多个因素的影响[11]。 PMOP 的发生可能与绝经女性体内雌激素水平显著下降有关[12],部分研究者认为OP 的发生与骨组织微血管减少有关[13],目前关于骨质疏松的发病机制并没有明确的结论。 机体内骨形成和骨吸收处于一个动态代谢过程,随着年龄增长,血管功能受损,成骨所需营养不足,骨形成速度低于骨吸收速度,骨质下降,骨量减少,出现骨质疏松的症状。 研究表明血管数目的减少加速了骨质疏松症状的发生和发展,促进局部血管生长对骨质疏松的症状有缓解作用[14]。 据已有实验研究报道,去势小鼠雌激素减少,骨代谢平衡遭到破坏,骨转换率增加,单位体积内骨组织量减少,骨质疏松小鼠骨组织内部血管明显少于对照组小鼠,再一次验证骨组织血管形成与骨质疏松有关[15]。 PMOP 在中医理论里属于“骨萎”,肾精渐衰,骨髓空虚,遂致骨质疏松[16]。 本研究通过切除双侧卵巢,构建骨质疏松大鼠模型,通过对4 组大鼠进行股骨BMD 测定和骨组织形态观察,可以说明卵巢去势大鼠构建OP模型成功,同时通过补肾化瘀冲剂和阿仑磷酸钠片治疗的大鼠,骨密度增加,骨小梁生长状况较好,说明补肾化瘀冲剂对骨质疏松症有治疗效果。 骨组织HE 染色结果和Micro-CT 扫描结果表明冲剂组用药治疗后,OP 大鼠血管形成状况好转,说明补肾益气化瘀方剂可能对骨质疏松群体的血管形成有促进作用。
骨组织血管状态可以为骨发育提供氧气、无机盐、激素等生长所需物质,并运送新陈代谢产物,对骨重建起到了重要作用[17]。 CD31 是血小板内皮细胞黏附分子,其抗原广泛分布于血管内皮细胞、血小板、巨噬细胞、淋巴细胞,主要参与血管形成、白细胞迁移等生理活动,可作为评估血管形成的标记分子[18]。 王亮等[19]通过对CD31 和EMCN 进行免疫荧光染色,对骨标本的H 型血管进行显像,来表现OP 小鼠H 型血管的变化。 HIF-1α 是氧依赖性调节蛋白,在低氧条件下,能转入核内,与HIF-1β 作用,激活体内的缺氧适应性反应[20]。 OP 导致血管受损,骨组织微血管减少,骨重建所需营养物质运送不足,形成骨组织的低氧环境。 缺氧条件下,骨组织中HIF-1α 能激活VEGF 表达,形成骨组织血管网络[21]。 VEGF 是重要的促进血管形成的细胞因子,能增加血管内皮细胞的通透性,并刺激血管内皮细胞的有丝分裂[22]。 一研究通过染料木黄酮干预治疗OP 大鼠,来比较干预组大鼠和模型组大鼠间VEGF 的表达差异,结果表明干预组大鼠血清和骨组织中VEGF 的表达均高于模型组,且BMD 值也高于模型组说明VEGF 的表达有助于OP 发生后骨重建过程[23]。 本研究对4 组大鼠的股骨组织进行CD31 免疫荧光染色和血清中VEGF、HIF-1α 的浓度测定,发现经过药物治疗,CD31 染色情况显示大鼠骨组织中血管形成情况优于未经治疗的OP 模型组大鼠,并且血清中HIF-1α 和VEGF 的含量较模型组大鼠也有明显升高,说明补肾化瘀冲剂可能通过调节机体的HIF-1α 和VEGF 的表达来影响血管形成。
NF-κB 在TLRs 的下游,受到TLRs 的调控,TLRs/NF-κB 信号通路参与机体细胞的增殖和分化及免疫反应等生理过程[24]。 杨明镜等[25]研究表明通过番茄红素预处理,细胞中NF-κB 表达下调,揭示了番茄红素对TLRs/NF-κB 信号通路的抑制,可能抑制机体的氧化应激反应,从而减轻细胞的缺氧损伤,说明TLRs/NF-κB 信号通路与机体的氧化应激反应有关。 阿仑磷酸钠通过诱导破骨细胞凋亡,能抑制骨吸收过程,已广泛应用于OP 的治疗中。已有研究报道,通过对OP 大鼠给予阿仑磷酸钠灌胃,发现给药大鼠BMD 值,血液中钙、磷、雌激素含量和骨小梁明显增加,而骨组织中p-p50/p50 和p-p65/p65的表达显著降低[26]。 说明阿仑磷酸钠片可抑制OP 大鼠骨组织中p-p50/p50 和p-p65/p65的表达,从而抑制NF-κB 信号通路,影响破骨细胞的形成。 研究表明NF-κB 对HIF-1α 的表达具有调控作用,但作用机制较为复杂,在不同条件下,NFκB 对HIF-1 的表达具有正向或负向调控的作用。缺氧条件下,抑制NF-κB,会激活HIF-1α 的表达[27]。 本研究采用阿仑磷酸钠片灌胃给药的大鼠作为阳性对照,对4 组大鼠骨组织中p-p50/p50 和p-p65/p65 的表达水平进行分析,发现冲剂组和阳性对照组大鼠p-p50/p50 和p-p65/p65 的表达量低于模型组大鼠,说明在治疗过程中,冲剂组大鼠骨组织中NF-κB 通路可能受到抑制。 而冲剂组大鼠血清中HIF-1α 和VEGF 的含量高于模型组大鼠,说明抑制NF-κB 通路,可能对HIF-1α 具有正向调控的作用。 补肾化瘀冲剂影响TLRs/NF-κB 通路,进而调控HIF-1α 和VEGF 表达的具体机制仍需进一步的分子实验研究。
综上所述,补肾益气化瘀冲剂可能通过调控TLRs/NF-κB 通路,对卵巢去势大鼠血管形成起到了促进作用,有助于骨质疏松症的缓解。

