尿液HPV检测在宫颈癌筛查中的临床应用价值
宋金维,王建东
(1.首都医科大学附属北京妇产医院/北京妇幼保健院妇瘤科,北京 100026; 2.北京市西城区妇幼保健院妇产科,北京 100054)
根据2018年全球统计数据显示,全世界每年有超过32万的女性死于宫颈癌,其中85%的死亡病例发生在发展中国家[1]。高危型人乳头瘤病毒(human papillomavirus,HPV)的持续感染已被流行病学和生物学证明是引起宫颈癌及癌前病变的必要因素[2],但一定比例的女性由于主观或客观原因错过早期诊断机会,因此选择一个舒适性更强、更简便的、可以由患者自行采样的检查方式可以提高宫颈癌前病变的诊断率,避免患者的不良预后[3]。感染HPV的子宫颈上皮细胞脱落后随着宫颈分泌物进入阴道内,这些分泌物积聚在阴道口和小阴唇附近,当患者排尿时,尿液会将这些上皮细胞冲走,因此尿液中可以检测出HPV DNA[4]。多项研究显示,尿液标本与宫颈标本检测结果有相当的一致性[5-6],且具有非侵入性、无创伤性、方便易行等优点,在不方便进行宫颈侵入性筛查方面显现出绝对的优势[7-9]。本研究旨在通过对符合条件的患者留取初段晨尿标本,在阴道镜检查前取宫颈脱落细胞标本,分别进行HPV分型检测,探讨尿液HPV检测在宫颈癌筛查中的临床应用价值,为宫颈癌的筛查提供新思路。
1 资料与方法
1.1一般资料 选择2017年12月1日至2018年3月31日在首都医科大学附属北京妇产医院就诊的498例患者的尿液标本及宫颈脱落细胞标本。纳入标准:①年龄20~60岁;②具有完整子宫;③异常或不确定的宫颈癌筛查结果[宫颈细胞学异常和(或)宫颈HPV高危型阳性]或症状、体征提示宫颈癌可疑或不明原因的阴道异常出血、排液等需要进一步阴道镜检查。排除标准:①有临床妊娠的可疑症状;②有泌尿系统肿瘤;③子宫切除史;④宫颈外科手术史;⑤盆腔放疗史;⑥相关数据缺乏;⑦拒绝参与或拒绝签署留取相关标本知情同意书。本研究经首都医科大学附属北京妇产医院医学伦理委员会批准(伦理批准号:2017-KY-042-01),患者均签署了知情同意书。
1.2方法
1.2.1尿液标本HPV DNA提取 ①尿液的留取:在72 h内无性生活、无阴道出血、无阴道冲洗和阴道上药前提下,于阴道镜检查当日患者自取初段晨尿约10 ml置于尿液自取装置的管中(管内有固定液)送检。②尿液的保存:尿液+缓冲液,混匀,过滤,20 min离心浓缩,同一患者尿液分为3份,分别室温、4 ℃和-20 ℃保存。随机抽取3例患者,共9份标本先采用离心柱法提取尿液中的HPV DNA,然后进行检测,结果显示3例患者9份尿液标本的合格率为100%,均成功完成检测,室温、4 ℃和-20 ℃保存的标本检测结果无差异。实验采用4 ℃保存,长期保存则放入-20 ℃。③尿液HPV DNA提取:尿液标本离心,去上清,加入蛋白酶K,混匀;加入细胞裂解液,震荡混匀,15~20 min,期间颠倒混匀数次,温浴后加入异丙醇充分混匀,转入带硅胶柱的离心管中,9 500×g离心1 min,弃液;重复离心;更换离心管,放入吸附柱,静置1~2 min,吸附柱中加入洗脱缓冲液洗脱,静置2~5 min,11 500×g离心2 min,弃柱得HPV DNA。
1.2.2宫颈标本HPV DNA提取 ①宫颈标本采集及保存:阴道镜医师使用一次性宫颈脱落细胞采集器置于宫颈口,顺时针旋转3~5圈,将宫颈脱落细胞固定于标本管内,做好标识并送检。如不能立刻送检标本,则4 ℃保存,并于2周内进行检测。剩余标本于-20 ℃保存液中保存备查,保存期为6个月。冻融次数不超过7次,标本运送采用低温保存运输。②宫颈HPV DNA提取:宫颈标本离心,弃上清液,加入细胞保存液重悬细胞,16 100×g离心1 min,弃上清液;加入细胞裂解液,充分振荡重悬细胞,煮沸10 min,16 100×g离心10 min,保留上清液备用(上清液中为释放的HPV DNA)。
1.2.3宫颈及尿液HPV分型检测 将提取到的HPV DNA采用广东凯普生物有限公司提供的聚合酶链反应扩增技术(聚合酶链反应混合液+DNA聚合酶+DNA)完成所有标本的23种HPV分型(16、18、31、33、35、39、45、51、52、56、58、59、66、68、53、73、82、6、11、42、43、44、81)检测。
1.3统计学方法 采用SPSS 21.0统计软件进行数据分析,计数资料用例(%)表示,以宫颈HPV为标准,计算尿液HPV检测的灵敏度、特异度及其95%CI,尿液和宫颈HPV检测采用Kappa分析[10]行一致性检验,Kappa<0,代表一致性极差,Kappa 0~0.20,代表一致性微弱;Kappa 0.21~0.40,代表一致性弱;Kappa 0.41~0.60,代表一致性中等;Kappa 0.61~0.80,代表一致性强;Kappa 0.81~1.00,代表一致性极强。P<0.05为差异有统计学意义。
2 结 果
2.1不同型别HPV在尿液和宫颈标本中的阳性分布 配对收集合格的498例尿液和宫颈标本用于分析,宫颈标本中HPV阳性率为83.73%(417/498),尿液标本中HPV的阳性率为79.12%(394/498)。在23种HPV分型检测(16、18 、31、33、35、39、45、51、52、56、58、59、66、68、53、73、82、6、11、42、43、 44、81)中,宫颈和尿液标本中检测到的前3位常见类型分别是HPV16、HPV58、HPV52;高致病性HPV18型在宫颈和尿液标本中的阳性率分别为8.43%(42/498)和8.03%(40/498)。不同型别HPV在尿液和宫颈标本中的阳性分布见表1。
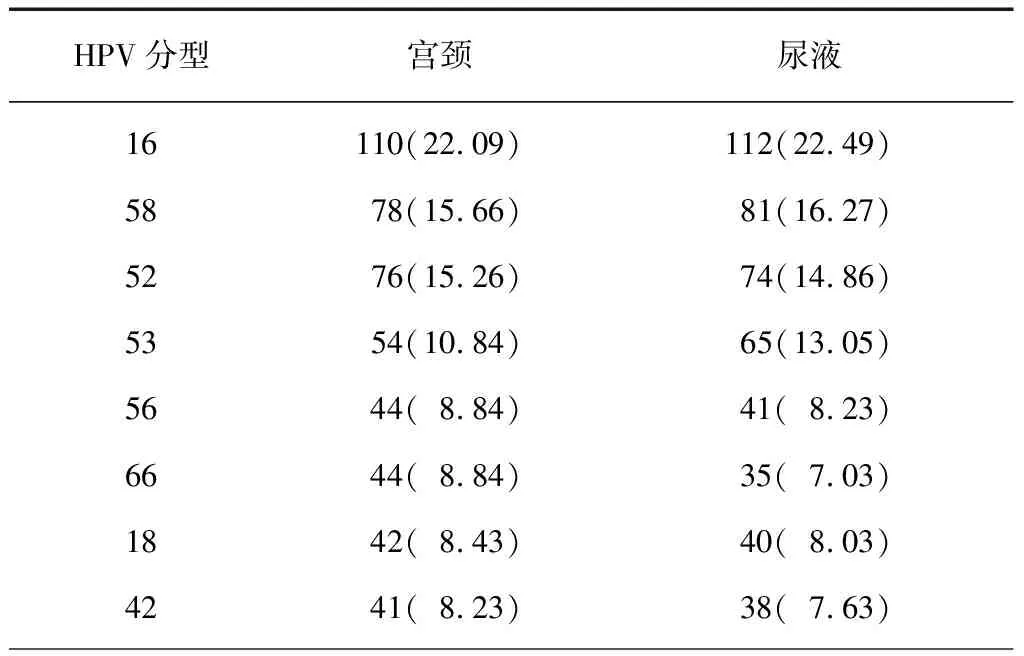
表1 不同型别HPV在498例尿液和宫颈标本中的阳性分布 [例(%)]
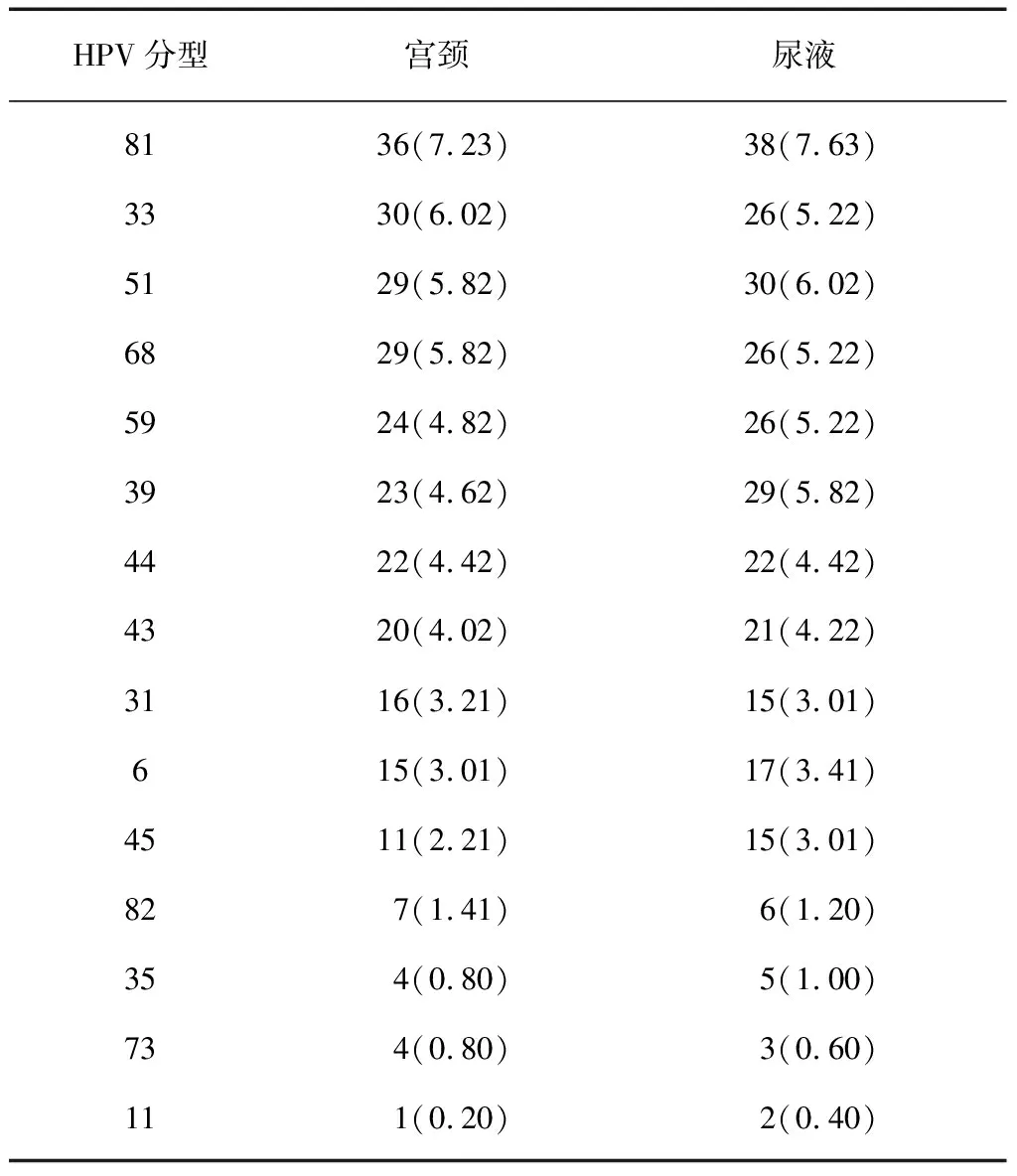
续表1
2.2尿液与宫颈HPV(9个型别)检测的一致性比较 以宫颈HPV分型为标准,选择与HPV九价疫苗相对应的9个型别(6、11、16、18、31、33、45、52、58)分析尿液与宫颈标本的一致性及尿液HPV的灵敏度和特异度。498例阴道镜患者尿液标本的合格率为100%。在9个HPV型别中,尿液HPV检测的灵敏度为68.75%~100.00%,特异度为96.13%~99.80%,一致性Kappa值为0.666~0.858,差异有统计学意义(P<0.001)。HPV6、11、31、33、45、52型的Kappa值为0.666~0.770,一致性强;HPV16、18、58型的Kappa值为0.838~0.858,一致性极强;差异均有统计学意义(均P<0.001)。见表2。
3 讨 论
宫颈癌病因学的肯定使HPV检测在全世界得到了广泛推广应用。目前高危型HPV的检测方法基本均为侵入性,该方法存在以下问题:许多女性认为侵入性妇科检查不舒服甚至疼痛、令人难堪,故依从性差;交通不便、工作繁忙、医院检测程序烦琐也使得部分女性未参与检测;对宫颈癌筛查的意识不足、缺乏健康教育和普查知识也使得大部分人群不参加检测[11]。这些严重降低了女性HPV筛查的

表2 尿液与宫颈HPV(9个型别)检测的一致性比较
依从性,尤其是接种疫苗后的青少年、妊娠妇女、受宗教文化和信仰影响的女性。因此,研究一种取样方便、依从性好、灵敏度高、特异度佳的HPV检测方法成为子宫颈癌防治研究中的热点与难点。
国外一项荟萃分析显示,与宫颈HPV检测相比,尿液HPV检测的灵敏度和特异度分别为87%和94%[12]。本研究中尿液HPV检测的灵敏度为68.75%~100%,特异度为96.13%~99.80%,其中尿液HPV11、16、45、58型的灵敏度与上述研究相当,HPV18、31、33、52、6型的灵敏度均略低于上述研究。本研究对于高致病性的HPV16型和18型,尿液的灵敏度分别为88.18%和83.33%,特异度分别为96.13%和98.90%,Kappa值分别为0.838和0.841(P<0.001),提示尿液HPV有较好的灵敏度和特异度。使用初段晨尿标本而不是随机或中段尿标本,以及在标本采集和HPV DNA检测中采取一些预防措施可大大提高灵敏度[13]。
巴西的一项横断面研究中,通过从妊娠的妇女中自行收集尿液和阴道标本,对高危型HPV(16、18、31、33、39、45、59)进行检测,尿液和阴道标本的HPV DNA检测结果基本一致(P<0.000 1)[14],表明尿液可能是孕妇HPV检测的可靠标本。本研究中HPV6、11、31、33、45、52型的Kappa值为0.666~0.770(P<0.001),与上述研究相当;其余3个分型(16、18、58)的Kappa值均大于0.810,最高为0.858(P<0.001),其一致性高于上述研究。尿液HPV检测具有非侵入性、取样方便等特点,使得妊娠期妇女有更高的HPV筛查依从性。一项研究表明,人类免疫缺陷病毒感染的女性由于免疫抑制等导致HPV感染率增加,从而导致发展为宫颈癌的风险增加[15]。Ferenczy等[16]报道,人类免疫缺陷病毒阳性的女性留取尿液行HPV检测,并与宫颈标本配对比较,发现HPV感染的一致性为73.6%。Munoz等[17]对人类免疫缺陷病毒感染的妇女使用自我采集的尿液标本与宫颈标本进行检测,结果显示HPV的灵敏度为68.8%,特异度为50.0%。由此可见,在宫颈癌控制和预防项目中,如何提高覆盖率、采样率、依从性和随访率,特别是那些呈现某种免疫抑制类型的妇女起着决定性的作用。自我采样方法(如尿液采样)因诊断性能良好且女性的接受度高,可作为预防病理学的有效方式。
Vorsters等[18]对注射HPV疫苗后女性的尿液标本和血清标本中HPV抗体滴度进行比较,结果显示尿液中IgA和IgG含量约是血清中的0.15%和0.35%,与未注射疫苗的女性相比,注射疫苗的女性HPV16、6、11、18型的抗体含量显著增加,提示疫苗可增加尿液中的抗体,可以考虑使用尿液进行HPV疫苗效果评价。本研究中,尿液标本中HPV16、58、53、81、51、59、39、43、6、45、35、11型的阳性率均高于宫颈标本,HPV44型的尿液和宫颈标本阳性率相等,均为4.42%。从长期来看,高敏感性的尿液HPV检测可能会促进高覆盖率的HPV疫苗接种计划[19]。我国人群的HPV感染统计数据基本都是源于医院就诊和体检,缺少基于社区人群的有代表性的全国性数据。HPV感染除可导致宫颈癌外,还可引起外阴癌、阴道癌、阴茎癌、肛门癌、喉癌、口腔癌和口咽癌等,目前国内流行病学方面此类研究较少。因此,我国人群HPV感染的全国性数据、疾病负担、流行病学等研究需进一步规范化、系统化开展[20]。一项研究分析显示,以预防宫颈癌为价值标准,液基薄层细胞学检查联合HPV高危分型筛查效果最好[21],HPV高危分型筛查成本效果最优。筛查人群的接受度和依从性变化影响筛查方案的成本效果,且初筛接受率和阴道镜转诊率的变化将影响结果排序。因此,提高人群的依从性和接受度,有利于完善我国宫颈癌防控体系,从而有效提高宫颈癌的防治效果。
有文献研究显示,自收集尿液进行HPV检测是监测HPV流行状况和女性HPV疫苗接种效果的宫颈取样的一种潜在替代方法。尿液HPV检测可能弥补宫颈HPV检测和细胞学检查的不足[22]。但是尿液采样、储存条件、DNA提取和DNA扩增检测均可能对HPV DNA检测和检测到的病毒DNA形式产生重要影响,从而导致在各研究中尿液HPV检测的灵敏度和特异度有较大差异。
综上所述,尿液HPV与宫颈HPV检测对宫颈癌筛查有较好的一致性,适用于不具备侵入性宫颈HPV检测的宫颈癌早期筛查及HPV疫苗接种后的效果评价,可有效地预防和减少女性宫颈癌的发生,从而保证广大妇女的身体健康。

