基于量子点标记技术的免疫层析法检测新型冠状病毒N蛋白IgG抗体研究
于仁峰,邹小仓,邹大阳,李琳昊,王可慧,贺晓明,徐雅晴,秦日辉,莫冬冬,段佳慧,余涛*,刘威*,郭金鹏*
目前,对于由新型冠状病毒(SARS-CoV-2)引起的新型冠状病毒肺炎(COVID-19)没有特效治疗方法,早发现、早报告、早检测、早隔离是疫情防控的重要手段[1]。SARS-CoV-2 属于β-冠状病毒簇,是一种具有外膜的正链单股RNA 病毒,其基因组可编码 RNA聚合酶、刺突 (S) 糖蛋白、膜 (M) 糖蛋白、包膜(E) 糖蛋白和核衣壳(N)蛋白[2]。其中N蛋白不仅将病毒RNA和蛋白质包装成病毒体,还能促进病毒RNA的转录和复制,并损害宿主细胞的免疫反应,是一种高免疫原性且在感染过程中大量表达的蛋白,目前关于SARS-CoV-2 N蛋白的报道相对较少,迫切需要对SARS-CoV-2 N蛋白的更新认识[3-5]。同时,N蛋白相对保守,在病毒的结构蛋白中所占比例最大,感染早期机体能产生抗N蛋白的高水平抗体[6]。另外一个重要的蛋白是S蛋白,其可以介导SARS-CoV-2进入宿主细胞。研究显示,中和抗体主要通过与S1亚基上的受体结合域(receptor binding domain,RBD)片段结合进而竞争性地阻断S蛋白与血管紧张素转换酶-2(ACE2)的结合,因此,SARS-CoV-2的S1蛋白是抗病毒中和抗体的重要靶点[7],能够诱导机体产生中和抗体,是研究疫苗的常用抗原[8]。检测血清中SARS-CoV-2抗体不仅简单、快速,而且能区分急性感染和既往感染,更适合基层医院使用。冠状病毒基因组所编码的抗原中,N 蛋白具有较高的免疫原性,可在早期感染时分泌到体液中,作为抗原检测的生物标志物,同时机体产生抗N蛋白抗体可被用于检测SARS-CoV-2感染[9]。本研究建立了SARS-CoV-2抗N 蛋白IgG抗体荧光免疫层析方法,具有检测时间短、方法简便的优点,同时可使用免疫荧光检测仪读取硝酸纤维素(NC)膜质控线(C线)、检测线(T线)荧光值,使灵敏度更高,更客观可靠,可用于检测人血清、血浆、指尖血样本中的抗SARSCoV-2 N蛋白IgG抗体。制备的免疫层析检测试纸条,可辅助临床判断被检者是否感染SARS-CoV-2以及体内是否产生抗体,对疾病流行筛查及评估均具有较大意义。
1 材料与方法
1.1 材料来源 50例健康人血清(阴性样本,本课题研究始于2020年8月,期间解放军疾病预防控制中心采集注射腺病毒疫苗的健康人血清)及COVID-19患者阳性灭活血清(阳性样本,来源于解放军疾病预防控制中心2020年3月随机采集于武汉火神山医院的阳性血清样本)。
1.2 试剂与仪器 量子点微球(QDS)(上海迈瑞尔科技有限公司、昆道公司、BRAVEOS以及ACMES)、鼠抗人IgG抗体(北京索莱宝公司)、硝酸纤维素膜(NC膜)(WATMAN)、玻璃微纤维(样品垫)(上海金标公司)、聚脂纤维(结合垫)(上海金标公司)、吸水垫(上海金标公司)、N蛋白IgG抗体检测ELISA试剂盒(北京科卫科技有限公司),SARS-CoV-2抗N蛋白IgG抗体标准品85.3 μg/g,中国计量科学研究院,编号:GBW(E)091110)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺 (EDC)、NHS(麦克林公司)、荧光检测仪(北京弘进久安生物科技有限公司)、旋转蒸发仪(大龙公司)、喷金划膜仪(上海金标公司)、斩切机(上海金标公司)、玻璃仪器(欣维尔公司)。
1.3 实验原理 将N蛋白抗体和鼠抗人IgG抗体分别包被到NC膜C线、T线对应区域,将偶联了量子点的N蛋白抗原喷涂到已处理好的玻纤垫上;若待测血清中含有N蛋白抗体,在层析的过程中,与玻纤垫上的量子点标记N蛋白抗原特异度结合,形成抗原-抗体复合物继续向上层析,并与NC膜T线区域包被的鼠抗人IgG抗体结合,使T线位置受激发光激发显示出红色条带,而未与血清中抗体结合的量子点标记N蛋白抗原则继续向前层析,与C线包被的N蛋白抗体结合,使C线位置受激发光激发显示出红色条带(阳性);若待测血清中无N蛋白IgG抗体则量子点标记抗原无法与T线包被的鼠抗人IgG结合,直接向上层析,与C线包被的抗N蛋白IgG抗体结合,C线位置受激发光激发显示出红色条带,而在T线位置无显色条带(阴性)。
1.4 实验方法
1.4.1 SARS-CoV-2 重组N 蛋白抗原的制备 核酸序列来自GenBank,序列号:QQL14119.1,氨基酸1-194;将序列送至测序公司进行合成,然后酶切连接至pET28a载体中。将连接成功、测序正确的载体命名为pET28a-COV_N,将质粒转化至BL21大肠埃希菌中,待细菌生长至波长为600的吸光度(OD值)为 0.06时,加入0.05 mmol/L IPTG,在16 ℃条件下进行诱导表达8 h。4 000 r/min,30 min收集菌体,加入裂解缓冲液,重悬菌体至无颗粒状,置冰上,超声破碎。18 000 r/min,30 min离心,收集上清。超声上清经过0.45 μm针孔过滤器进行过滤,用5倍柱体积裂解缓冲液平衡填料。将处理好的上清与平衡好的Ni柱4 ℃结合1.5 h,后转入重力柱内。连接恒流泵和蛋白检测仪,观察峰图收集流穿。用洗脱缓冲液对填料进行目的蛋白洗脱,分5~8次,每次1倍柱体积洗脱缓冲液进行目的蛋白洗脱。收集每次洗脱液,进行电泳鉴定。
1.4.2 重组N 蛋白抗原的ELISA试剂盒验证 将初始浓度为2 mg/ml的SARS-CoV-2重组N蛋白用coating缓冲液稀释至1μg/ml,用以制作蛋白工作液。设置10孔(试剂盒的阳性标准品稀释10倍、20倍、30倍、40倍、阴性对照,每浓度梯度设2个平行),用上述制备好的工作液与ELISA试剂盒作对比,参照物为试剂盒内自带N蛋白包被的板孔,设定12孔(阳性标准品稀释10倍、20倍、30倍、40倍、阴性对照、空白,每浓度梯度设2个平行);实验方法参照试剂盒说明书,450 nm波长下测定OD值。
1.4.3 量子点检测试纸条的制备及优化
1.4.3.1 试纸条的制备 用相应的处理液分别浸泡金标垫、样品垫后烘干,然后将其分别裁成尺寸适宜的小条,装入干燥剂并将袋口封紧备用;EDC/NHS法活化量子点微球,用PBS(pH值6.0)反应缓冲液稀释SARSCoV-2 N蛋白抗原,然后将活化后的量子点微球迅速加入SARS-CoV-2 N蛋白中,混匀37 ℃孵育1 h;4 ℃,14 000 r/min离心15 min,去上清;加封闭液(1% BSA溶液)200 μl,充分超声分散,孵育2 h;根据比例稀释后,进行喷金,喷量参数为2.5 μl/cm。取出NC膜,剪成300 mm/条,平整贴在PVC背板上,室温放置30~60 min。将N蛋白IgG抗体(0.5 mg/ml)及鼠抗人IgG(0.5 mg/ml)利用喷金划膜仪划线(操作流程参考《三维划膜喷金仪操作流程》),划好的NC膜置于干燥箱中烘干。将干燥的吸水纸裁成31.5 mm×300 mm每条,贴在背板长端,在NC膜下端贴上金垫与样品垫,两端均压NC膜1 mm,切成3.88 mm宽的试纸条,备用。
1.4.3.2 量子点微球的筛选 选取迈瑞尔、昆道、BRAVEOS、ACMES四家公司生产量子点,记作1号、2号、3号、4号,静置10 min后1号量子点出现明显沉淀(图1)。
按照1.4.3.1标记量子点的方法分别用4种量子点标记SARS-CoV-2N蛋白抗原,并制成试纸条;向每个试纸条结合垫分别滴加1.2 μl 5倍稀释后的量子点标记抗原溶液,用阳性标准品进行检测,得出T、C线荧光值,每种实验条件设置6个平行,计算其T线荧光值平均值。
1.4.3.3 最适检测时间的确定 为了确定量子点试纸条的最佳检测时间,取同一试纸条检测阳性血清标准品,每隔30 s测一次信号,记录数据,绘制曲线。
1.5 观察指标
1.5.1 阴、阳性血清检测对比 应用制备好的试纸条检测阴、阳性标准血清(ELISA试剂盒提供),加样10 min后用荧光检测仪检测荧光值,并置于紫外光灯下观察。
1.5.2 确定检测阈值(临界值) 取阴性样本血清,测其T、C线荧光值,计算T/C线荧光比值(FIT/FIC值),利用SPSS(统计产品与服务解决方案)软件推算其中离群样本,去除离群值,利用SPSS软件对其余数据进行探索性检验分析,确定此组数据是否为正态分布,确定临界值。
1.5.3 试纸条灵敏度与重复性验证 利用SARS-CoV-2抗N蛋白IgG抗体〔85.3μg/g,中国计量科学研究院,编号:GBW(E)091110〕来验证试纸条的灵敏度。将抗 N 蛋白IgG单克隆抗体标准品依次稀释为1∶500、1∶1 000、1∶2 000、1∶5 000、1∶10 000,每个稀释倍数3个重复,取同一批次制作的试纸条检测不同浓度结果取均值。另抽取制备的3 批次试剂卡,检测1∶500、1∶2 000、1∶5 000的N 蛋白IgG抗体标准品,每个浓度平行检测5次,测其T、C线荧光值,计算FIT/FIC均值。
1.5.4 特异度验证 选取季节性冠状病毒229E(HD15OC2014)、NL63(HD15DE0922)、HKU1(HD15JA0702)、OC43(HD15JA0704)4种分型的N蛋白IgG抗体(均购自义翘神州公司)及支原体P1蛋白、呼吸道合胞病毒F0蛋白、麻疹病毒N蛋白和风疹病毒E1蛋白IgG抗体(睿信生物科技公司)验证试纸条的特异度。每种样本检测3次,测其T、C线荧光值,计算FIT/FIC均值。
1.5.5 方法学比较 随机抽取本实验制备的85个试纸条与SARS-CoV-2抗体检测ELISA试剂盒(北京科卫临床诊断试剂有限公司)同时对35份SARS-CoV-2患者血清(血清由解放军疾病预防控制中心提供)和50例正常人血清进行检测比较,同时对样本核酸检测结果(临床确诊)进行三方比较(PCR核酸检测、ELISA法、免疫层析试纸条)。
1.5.6 稳定性实验 随机抽取同批次90条检测试纸条,置于60.1℃烘箱中烘烤。依据阿伦尼乌斯公式设计实验,由其附表温度与老化天数关系表可知,37 ℃环境下保存91 d相当于常温(25 ℃)下1年的稳定性,等同于60.1 ℃环境下保存9.3 d。因此,60.1 ℃需要测试的时间间隔为第0天、第1天、第2天、第4天、第8天(约为25 ℃0 d、40 d、80 d、160 d、320 d)。每批次取出18条试纸条,测量标准品抗体稀释1∶500、1∶2 000、1∶5 000 三种浓度及三个阴性血清1#、2#、3#,每个样本设3个平行,计算其FIT/FIC均值。
1.5.7 测定标准曲线 根据确定好的实验条件制作试纸条,利用SARS-CoV-2N蛋白IgG抗体标准品(中国计量科学研究院,编号:GBW(E)091110)稀释不同浓度,测量其T、C线荧光值,绘制散点图,推导标准曲线。
1.6 统计学方法 利用SPSS(统计产品与服务解决方案)统计分析采集的阴性样本检测数据,绘制散点图,推算出其中离群值,去除离群值对其余数据进行探索性分析,判断此数据是否符合正态分布。计算第95百分位点,确定临界值。以P<0.05为差异有统计学意义。
2 结果
2.1 N 蛋白制备、纯化及验证结果 图2a峰图显示250 mmol/L咪唑洗脱时有蛋白峰出现,SDS-PAGE电泳图显示IPTG诱导后有分子量约为21 kDa的目的蛋白表达,250 mmol/L咪唑洗脱后目的条带单一,蛋白量多,杂带较少(图3b)。将纯化的N蛋白与试剂盒中N蛋白进行对比验证结果显示:横坐标为阳性标准品稀释不同浓度(10倍、20倍、30倍、40倍)后样本、阴性标准品及空白孔,纵坐标为OD值(450 nm波长下吸光度),自制的N蛋白抗原包板与抗体结合,而且所测得阳性标准品结果(OD值)均在14.5以上,比ELISA试剂盒中原N蛋白抗原包板检测结果(OD值最高8.2)效果明显,说明纯化的N蛋白满足抗原抗体结合要求,可以应用于免疫层析法检测的建立。见图3。

图2 蛋白洗脱峰和SDS-PAGE 电泳图Figure 2 Protein elution peak and SDS-PAGE electropherogram
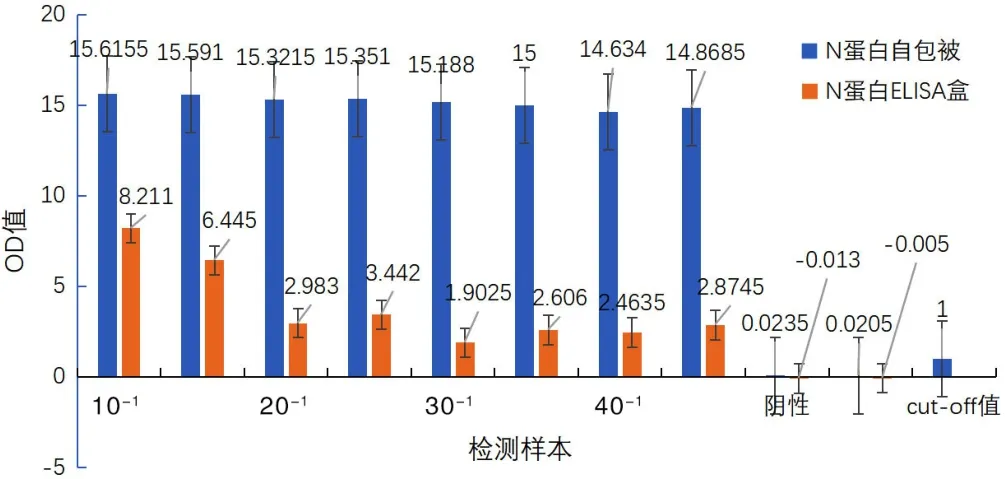
图3 N蛋白ELISA试剂盒验证结果图Figure 3 Validation results of N protein ELISA kit
2.2 量子点的筛选结果 用4种量子点标记N蛋白抗原,分别制作试纸条,检测标定阳性血清,得出T、C线荧光值,对比T线荧光值大小,筛选最优量子点,相同条件下,4种不同量子点标记的抗原试纸条C线及T线的数值呈现差异,1号量子点微球及3号量子点微球的T线荧光值较高(4 424、4 665),说明这两种量子点的偶联效率比较高。从经济适用效果方面考虑,最终确定3号量子点(BRAVEOS公司)作为后续实验材料。见图4。
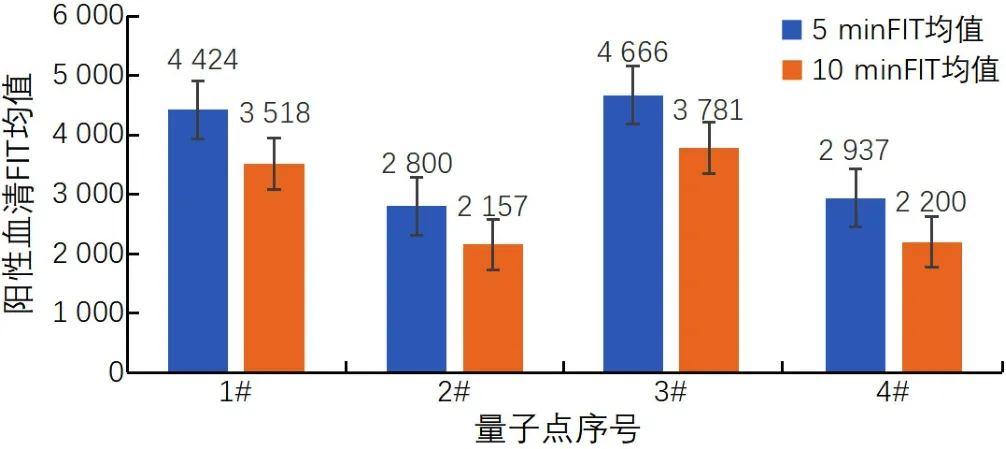
图 4 量子点筛选数据图Figure 4 Data graph of quantum dots selecting
2.3 最适检测时间的确定 加样后8~10 min T线荧光值达到最高并趋于稳定,由此将10 min作为反应最佳时间。用试纸条检测阳性血清标准品确定最佳检测时间,见图5。
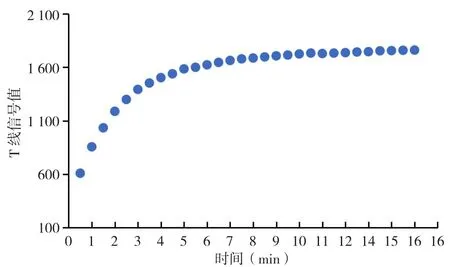
图 5 T值随时间变化曲线图Figure 5 Curve of T value changing with time
2.4 阴、阳性样本血清检测对比 检测阴阳性血清标准品,荧光检测仪软件图显示:阴性标准品T线位置无荧光波峰,C线位置出现荧光波峰;而阳性标准品T、C线位置均出现波峰;紫外灯下可见阳性血清T线、C线均出现红色荧光带,阴性血清C线出现红色荧光带、T线未出现条带,见图6。

图 6 阴、阳性样本血清检测图Figure 6 Positive and negative serum test graph
2.5 确定检测阈值(临界值) 分析采集的阴性血清数据,样本检测结果FIT/FIC值相对集中,个别数值差别较大(图7)。利用SPSS(统计产品与服务解决方案)软件推算其中离群样本,得出箱图显示:4号、7号为极端离群值,41号、43号、51号为离群值,去除此5个样本,见图8。利用SPSS(统计产品与服务解决方案)对其余数据进行探索性检验分析,得出P=0.027,可以认为该数据不服从正态分布,见图9。因此应用第95百分位数法确定其临界值范围为0.062,因健康人SARS-CoV-2 N蛋白IgG抗体值偏高为异常,因此选择百分位数法计算的上侧界值作为第95百分位数,为0.062,即此试纸条N蛋白IgG抗体检测FIT/FIC临界值为0.062[10]。即经过荧光检测仪测定,最终得出样本FIT/FIC值≥0.062可判定为阳性,<0.062为阴性。

图 7 样本T/C值散点图Figure 7 Sample T/C value scatter plot

图 8 阴性样本FIT/FIC值箱图Figure 8 Box graph of samples' FIT/FIC values
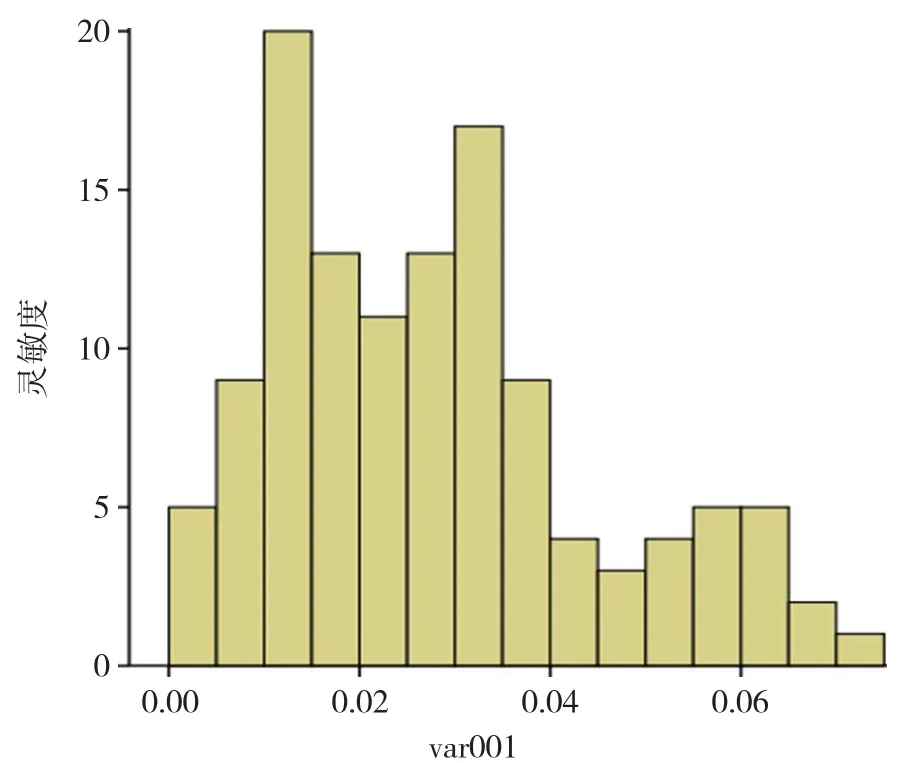
图 9 排除5例离群值样本后阴性样本FIT/FIC值正态性检验直方图Figure 9 Histogram of samples' FIT/FIC values for normality test
2.6 试纸条灵敏度与重复性验证 利用SARS-CoV-2抗N蛋白IgG抗体来验证试纸条的灵敏度。结果显示:1∶500~1∶5 000 的标准品为阳性,1∶10 000 则为阴性。标准品为85.3 μg/g,稀释10 000倍为8.53 ng/g,稀释5 000倍为17.06 ng/g,故该方法的灵敏度为8.53~17.06 ng/g的SARS-CoV-2N 蛋白IgG单克隆抗体,见图10。另抽取制备的3 批次试剂卡,检测1∶500、1∶2 000、1∶5 000 的N 蛋白IgG抗体标准品,每个浓度平行检测5次,进行重复性验证,各浓度标准品均得出阳性结果,且T、C线荧光值(FIT/FIC值)的变异系数(CV)≤10%,可见所研制试纸条重复性良好,见表1。

表1 重复性实验测量表Table 1 Repeatability experiment test scale

图10 灵敏度实验测量数据图Figure 10 Measurement data graph of sensitivity experiment
2.7 特异度验证 选取季节性冠状病毒四种分型的IgG抗体(均购自义翘神州公司)及支原体P1蛋白、呼吸道合胞病毒F0蛋白、麻疹病毒N蛋白和风疹病毒E1蛋白IgG抗体验证试纸条的特异度,此批次试纸条检测以上8种病原IgG抗体,其FIT/FIC值均小于临界值0.062,结果均呈阴性,说明试纸条特异度良好。见表2。

表2 特异度实验测量表Table 2 Specificity experiment test scale
2.8 方法学比较 利用本实验制备的试纸条与SARSCoV-2抗体检测ELISA试剂盒(北京科卫)同时对血清样本进行检测比较,同时样本核酸检测结果(临床确诊)进行三方比较(核酸检测、ELISA法检测、免疫层析试纸条),结果显示:ELISA检测法与免疫层析试纸条检测法阳性符合率为94.12%,阴性符合率为98.04%,总体符合率为96.47%。本研究建立的免疫层析法检测试纸条检测SARS-CoV-2 N蛋白IgG抗体的灵敏度为94.29%(32/35),特异度为100.00%(50/50),检测性能良好。见表 3。

表3 N蛋白抗体试纸条、ELISA试剂盒与核酸检测方法学对比结果Table 3 Comparison results of N protein antibody strip、ELISA kit and nucleic acid detection methods
2.9 稳定性实验 随机抽取同批次90条检测试纸条进行稳定性实验,推测保存时间,结果显示:60.1 ℃下保存4 d(160 d,25 ℃)的试纸条检测效能减弱,仅能测出1∶500高浓度抗体标准品,且实验数据显示C线荧光值偏低,由此推测本研究试纸条保存时限约为常温环境中160 d。见图11。

图11 稳定性实验检测数据图Figure 11 Data graph of stability experiment test
2.10 测定标准曲线 利用SARS-CoV-2 N蛋白IgG抗体标准品作为阳性标准品推导标准曲线,结果显示,以FIT/FIC均值为纵坐标,样本中抗体浓度为横坐标做坐标图,得出相关曲线 y=0.039 9x+3.052 4(R2=0.981),利用荧光检测仪测出FIT/FIC值即可在一定范围内初步定量检测。见图12。

图 12 标准曲线图Figure 12 Standard curve graph
3 讨论
免疫层析技术是一种将抗原抗体特异度反应与色谱层析技术相结合的新型膜检测分析方法,是目前最常用的现场快速检测(POCT)检验技术。传统以胶体金为标志物的免疫层析检测方法虽然价格低廉、检测简便、肉眼直观可见,但其灵敏度和特异度方面均差强人意。新型荧光标记材料量子点具有荧光尺寸可调,发射光谱窄而对称,高量子产率,宽吸收光谱,荧光强度高,耐光漂白和稳定性好等优点,在多联检测上是很有前途的纳米材料[11]。本研究表达了SARS-CoV-2具有诊断意义的抗原蛋白-N蛋白,并利用量子点作为标记材料标记N蛋白,应用免疫层析技术原理制备了SARS-CoV-2 IgG抗体检测试纸条,能够在10 min左右检测出人血清中IgG抗体,与季节性冠状病毒229E、NL63、HKU1、OC43及支原体、呼吸道合胞病毒等其他呼吸道病毒抗体无交叉反应,重复性良好,预测其稳定性可于常温下(25 ℃)保存160 d。本试纸条检测灵敏度为8.53~17.06 ng/ml,特异度为100.00%,灵敏度为94.29%。SHEN等[12]评价了胶体金免疫层析法检测SARS-CoV-2抗体的效果,检测97例核酸PCR法阳性病例,胶体金法检测出69例阳性,灵敏度为71.1%,检测53例核酸PCR法阴性病例,胶体金法检测出2例阳性,特异度为96.2%。由此可见,量子点免疫层析法相比胶体金性能更为优良,其原因可能为胶体金法免疫层析通过肉眼观察结果,阳性结果捕捉率偏低,而量子点等荧光材料通过发射荧光可被仪器采集荧光读取结果,结果可靠性更高。另外量子点更优良的性能决定着其在免疫层析领域的应用必将广泛推广。
同时,本课题研究具有一定的局限性,体现在样本数量较少,SARS-CoV-2阳性血清样本有35例,且样本血清中IgG抗体浓度未知,无法代表不同抗体浓度梯度的患者。另外,检测时也可能因为环境因素或样本血清内其他干扰因子存在而出现假阳性。利用量子点免疫层析法制备了SARS-CoV-2 N蛋白抗体检测试纸条,操作简便,灵敏度及特异度高,可以应用于POCT,进一步结合SARS-CoV-2 S1蛋白抗体检测,在COVID-19诊断及疫苗注射判断中意义重大。本研究将进一步设计研发同一试纸条不同T线检测,实现同时检测出抗N、S1蛋白抗体,也为下一步研究荧光材料免疫层析法多元检测奠定基础。
4 意义
目前SARS-CoV-2感染的大量排查主要采用核酸检测的方法,因其灵敏度强而成为疑似病例确诊的金标准[13]。但该技术对实验场所及人员要求高,操作繁琐,受环境条件影响较大,容易受气溶胶的污染而出现假阳性[14]。血清学改变是COVID-19患者疾病发展过程中的普遍事件,发生在感染的早期并一直持续至感染后期,甚至康复期。检测COVID-19 患者血清中产生的抗体,可做到早诊断、早隔离、早治疗。《新型冠状病毒肺炎诊疗方案(试行第七版)》[15]首次将血清SARSCoV-2特异度抗体作为COVID-19确诊的指标之一。SARS-CoV-2包含众多蛋白,其中N蛋白包裹病毒基因组RNA并形成螺旋状核糖核蛋白,使其被包装成病毒粒子[16-17]。除了病毒RNA包装和病毒颗粒形成[8],N蛋白已被证明通过招募RNA解旋酶DDX1来促进RNA模板读取[17],从而参与亚基因组mRNA转录。N蛋白作为高保守、抗原表位强的蛋白,其抗体检测在临床诊断中具有重要意义。
目前国内上市的SARS-CoV-2疫苗主要包括灭活病毒疫苗(SARS-CoV-2),减毒腺病毒载体疫苗及mRNA疫苗,其中可以产生抗N蛋白IgG抗体的只有灭活病毒疫苗,因此,检测抗N蛋白IgG抗体可以判断是否接种过灭活病毒疫苗:若无疫苗接种史,则为既往感染;尤其合并检测抗S1蛋白IgG抗体,在普查、筛查中判断疫苗接种史及既往感染史均有重要指导意义。另外针对目前国外主要两种疫苗(辉瑞mRNA疫苗、阿斯利康腺病毒疫苗)注射情况下,在国境安检快速筛查N蛋白IgG抗体及S1蛋白IgG抗体,更有助于判断入境人员为既往感染或疫苗接种,有利于有效开展疫情防控。
作者贡献:于仁峰进行文章的构思与设计,统计学处理,撰写论文;邹大阳、余涛、刘威进行研究的实施与可行性分析;徐雅晴、秦日辉进行数据收集;于仁峰、莫冬冬、段佳慧参与试纸条的制作;于仁峰、邹小仓、贺晓明进行数据整理;于仁峰、李琳昊、王可慧进行结果的分析与解释;王可慧进行论文的修订;刘威负责文章的质量控制及审校;刘威、郭金鹏对文章整体负责,监督管理。
本文无利益冲突。

