Dickkopf-1在动脉瘤性蛛网膜下腔出血预后中的价值
应翔 周江 张杰 陈孟宗
蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)是一种严重的脑卒中类型,年发病率约9.1/10万,对患者健康造成严重的损害。颅内动脉瘤破裂是aSAH的主要原因[1]。世界神经外科医师联盟(world federation of neurosurgeons score,WFNS)评分和改良的Fisher分级常用于评估动aSAH后的严重程度和预测预后[2]。生物标志物与动脉瘤性蛛网膜下腔出血的预后关系被广泛研究[3]。Wnt是一种分泌型糖蛋白,在发育过程中能够调节神经元的动态平衡,在成年人中也是如此。Dickkopf-1作为Wnt信号通路中重要的拮抗分子,负向调节典型的Wnt途径[4]。Dickkopf-1有助于缺血性或出血性神经元凋亡的发生,减少Dickkopf-1可通过改善血脑屏障破坏和脑水肿保护神经元免受缺血或出血性损伤[5]。研究表明,血清Dickkopf-1水平与急性缺血性卒中1年不良预后独立相关[6]。此外,血清中高水平的Dickkopf-1与重型颅脑损伤患者病情加重和30 d死亡率上升密切相关[7]。本文探讨血清Dickkopf-1水平与aSAH预后的相关性。
1 资料与方法
1.1 临床资料 选择2018年7月至2019年8月本院自发性蛛网膜下腔出血患者。纳入标准包括:①首次蛛网膜下腔出血;②经CT血管造影或数字减影血管造影证实的单个颅内动脉瘤破裂所致的蛛网膜下腔出血;③年龄≥18岁;④卒中发病后24h内入院;⑤住院后48 h内行动脉瘤手术。排除标准:①动脉瘤再出血;②疑似假性动脉瘤;③其他特殊疾病或情况,如炎症性疾病、恶性肿瘤、其他类型中风和妊娠;④临床资料不完整;⑤无法获得血样;⑥失去随访。同时,招募社区中的健康者为对照组。本项经本院伦理委员会批准,所有受试者或其直系亲属签署知情同意书。
1.2 方法 收集患者的基线数据、血管危险因素(吸烟、饮酒、高血压和糖尿病)、病史和临床特征。卒中严重程度的评估使用WFNS量表完成。血压记录由仰卧时采集,三次血压记录的平均值用于进一步分析。影像学资料包括是否急性脑积水、脑室出血、动脉瘤部位(前循环或后循环)、瘤形态(囊性或其他类型)、瘤直径和改良Fisher分级。动脉瘤的手术方法包括开颅夹闭和血管内介入。随访至卒中后3个月或死亡。所有患者在卒中起病后3个月内进行电话随访,以格拉斯哥预后评分(GOS)作为预后评分。GOS评分为1分(死亡)、2分(持续植物状态)、3分(重残)、4分(中残)和5分(恢复良好)[8]。GOS评分1~3被定义为不良[9]。
1.3 血样采集和血清Dickkopf-1测定 所有患者到达急诊时采集血样,对照组在研究开始时采集血样。对所有入选患者均进行常规实验室检测(血糖、白细胞计数、血清C反应蛋白等)。所有血清样本均分离后立即保存在-70℃进行检测。血清Dickkopf-1水平采用酶联免疫吸附法检测在两份样本中测量,使用美国MD公司VERSAmax酶标测试仪,试剂盒由北京安诺伦生物科技公司提供。
1.4 统计学方法 采用SPSS19.0和MedCalc 9.6.4.0软件。符合正态分布计量资料以(±s)表示,偏态分布计量资料以M(Q1,Q3)表示,计数资料以n(%)表示,采用t检验、Mann-Whitney检验、Fisher’s精确检验或χ2检验比较预后不良患者和预后良好患者的基线特征。多组间数据比较采用Kruskal-Wallis H检验。用Spearman相关系数确定血清Dickkopf-1水平与WFNS评分及改良Fisher评分之间的线性关系。多因素分析采用Logistic回归分析。绘制ROC曲线以确定血清Dickkopf-1水平的最佳临界值,使用最大Youden指数生成相应的敏感度和特异度值。报告曲线下面积(AUC)及其相应的95%可信区间。AUC比较采用Z检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者的基本资料 179例aSAH患者中,47例患者因再次出血、失访等原因剔除。最终132例患者纳入研究。男52例,女80例;年龄27~72(50.8±11.0)岁。对照组100例,男46例,女54例;年龄30~74(48.9±12.3)岁。患者年龄、性别比例与对照组比较差异均无统计学意义(P>0.05)。
2.2 aSAH患者血清Dickkopf-1水平与aSAH严重程度的多因素模型评估 aSAH患者血清Dickkopf-1水平为1.1~8.8 ng/mL,中位数5.1(3.5,6.4)ng/mL,对照组血清Dickkopf-1水平为0.2~3.5 ng/mL,中位数为1.1(0.7,1.9)ng/mL。aSAH患者血清Dickkopf-1水平明显高于对照组(P<0.001)。aSAH患者血清Dickkopf-1水平随着WFNS和改良Fisher评分的增加而显著升高(均P<0.001)。aSAH后血清Dickkopf-1水平除与改良Fisher评分外,还与WFNS评分独立相关(P<0.001)。见图1~3。

图1 血清Dickkopf-1水平
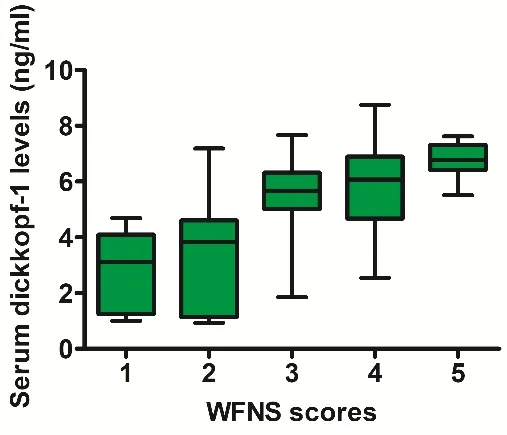
图2 Dickkopf-1与WFNS评分
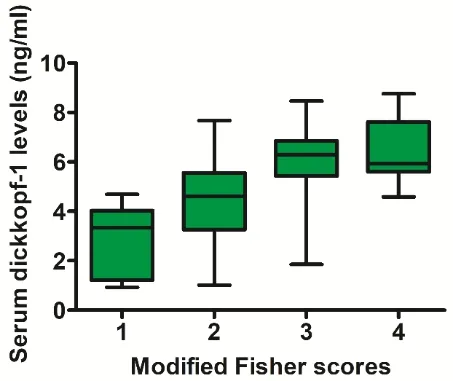
图3 Dickkopf-1与改良Fisher评分
2.3 Dickkopf-1水 平与aSAH预后多因素分析 随着GOS评分的升高,血清Dickkopf-1水平明显下降(P<0.001),见图4。与卒中后3个月预后良好的患者相比,预后不良3个月的患者年龄、WFNS评分、改良Fisher评分、血清C-反应蛋白水平、血糖水平、白细胞计数和血清Dikopt-1水平显著增高,急性脑积水、脑室内出血和脑室外引流的比例也显著增加(P<0.05),且预后不良患者的年龄、WFNS评分、改良Fisher评分、血清C-反应蛋白水平、血糖水平、白细胞计数和Dikopt-1水平均显著高于卒中后3个月预后良好的患者(P<0.05)。将上述变量纳入二元Logistic回归模型,发现与aSAH术后3个月不良预后独立相关的因素有WFNS评分(OR 3.758;95%CI 1.582~8.926;P=0.003)、改良Fisher评分(OR 4.298;95%CI 1.513~12.209;P=0.006)和 血清Dickkopf-1水 平(OR 1.132;95%CI 1.004~1.277;P=0.021)。Hosmer-和Lemeshow检验表明,包括WFNS评分、改良Fisher评分和血清Dickkopf-1水平在内的数据模型拟合效果较好(P=0.344)。
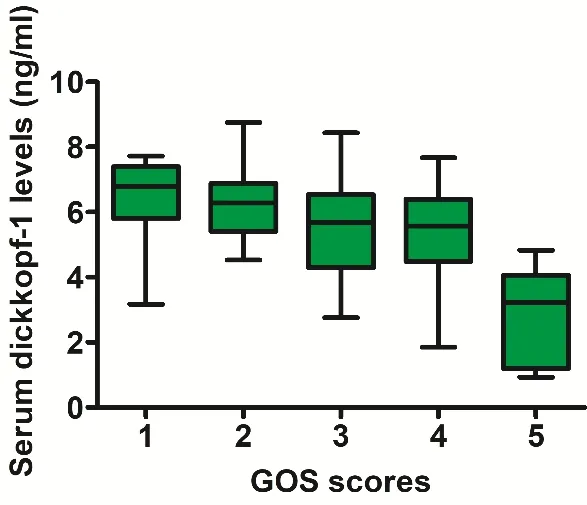
图4 Dickkopf-1与 GOS评分
2.4 ROC曲线下血清Dickkopf-1水平与预后 以约登指数0.509为标准,检测血清dikkopt-1的最佳值为4.83ng/mL,其敏感性为85.4%,特异性为65.5%。将血清Dickkopf-1水平的AUC与两个传统的预后决定因素(WFNS评分和改良Fisher评分)以及三个共同生化指标(血清C-反应蛋白水平、血糖水平和血白细胞计数)的AUC进行比较,见图5。血清Dickkopf-1预测水平高于血清C-反应蛋白水平(AUC 0.667;95%CI 0.579~0.746;P=0.037)、血糖水平(AUC 0.643;95%CI 0.555~0.724;P=0.015)和血白细胞计数(AUC 0.614;95%CI 0.525~0.697;P=0.003),其预测能力与WFNS评分(AUC 0.863;95%CI 0.793~0.917;P=0.086)和改良Fisher评分(AUC 0.835;95%CI 0.760~0.894;P=0.299)相当。

图5 血清Dickkopf-1与传统指标预测水平的ROC曲线
3 讨论
较多流行病学研究表明,新生儿缺氧缺血性脑病[10]、重型颅脑损伤[7]和急性缺血性卒中[6]后循环Dickkopf-1水平升高。本研究结果显示,aSAH后血清Dickkopf-1水平显著升高。此外,血清Dickkopf-1水平与WFNS评分和改良的Fisher评分显示的出血严重程度高度相关;血清Dickkopf-1水平是卒中后3个月不良预后的独立预测因子;血清Dickkopf-1水平对aSAH显示出较高的预后预测能力。因此,血清Dickkopf-1有可能成为预测aSAH预后的潜在生物标志物。
研究表明,Dickkopf-1可能参与急性脑损伤的病理生理过程。大鼠脑出血后早期脑组织中Dickkopf-1水平显著升高[5]。在6个活检样本和1个内侧颞叶癫痫合并海马硬化患者的尸检样本中发现了Dickkopf-1免疫标记[11]。此外,针对Dickkopf-1的小干扰RNA(siRNA)显著减轻大鼠脑出血后的脑水肿,改善血脑屏障的通透性[5]。
在一项对急性缺血性卒中患者进行研究中,发现Dickkopf-1水平与卒中严重程度无相关性[12-13]。在另一项严重颅脑损伤患者的研究中,血清Dickkopf-1水平与临床评分密切相关[7]。本资料纳入132例aSAH患者中,血清Dickkopf-1水平与WFNS评分和改良Fisher评分密切相关。使用多元回归分析,血清Dickkopf-1水平与其密切相关仍然存在。到目前为止,已经有三项临床研究评估了Dickkopf-1水平与缺血性卒中预后的关系[9,12-13]。前两项研究中,循环中Dickkopf-1水平与3个月的不良预后之间没有明显的关系。在最近一项3178例急性缺血性卒中患者的研究中,循环中的Dickkopf-1可能是一年不良预后的独立预测因子[6]。3,178例患者中Dickkopf-1浓度为4.04 ng/mL。在最近一项观察性研究中,血清Dickkopf-1水平与严重颅脑损伤后30 d的死亡率和总存活率独立相关[7]。颅脑损伤患者血清Dickkopf-1水平范围为0.9~7.9 ng/mL,中位数为3.7 ng/mL;同时,对照组血清Dickkopf-1水平为0.4~3.4 ng/mL,中位数为1.0 ng/mL。本研究中,血清Dickkopf-1水平与aSAH后3个月不良预后之间存在独立关联。ROC曲线显示,血清Dickkopf-1水平在出血性卒中后3个月预后良好和预后不良的患者方面显示出显著的预后准确性。对血清Dickkopf-1水平和两个传统的预后决定因素(即WFNS评分和改良的Fisher评分)[2]以及三个共同的生化变量(即血清C-反应蛋白水平、血糖水平和白细胞计数)之间的AUC进行比较[14-15]。结果表明,血清dicckopf-1水平对预后的预测能力明显高于血清C反应蛋白水平、血糖水平和白细胞计数,与WFNS评分和改良Fisher评分相似。综上所述,血清dicckopf-1可能是预测aSAH长期预后的潜在生物标志物。

