围绝经期女性超重、胰岛素抵抗与肠道菌群的相关性分析
盛吉莅 诸剑芳 黄元安 金肖青
围绝经期是女性卵巢功能及生育能力逐步走向衰退的时期,除潮热、盗汗、睡眠障碍等症状外,大部分女性还会出现超重、肥胖以及胰岛素抵抗的现象,进而增加2型糖尿病、高血压等心血管和代谢性疾病的患病风险[1]。近年来,较多研究[2-3]发现肠道菌群与肥胖、胰岛素抵抗关系密切,纠正失调的肠道细菌可能成为治疗和预防肥胖的靶点。本文探讨围绝经期女性体重增加与相关血液指标和肠道菌群的相关性。
1 资料与方法
1.1 临床资料 选择2017年12月至2019年12月本院围绝经期患者72例。本项目通过医院伦理委员会批准,患者均签署书面知情同意书。纳入标准[4]:①年龄>40周岁,且<60周岁;②出现月经周期不规则、经期时间延长、经量增多或减少,或月经停止1年内病史者。排除标准:①长期便秘或腹泻;②存在胃肠道疾病,需长期服用胃肠动力药物;③入组前3个月内曾服用益生菌或抗生素等药物。体重指数(BMI)<24.0为体重正常组(正常组,NC),24.0≤BMI<28.0则为体重超重组(超重组,OB)。
1.2 方法 (1)形体指标:体重采用拜斯倍斯身高体重分析仪(型号:BSM370)于同一时间段进行测量;腰围采用世界卫生组织(WHO)推荐的测量腰围的方法[5],双脚分开25~30 cm,测量位置在水平髂前上嵴和第12肋下缘连线的中点,反复测量3次,取平均数;臀围测量时两腿并拢直立,测量位置在耻骨联合和背后臀大肌最凸处。腰臀比(WHR)=腰围(cm)/臀围(cm);腰围身高比(WHtR)=腰围(cm)/身高(cm)。(2)血液指标:抽取肘静脉血,检测患者血液中甘油三酯、总胆固醇、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、空腹胰岛素(FINS)及空腹血糖(FPG),并计算(胰岛素抵抗指数)HOMA-IR。(HOMA-IR)= 空腹血糖(FPG)×空腹胰岛素(FINS)/22.5。(3)肠道菌群检测方法:①样品采集:用一次性采样勺采集新鲜排出的粪便≥2 g,装入无菌粪盒中,并将样本冻存于-80℃冰箱中。②预处理:1 g粪便样品用30 mL无菌的0.1 mmol/L磷酸钠缓冲液(SPB)悬浮,涡旋约30 min,200 g离心5 min,离心3次,去除粗颗粒,收集上清液;9,000 g离心3 min,收集沉淀,30 mL SPB洗4次,最后重悬于10 mL的SPB中,平均分装成5份,置于-70℃保存,用于后续DNA提取。③DNA提取、纯化及检测:依据粪便肠道菌群DNA 提取试剂盒QIAamp Fast DNA Stool Mini Kit(QIAGEN)操作说明书进行样本DNA 提取。操作步骤如下:用紫外分光光度计(NanoDrop)检测DNA浓度及纯度,1% 琼脂糖凝胶电泳跑胶观察DNA完整性。选取OD260 /OD280值在1.8~2.0之间、条带完整的DNA样本进行后续分析。④PCR扩增、建库及测序:采用细V3-V4区通用引物对16S rDNA进行PCR扩增。所用引物为341F(5’-CCTAYGGGRBGCASCAG-3’)和806R(5’-GGACTACNNGGGTATCTAAT-3’)。使用Thermofisher公司的Ion PlusFragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的库经过Qubit定量和文库检测合栺后,使用IonS5TMXL测序仪上机测序。⑤数据分析:使用Cutadapt进行剪切、拆分和处理得到原始序列(Rawreads),并利用UCHIME Algorithm与物种注释数据库迚行比对检测,得到最终的有效数据(Clean Reads)。采用Uparse软件对所有样品的全部Clean Reads进行聚类,默认以97%的一致性(identity)将序列聚类成为操作分类单元(operational taxonomic Units,OUT),同时选取OTU数目的代表性进行物种注释。使用Qiime软件计算Chao1,Shannon和Simpson指数,使用R软件进行组间差异分析。
1.3 统计学方法 采用SPSS 23.0统计软件。符合正态分布计量资料以(±s)表示,用t检验;不符合正态分布,用秩和检验;计数资料采用频数表示。以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 见表1。
表1 两组一般资料比较(±s)
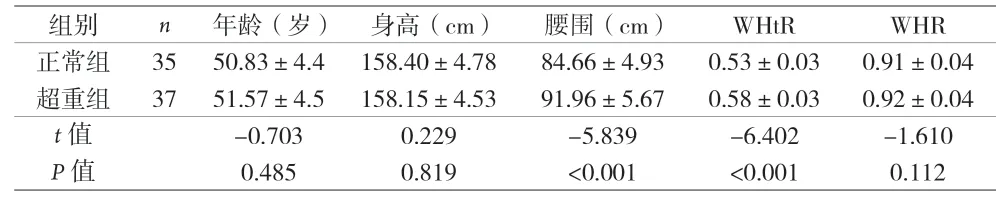
表1 两组一般资料比较(±s)
?
2.2 血液指标比较 与正常组比较,超重组的空腹胰岛素和HOMA-IR水平高于正常组,差异有统计学意义(P<0.01)。见表2。
表2 两组血液指标比较(±s)

表2 两组血液指标比较(±s)
?
2.3 两组肠道微生物多样性比较 两组Observedotus,Chao1,Shannon,Simpson,ACE指数,比较差异无统计学意义(P>0.05)。见表3。
表3 两组肠道微生物多样性比较(±s)

表3 两组肠道微生物多样性比较(±s)
?
2.4 两组肠道菌群相对丰度比较 在门水平上,正常组菌群相对丰度较高的依次为厚壁菌门(Firmicutes)84.5%,拟杆菌门(Bacteroidetes)11.71%,放线菌门(Actinobacteria)3.62%,变形菌门(Proteobacteria)1.07%,梭杆菌门(Fusobacteria)0.01%,超重组的菌群相对丰度较高的依次为厚壁菌门(Firmicutes)79.61%,拟杆菌门(Bacteroidetes)11.73%,变形菌门(Proteobacteria)4.22%,放线菌门(Actinobacteria)3.65%,梭杆菌门(Fusobacteria)0.54%。超重组菌群相对丰度与正常组比较差异无统计学(P>0.05),见图1。

图1 两组肠道菌群相对丰度比较
2.5 两组肠道菌群差异物种分析 超重组的δ变形菌纲(deltaproteobacteria)、脱硫弧菌目和脱硫弧菌科(desulfovibrionaceae)与正常组比较,差异有统计学意义(P<0.01),见图2~4。

图2 T-test检测方法在纲水平上两组肠道菌群的差异

图3 T-test检测方法在目水平上两组肠道菌群的差异
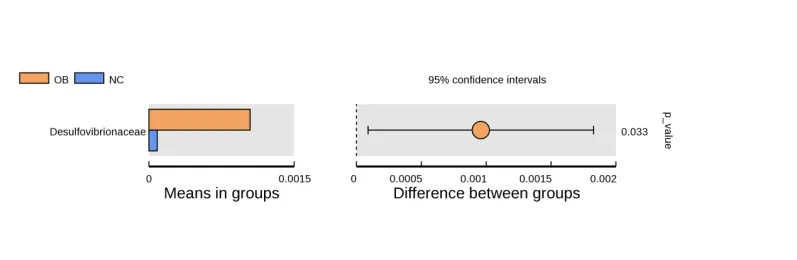
图4 T-test检测方法在科水平上两组肠道菌群的差异
3 讨论
肠道菌群作为人体最大的微生态系统,是近来与肥胖相关的多种疾病防治研究的热点之一。肠道菌群的改变可引发慢性炎症反应,进而导致肥胖、胰岛素抵抗等代谢失调。本资料显示,超重组女性肠道菌群丰度及多样性结果与正常组比较,差异无统计学意义(P>0.05),但超重组菌群丰度及多样性呈下降趋势。在肠道菌群组成结构方面,两组菌群结构大体相当,在门水平中,两组均以厚壁菌门和拟杆菌门为优势菌群,这与相关研究[6]结果一致。
本资料中,超重组甘油三酯、总胆固醇、LDL水平总体较高,HDL和空腹血糖水平较低与正常组比较,差异无统计学意义(P>0.05),而空腹胰岛素水平、HOMA-IR以及肠道菌群中δ-变形菌和脱硫弧菌数量增高(P<0.01),表明围绝经期女性体重增加过程中,胰岛素抵抗出现早于糖脂代谢紊乱,且该过程可能与肠道菌群中δ-变形菌和脱硫弧菌的数量改变有关。变形菌门是肠道微生物中最大的一门,包括α-变形菌、β-变形菌、γ-变形菌、δ-变形菌和ε-变形菌等五类,其中有较多致病菌,如大肠杆菌、沙门氏菌、霍乱弧菌和幽门螺杆菌等,会导致胃肠道感染、伤寒、霍乱、急慢性胃炎等疾病,变形菌门比例增高被认为是肠道菌群失调的微生物标志之一[7-9]。
目前关于肥胖的病理生理机制尚不清楚,但近年来研究[10]揭示,肥胖与慢性低度炎症有关,且慢性低度炎症被认为是促使肥胖患者胰岛素抵抗进一步发展的使动因素之一。脱硫弧菌属于δ-变形菌纲中最主要的一种可以产生硫化氢的细菌,其能够促进肠道IL-6和IL-8的分泌,诱发肠道慢性炎症[11-12],进而促进体重增加及胰岛素抵抗的发展。另外,腹部脂肪增加也是胰岛素抵抗的一个重要原因。本资料结果显示,围绝经期女性体重增加的同时腰围、WHtR也增大(P<0.01)。有研究表明[13-15]腹部脂肪增加会导致脂肪细胞分泌的游离脂肪酸(FFA)、瘦素(Leptin)、肿瘤坏死因子(TNF-α)、抵抗素(Resistin)、脂联素(Adiponectin)、过氧化物酶体增殖体激活物受体γ(PPAR-γ)等物质也相应增加,使局部组织对胰岛素的敏感性下降,从而影响胰岛素的效应发挥,导致胰岛素抵抗的产生。
综上所述,围绝经期女性超重及胰岛素抵抗的发展可能与肠道菌群的结构改变存在一定关系。但本研究也有一定的局限性,比如未纳入肥胖的围绝经期女性,且肠道菌群结构受饮食习惯、地域等多方面影响,结果难免产生一定的偏倚,期待后续研究能将以上因素纳入考虑,进一步探索围绝经期女性体重增加与肠道菌群的相互关系。

