法舒地尔通过Nrf2/ARE和NF-κB途径对糖尿病周围神经病变大鼠的作用*
吉桂芳 马明梅 张静雅 盖祥云
(1.青海大学附属医院药剂科,青海 西宁 810000;2.青海民族大学药学院,青海 西宁,810007;3.青海大学附属医院静脉配置中心,青海 西宁810000)
糖尿病周围神经病变(Diabetic peripheral neuropathy,DPN)是糖尿病最常见的慢性并发症之一,常见的形式为糖尿病感觉运动多发性神经病和影响外周神经系统的感觉、运动和自主神经功能[1]。DPN的全球患病率为16%~66%[2]。目前,DPN的有效治疗方法较少,药物的治疗效果受到许多因素,如严重的不良反应等。因此,还需继续探索新的治疗策略来治疗DPN[3]。法舒地尔是目前唯一获得临床批准的Rho关联卷曲螺旋蛋白激酶抑制剂,由于其强大的血管舒张功能,法舒地尔已被广泛应用于血管痉挛性疾病,如蛛网膜下腔出血和缺血性心脏病[4]。目前已有研究[5]表明,法舒地尔可改善高血糖诱导的糖尿病小鼠心肌纤维化,抑制炎症反应。目前,关于法舒地尔对DPN的作用尚不明确。有研究[6]表明,核因子红系相关因子2(Nuclear factor erythroid 2-related factor 2,Nrf2)通过调节抗氧化反应元件(Antioxidant response element,ARE)能够刺激内源性抗氧化防御和解毒酶的产生从而调节神经性病变。核因子-κB(Nuclear factor-κB,NF-κB)是一种转录因子,能促进炎细胞因子的产生,从而参与DPN中炎症反应的激活[7]。因此,本研究旨在探究法舒地尔对DPN及Nrf2/ARE和NF-κB通路的影响,以期为明确舒地尔对DPN的作用机制及开发新的DPN治疗策略提供新的科学资料。
1 材料与方法
1.1 主要试剂 法舒地尔购自天津红日药业股份有限公司,普瑞巴林购自重庆赛维药业有限公司,链脲佐菌素(STZ)购自美国Sigma公司,丙二醛(MDA)测定试剂盒(TBA法)、还原型谷胱甘肽(GSH)测定试剂盒(分光光度法)和总超氧化物歧化酶(SOD)测定试剂盒(WST-1 法)购自南京建成生物工程研究所,IL-1β、IL-6和TNF-αELISA检测试剂盒购自美国Biovision,BCA试剂盒购自南京凯基生物科技有限公司,Nrf2抗体和HO-1抗体购自艾博抗(上海)贸易有限公司,p-p65抗体和p65抗体购自美国Cell Signaling Technology,GAPDH抗体购自北京义翘神州科技股份有限公司。
1.2 动物饲养 雄性清洁级SD大鼠60只,体质量220~250 g,在20~25℃、明暗交替(12 h/12 h)条件下饲养。所有大鼠自由饮水和进食。待大鼠适应环境1周后,进行分组造模及给药处理。本研究符合动物伦理要求,并经医院伦理委员会审核批准。
1.3 模型的建立及给药处理 将60只SD大鼠随机分为对照组、模型组、阳性对照组、法舒地尔低剂量组、法舒地尔高剂量组,每组各12只。依照参考文献[8]建立DPN大鼠模型。模型组、阳性对照组、法舒地尔低剂量组、法舒地尔高剂量组大鼠用高脂饲料喂养6周,对照组大鼠用标准饲料喂养6周。6周后,除对照组外,其余组大鼠腹腔注射STZ(35 mg/kg),对照组大鼠注射等量溶剂。72 h后,大鼠禁食禁水12 h,采集大鼠尾静脉血,血糖仪检测各组大鼠空腹血糖值,血糖值>16.7 mmol/L者即为糖尿病模型造模成功。对照组大鼠用标准饲料喂养,其余组大鼠用高脂饲料喂养。阳性对照组大鼠灌胃普瑞巴林(30 mg/kg)[9];法舒地尔低剂量组和法舒地尔高剂量组分别灌胃法舒地尔(15 mg/kg和30 mg/kg)[10],每天给药1次,对照组和模型组灌胃生理盐水,连续给药8周后,进行大鼠行为学测试。
1.4 血糖检测 给药结束后,各组大鼠禁食不禁水12 h,测量各组大鼠体重。随后用血糖仪检测各组大鼠空腹血糖值。
1.5 热板实验 参考文献[11],采用Eddy热板法检测各组大鼠热伤害性阈值。给药结束后,将各组大鼠置于热板仪内,热板仪温度(55±0.5)℃,记录第一次反应(闪烁、舔后爪或跳跃)所需的时间,即为热缩腿潜伏期(Thermal withdrawal latency,TWL)。截断时间设为15 s,以避免组织损伤。
1.6 Von Frey实验 参考文献[12],采用Von Frey法检测各组大鼠机械性超敏反应,确定其对伤害性刺激的痛阈。给药结束后,将各组大鼠转移到高架铁丝网笼子中,待大鼠适应环境20 min后,用 Von Frey压力施加器对后肢足底中部施加持续增加的压力刺激。用数字式压力计记录动物出现反应(缩爪或轻快抬起)的最大压力,即为压力-缩腿阈(Paw-Withdrawal Threshold,PWT)。
1.7 Randall Selitto实验 参考文献[13],采用Randall-Selitto法测定机械性痛觉超敏(Mechanical allodynia,MWT),确定机械性伤害阈值。给药结束后,将各组大鼠固定后,用Randall-Selitto痛觉测试仪对后肢表面施加持续增加的压力刺激,用数字压力计记录动物表现出反应(爪子缩回、吱吱叫或挣扎)的最大压力,即为MWT。
1.8 神经传导速度(Nerve conduction velocity,NCV)检测 给药结束后,3%戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,仰卧位固定,随后暴露右侧坐骨神经。参考文献[14],采用双极针电极(24G)对坐骨神经进行单次刺激(5V)。使用数据采集系统记录M波和H波反射。人工记录两个刺激点之间的距离。运动神经传导速度(Motor nerve conduction velocity,MNCV)(m/s)=距离/M波潜伏期,感觉神经传导速度(Sensory nerve conduction velocity,SNCV)=距离/H波潜伏期。
1.9 HE染色检测坐骨神经病理学变化 末次给药结束后,3%戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,腹主动脉采血。取出坐骨神经,4%多聚甲醛固定,梯度酒精脱水,二甲苯透明。组织块石蜡包埋,切片机切片。最后将切片置于温箱中烘干。石蜡切片二甲苯、梯度酒精脱蜡至水,蒸馏水冲洗切片后,苏木素染色液染色15 min,切片流水冲洗1 min,1%盐酸乙醇分化3 s后,氨水返蓝,伊红染色液染色10 s后,流水冲洗。切片梯度酒精脱水、二甲苯脱水透明,中性树胶封固,显微镜下观察。
1.10 甲苯胺蓝染色检测坐骨神经轴突数量 取新鲜坐骨神经,10%甲醛液固定组织,常规脱水包埋。对包埋的组织块进行修块后,切片机切片。石蜡切片常规脱蜡至水。加入甲苯胺蓝染色液,将切片置于60℃温箱中孵育40 min。蒸馏水清洗切片后,1%盐酸乙醇分化3 s,切片梯度酒精脱水、二甲苯脱水透明,中性树胶封固,显微镜下观察。
1.11 MDA、GSH和SOD含量测定 取坐骨神经,加入预冷提取液,制备组织匀浆。组织匀浆离心取上清液,根据MDA、GSH和SOD检测试剂盒说明书所示,检测上清液中MDA、GSH和SOD的含量。
1.12 IL-1β、IL-6和TNF-α含量测定 给药结束后,腹主动脉采血,分离血清后,根据ELISA试剂盒说明书所示,测定血清中IL-1β、IL-6和TNF-α含量。
1.13 Western blot检测Nrf2、HO-1、p-p65和p65蛋白水平 取坐骨神经,加入液氮研磨,随后加入含1 mmol/L苯甲基磺酰氟的RIPA裂解缓冲液,充分混匀后,冰上反应30 min。离心收集上清液,BCA试剂盒检测上清液蛋白浓度。根据所测浓度,取30 μg蛋白加入凝胶上样孔内,进行SDS-PAGE电泳和转膜操作。5%脱脂奶粉室温封闭3 h。随后加入Nrf2抗体(1:1000)、HO-1抗体(1:1000)、p-p65抗体(1:2000)、p65抗体(1:1000)和GAPDH抗体(1:5000),于4℃条件下孵育过夜。加入特异性二抗(1:5000),室温条件下孵育1 h后,凝胶成像系统检测蛋白条带。Image J软件分析各蛋白条带的灰度值。
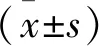
2 结果
2.1 法舒地尔对DPN大鼠体质量和血糖水平的影响 与对照组相比,模型组大鼠体质量显著降低(P<0.05),血糖显著升高(P<0.05);阳性对照组、法舒地尔低剂量组和法舒地尔高剂量组大鼠体重和血糖水平与模型组相比差异均无统计学意义(均P>0.05);法舒地尔高剂量组大鼠体重和血糖水平与法舒地尔低剂量组相比差异无统计学意义(P>0.05)。见表1。

表1 各组大鼠体质量和血糖水平比较Table 1 Comparison of body weight and blood glucose level of rats in each group
2.2 法舒地尔对DPN大鼠行为学的影响 与对照组相比,模型组大鼠TWL、MWT和PWT显著降低(P<0.05);与模型组相比,阳性对照组、法舒地尔低剂量组、法舒地尔高剂量组大鼠TWL、MWT和PWT显著升高(P<0.05);与法舒地尔低剂量组相比,法舒地尔高剂量组大鼠TWL、MWT和PWT显著升高(P<0.05)。见表2。

表2 各组大鼠行为参数的比较Table 2 Comparison of behavioral parameters of rats in each group
2.3 法舒地尔对DPN大鼠MNCV和SNCV的影响 与对照组相比,模型组大鼠MNCV和SNCV显著降低(P<0.05);与模型组相比,阳性对照组、法舒地尔低剂量组、法舒地尔高剂量组大鼠MNCV和SNCV显著升高(P<0.05);与法舒地尔低剂量组相比,法舒地尔高剂量组大鼠MNCV和SNCV显著升高(P<0.05)。见表3。

表3 各组大鼠MNCV和SNCV的比较Table 3 Comparison of MNCV and SNCV of rats in each group
2.4 法舒地尔对DPN大鼠坐骨神经病理学变化和轴突密度的影响 对照组大鼠坐骨神经纤维分布均匀,排列紧密整齐,形态正常。神经髓鞘细胞染色均匀,结构完整清晰,形态正常,与对照组相比,模型组大鼠坐骨神经表现出明显神经病变,并伴有明显炎性细胞浸润,神经纤维数量减少且纤维分布稀疏,神经髓鞘细胞变性、肿胀,部分神经髓鞘溶解脱失,染色不均,轴突数量显著降低(P<0.05);与模型组相比,阳性对照组、法舒地尔低剂量组、法舒地尔高剂量组大鼠坐骨神经病理学变化均有不同程度的改善,神经纤维排列趋于规则,神经髓鞘细胞病变减轻,各组大鼠轴突数量均显著升高(P<0.05),其中阳性对照组和法舒地尔高剂量组改善效果最为明显;与法舒地尔低剂量组相比,法舒地尔高剂量组大鼠坐骨神经病理学变化得到进一步改善,轴突数量显著升高(P<0.05)。见图1、2和表4。

表4 各组大鼠轴突数量的比较Table 4 Comparison of the number of axons in each group of rats

图1 HE染色检测坐骨神经病理学变化(400×)Figure 1 HE staining was used to detect the pathological changes of sciatic nerve注:A.对照组;B.模型组;C.阳性对照组;D.法舒地尔低剂量组;E.法舒地尔高剂量组

图2 甲苯胺蓝染色检测坐骨神经轴突数量(400×)Figure 2 Toluidine blue staining was used to detect the number of sciatic nerve axons 注:A.对照组;B.模型组;C.阳性对照组;D.法舒地尔低剂量组;E.法舒地尔高剂量组
2.5 法舒地尔对DPN大鼠坐骨神经氧化应激的影响 与对照组相比,模型组大鼠坐骨神经组织中MDA显著升高(P<0.05),GSH和SOD含量显著降低(P<0.05);与模型组相比,阳性对照组、法舒地尔低剂量组、法舒地尔高剂量组大鼠坐骨神经组织中MDA显著降低(P<0.05),GSH和SOD含量显著升高(P<0.05);与法舒地尔低剂量组相比,法舒地尔高剂量组大鼠坐骨神经组织中MDA显著降低(P<0.05),GSH和SOD含量显著升高(P<0.05)。见表5。

表5 各组大鼠坐骨神经氧化应激反应的比较Table 5 Comparison of oxidative stress response of sciatic nerve of rats in each group
2.6 法舒地尔对DPN大鼠坐骨神经炎症反应的影响 与对照组相比,模型组大鼠血清中IL-1β、IL-6和TNF-α含量显著升高(P<0.05);与模型组相比,阳性对照组、法舒地尔低剂量组、法舒地尔高剂量组大鼠血清中IL-1β、IL-6和TNF-α含量显著降低;与法舒地尔低剂量组相比,法舒地尔高剂量组大鼠血清中IL-1β、IL-6和TNF-α含量显著降低(P<0.05)。见表6。

表6 各组大鼠炎症反应的比较Table 6 Comparison of inflammatory response in each group of rats
2.7 法舒地尔对DPN大鼠坐骨神经Nrf2/ARE和NF-κB途径的影响 与对照组相比,模型组大鼠坐骨神经中Nrf2和HO-1蛋白水平显著降低(P<0.05),p-p65/p65蛋白水平显著升高(P<0.05);与模型组相比,阳性对照组、法舒地尔低剂量组、法舒地尔高剂量组大鼠坐骨神经中Nrf2和HO-1蛋白水平显著升高(P<0.05),p-p65/p65蛋白水平显著降低(P<0.05);与法舒地尔低剂量组相比,法舒地尔高剂量组大鼠坐骨神经中Nrf2和HO-1蛋白水平显著升高(P<0.05),p-p65/p65蛋白水平显著降低(P<0.05)。见图3、4和表7。
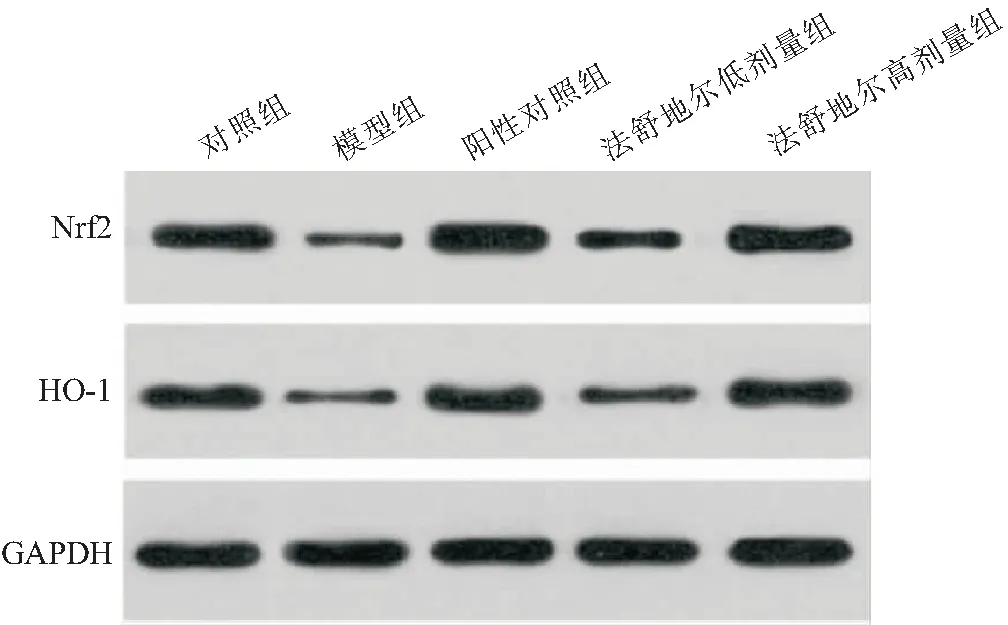
图3 Western blot检测大鼠坐骨神经中Nrf2和HO-1蛋白表达Figure 3 Western blot was used to detect the expression of Nrf2 and HO-1 protein in rat sciatic nerve

图4 Western blot检测大鼠坐骨神经中p-p65/p65蛋白表达Figure 4 Western blot was used to detect the expression of p-p65/p65 protein in rat sciatic nerve

表7 各组大鼠Nrf2、HO-1、p-p65和p65蛋白水平比较Table 7 Comparison of Nrf2,HO-1,p-p65 and p65 protein expression in each group of rats
3 讨论
与糖尿病视网膜病变、糖尿病心肌病变等糖尿病并发症相比,DPN具有起病早、发病率高的特点。DPN的典型病理表现为包括有髓神经纤维再生和脱髓鞘、轴突脱位、神经元变性和再生延迟[15]。有研究[16]表明,DPN的发生与多种机制有关,包括物质代谢紊乱、炎症信号通路的激活、过量氧化应激和钙稳态紊乱等,最终导致糖尿病进展过程中的神经损伤。不断探究新的药物对DPN的作用及其可能的作用机制,对于开发新的DPN治疗药物具有重要意义。
目前,法舒地尔已被广泛用于缓解一系列中枢神经系统疾病的症状,包括脊髓损伤、中风、帕金森病、实验性自身免疫性脑脊髓炎、神经性疼痛和癫痫[17]。已有证据显示,法舒地尔通过诱导巨噬细胞极化,改善实验性变态反应性脑脊髓炎[18]。法舒地尔还可治疗实验性自身免疫性神经炎(Experimental autoimmune neuritis,EAN)。法舒地尔可明显抑制EAN小鼠坐骨神经炎症反应和脱髓鞘细胞数增多[19]。此外,法舒地尔还在糖尿病相关并发症中发挥明显的保护作用。法舒地尔通过抑制炎症反应和抑制转化生长因子-β1和基质金属蛋白酶-9/基质金属蛋白酶-1的表达,从而抑制炎症反应和减轻糖尿病肝纤维化[20]。本研究结果显示,虽然法舒地尔对DPN大鼠体质量和血糖无明显影响,但是法舒地尔治疗可明显升高DPN大鼠TWL、MWT、PWT、MNCV和SNCV,改善DPN大鼠坐骨神经病理学变化,增加坐骨神经轴突数量。表明法舒地尔可在DPN中发挥保护作用。
氧化应激被认为是高血糖条件下细胞损伤的最终共同途径。长期持续的高血糖会导致神经元葡萄糖摄取过多,糖酵解对细胞内葡萄糖的处理不足。细胞内升高的葡萄糖随后驱动替代的多元醇途径,导致氧化应激和丝裂原活化蛋白激酶(MAPK)激活,产生葡萄糖神经毒性[21]。Nrf2/ARE途径是抗氧化应激损伤的主要反应机制。在应激状态下,Nrf2从Keap1中解离出来,转运到细胞核中,并上调抗氧化剂相关酶的转录,如血红素加氧酶-1(Heme oxygenase-1,HO-1)、NAD(P)H醌氧化还原酶1和谷氨酸-半胱氨酸连接酶催化亚单位,从而发挥抗氧化作用[22]。研究[23]表明,Nrf2/ARE途径在神经炎症中发挥重要的作用,激活Nrf2/ARE途径可改善硝酸甘油诱导的偏头痛大鼠神经源性炎症,从而发挥神经保护作用。目前,已有相关研究[24]表明,法舒地尔具有较强抗氧化活性,其通过激活Nrf2通路,抑制氧化应激水平减少脂多糖诱导的星形胶质细胞损伤。本研究结果显示,DPN大鼠坐骨神经中MDA含量明显升高,GSH和SOD含量明显降低,Nrf2和HO-1蛋白水平明显降低。而法舒地尔治疗可明显降低MDA含量,升高GSH和SOD含量以及Nrf2和HO-1蛋白水平。表明法舒地尔可能通过激活Nrf2/ARE途径在DPN中发挥保护作用。
NF-κB通路参与许多生理过程,包括先天免疫、炎症和许多细胞过程,如细胞增殖、转化和凋亡。NF-κB通路的异常激活可促进炎症因子的表达,如IL-1β、IL-6和TNF-α,导致炎性级联和大量中性粒细胞聚集,最终引发一系列病理损伤[25]。已有研究[26]表明,四味健补汤通过抑制NF-κB通路,抑制IL-1β、IL-6和TNF-α等炎症因子的产生,从而缓解小鼠紫杉醇诱导的周围神经病理性疼痛。同样的,周夏慧等[27]的实验结果表明,靶向抑制NF-κB通路可导致IL-6和TNF-α水平降低,减轻神经氧化应激损伤,从而改善DPN大鼠周围神经损伤状态,促进神经传导的恢复。目前,已有研究[28]显示,法舒地尔具有较强抗炎活性,其通过抑制NF-κB通路改善脂多糖诱导的帕金森病模型中多巴胺神经元炎症反应。本研究结果显示,DPN大鼠血清中IL-1β、IL-6和TNF-α水平明显升高,而法舒地尔治疗可明显降低IL-1β、IL-6和TNF-α水平以及p-p65/p65蛋白水平。表明法舒地尔可能通过抑制NF-κB途径在DPN中发挥保护作用。
4 结论
本研究结果表明,法舒地尔可能通过激活Nrf2/ARE途径和抑制NF-κB途径,抑制DPN大鼠氧化应激和炎症反应,从而在DPN中发挥保护作用,为明确法舒地尔对DPN的作用机制及开发新的DPN治疗策略提供了新的科学依据。

