Twinfilin-1过表达缓解镉诱导肾细胞重金属中毒及凋亡*
郭艳红 吴琴宁 邓权 周强
(贵州省第二人民医院,贵州 贵阳 550000)
镉是一种具有广泛用途的金属元素,可用于电镀、充电电池、制造电工合金等,与人类生活息息相关[1]。但镉及化合物均有一定的生物毒性,若受污染的土壤或水体被动植物吸收后,沿着食物链进入人体,将对机体组织器官产生毒性损伤[2]。肾脏是镉主要的蓄积部位,其与硫基类蛋白形成的复合物可对肾小管和肾小球产生不可逆的损伤[3]。关于镉诱导的肾损伤机制有较多报道,大多认为与细胞凋亡、氧化损伤有关[4-5],但其作用机制尚不完全清楚。Twinfilin-1属于肌动蛋白结合蛋白家族成员,在细胞骨架重塑过程中发挥重要作用,与细胞结构形成及细胞凋亡等病理生理过程密切相关[6]。但国内Twinfilin-1与镉诱导肾损伤的相关研究较少,本研究将探究镉诱导肾细胞重金属中毒中Twinfilin-1基因的表达及其对细胞凋亡的影响,这对于明确镉诱导肾细胞凋亡机制具有重要的参考价值。
1 材料与方法
1.1 细胞株来源 猪肾细胞LLC-PK1购于美国组织培养库ATCC。
1.2 主要试剂与仪器 氯化镉(天津市风船化学试剂科技有限公司),取1 g氯化镉溶于4.4 mL双蒸水制备为1 mol/L镉母液,脂质体2000试剂盒(美国Invitrogen),CCK8试剂盒(日本同仁化学研究所),Annexin V-FITC/PI细胞凋亡试剂盒、JC-1探针(美国BD),GAPDH、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、半胱氨酸天冬氨酸特异性蛋白酶(Caspase3、9)、切割后Caspase3、9(cleaved cas3、9)抗体(美国Abcam),pc DNA空载体、pc DNA-Twinfilin-1质粒由上海生工生物股份有限公司提供,Twinfilin-1基因引物由上海基尔顿生物科技有限公司提供,荧光PCR仪、凝胶成像仪(美国Bio-Rad),流式细胞仪(美国BD)。
1.3 细胞培养 将猪肾细胞LLC-PK1均匀悬浮于含有5%胎牛血清的DMEM高糖培养基中,置于37℃、5%CO2条件下培养,待细胞贴壁密度达80%~90%时传代培养,取状态良好的细胞用于后续实验。
1.4 细胞分组与处理 稀释1 mol/L镉母液至8 μmol/L,处理细胞24 h建立重金属中毒模型[7],将细胞随机分为对照组、模型组、模型+pc DNA空载体组、模型+Twinfilin-1过表达组。模型+pc DNA空载体组、模型+Twinfilin-1过表达组参照脂质体2000试剂盒操作,将pc DNA空载体、pc DNA-Twinfilin-1转染细胞48 h,收集细胞通过实时荧光PCR技术和蛋白印迹实验验证转染效果。
1.5 实时荧光PCR技术检测Twinfilin-1 mRNA表达水平 采用Trizol试剂提取细胞中总RNA,再逆转录合成cDNA,Twinfilin-1上游引物序列为5’-GCGUGGUCUCCUGAUCAUUTT-3’,下游引物序列为5’-CCCAAAGAUGCAGCACGUUTT-3’。PCR条件:94℃预变性10 min,94℃变性30 s,60℃退火45 s,JP总40个循环。采用2-△△Ct相对定量法,以GAPDH为内参,计算Twinfilin-1 mRNA的相对水平。
1.6 蛋白印迹检测相关蛋白水平 采用RIPA裂解液提取细胞中总蛋白,经BCA法测定蛋白浓度,取70 μg变性蛋白进行SDS-PAGE凝胶电泳,蛋白分离后切取目的蛋白凝胶转移至PVDF膜,取出PVDF膜经5%脱脂牛奶室温孵育2 h,封闭非特异性位点,再置于1:1000蛋白一抗中4℃孵育过夜,接着置于1:8000蛋白二抗中37℃孵育1 h,最后添加ECL发光试剂,置于凝胶成像仪上成像,通过Quantity One软件对蛋白条带进行灰度分析。
1.7 CCK8实验检测细胞增殖 将各组细胞接种于96孔板,常规培养24、48、72、96 h,向孔中添加含有10% CCK8试剂的培养基,继续培养4 h,于450 nm处检测各孔吸光度值。
1.8 流式细胞术检测细胞凋亡 收集各组细胞,调整浓度至1×109/L,取100 μL细胞悬液分别加入Annexin V-FITC、PI染液各5 μL,室温下避光孵育30 min,再添加400 μL结合缓冲液,混匀后上流式细胞仪检测,计算凋亡细胞占细胞总数的百分比。
1.9 流式细胞仪检测细胞线粒体膜电位的变化 收集各组细胞,调整浓度至1×109/L,取100 μL细胞悬液加入10 mg/L JC-1探针,37℃孵育30 min,采用流式细胞仪检测。正常线粒体内JC-1聚集于线粒体基质中形成聚合物,呈红色荧光,而受损线粒体由于膜电位下降或丧失,JC-1只能以单体形式存在于胞浆,呈绿色荧光。
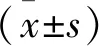
2 结果
2.1 LLC-PK1细胞转染情况 实时荧光PCR技术和蛋白印迹检测细胞中Twinfilin-1的表达结果显示,与对照组比较,模型组Twinfilin-1 mRNA及蛋白水平降低(P<0.05);与模型组比较,模型+Twinfilin-1过表达组Twinfilin-1 mRNA及蛋白水平增加(P<0.05),而模型组+pc DNA空载体组无明显变化(P>0.05),见图1。
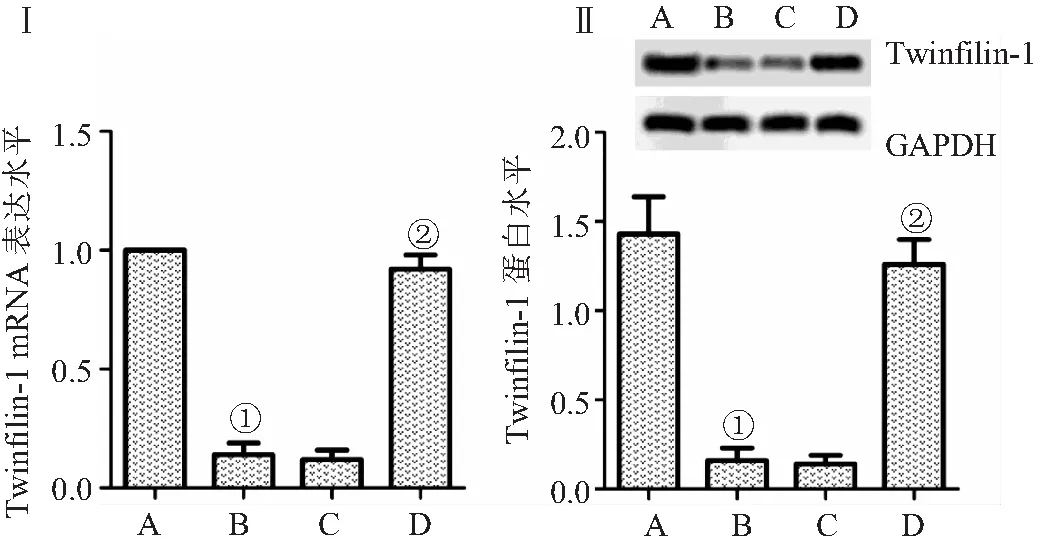
图1 LLC-PK1细胞转染情况Figure 1 Transfection of LLC-PK1 cells注:Ⅰ.实时荧光PCR技术检测Twinfilin-1 mRNA水平,Ⅱ.蛋白印迹检测Twinfilin-1蛋白水平;A.对照组,B.模型组,C.模型+pc DNA空载体组,D.模型+Twinfilin-1过表达组;与对照组比较,①P<0.05;与模型组比较,②P<0.05
2.2 Twinfilin-1过表达对细胞增殖的影响 CCK8实验检测细胞增殖能力结果显示,培养96 h时,与对照组比较,模型组细胞增殖能力降低(P<0.05);与模型组比较,模型+Twinfilin-1过表达组细胞增殖能力增加(P<0.05),而模型组+pc DNA空载体组无明显变化(P>0.05),见图2。

图2 Twinfilin-1过表达对细胞增殖的影响Figure 2 Twinfilin-effect of overexpression of bcl-1 on cell proliferation注:A.对照组,B.模型组,C.模型+pc DNA空载体组,D.模型+Twinfilin-1过表达组;与对照组比较,①P<0.05;与模型组比较,②P<0.05
2.3 Twinfilin-1过表达对细胞凋亡的影响 流式细胞术检测细胞凋亡水平结果显示,与对照组比较,模型组细胞凋亡率增加(P<0.05);与模型组比较,模型+Twinfilin-1过表达组细胞凋亡率降低(P<0.05),而模型组+pc DNA空载体组无明显变化(P>0.05),见图3。

图3 Twinfilin-1过表达对细凋亡殖的影响Figure 3 The effect of overexpression of twinfilin-1 on apoptosis注:Ⅰ.流式细胞术检测细胞凋亡水平,Ⅱ.各组细胞凋亡率的比较;A.对照组,B.模型组,C.模型组+pc DNA空载体组,D.模型+Twinfilin-1过表达组;与对照组比较,①P<0.05;与模型组比较,②P<0.05
2.4 Twinfilin-1过表达对凋亡相关蛋白水平的影响 蛋白印迹检测凋亡相关蛋白水平结果显示,与对照组比较,模型组细胞中Bax/Bcl-2、cleaved cas9/cas9及cleaved cas3/cas3水平增加(P<0.05);与模型组比较,模型+Twinfilin-1过表达组Bax/Bcl-2、cleaved cas9/cas9及cleaved cas3/cas3水平降低(P<0.05),而模型组+pc DNA空载体组无明显变化(P>0.05),见图4。
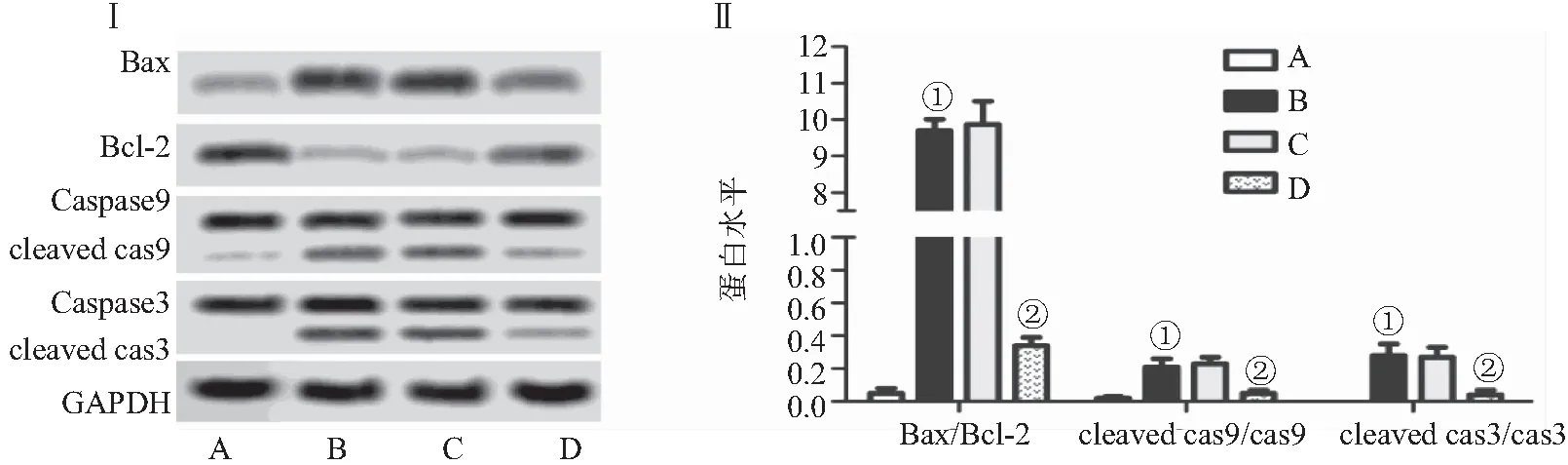
图4 Twinfilin-1过表达对凋亡相关蛋白水平的影响Figure 4 Effect of twinfilin-1 overexpression on the expression of apoptosis related proteins注:Ⅰ.蛋白印迹检测凋亡相关蛋白水平,Ⅱ.各组细胞中Bax/Bcl-2、cleaved cas9/cas9及cleaved cas3/cas3水平的比较;A.对照组,B.模型组,C.模型组+pc DNA空载体组,D.模型+Twinfilin-1过表达组;与对照组比较,①P<0.05;与模型组比较,②P<0.05
2.5 Twinfilin-1过表达对细胞线粒体膜电位的影响 流式细胞术检测细胞线粒体膜电位的变化结果显示,与对照组比较,模型组细胞线粒体膜电位降低(P<0.05);与模型组比较,模型+Twinfilin-1过表达组线粒体膜电位升高(P<0.05),而模型组+pc DNA空载体组无明显变化(P>0.05),见图5。
图5 Twinfilin-1过表达对细胞线粒体膜电位的影响Figure 5 Effect of twinfilin-1 overexpression on mitochondrial membrane potential注:Ⅰ.流式细胞术检测细胞线粒体膜电位的变化,Ⅱ.各组细胞线粒体膜电位的比较;A.对照组,B.模型组,C.模型组+pc DNA空载体组,D.模型+Twinfilin-1过表达组
3 讨论
镉在体内半衰期长达30~40年,且极易在人体内积聚,具有严重的致畸性和致癌性[8]。人体镉暴露后,主要表现为肠胃炎、肝功能异常、肾炎和骨质疏松等;肾脏被认为是镉毒性的主要靶器官,其毒性损伤影响机制尚无定论[9]。研究显示,电镜下观察肾细胞形态发现,随着镉浓度的增加,肾细胞的凋亡率也升高[10]。活性氧所致的氧化应激损伤,被认为是造成肾细胞凋亡的重要环节,镉可作用于线粒体产生大量活性氧,并抑制抗氧化系统酶活性,大量活性氧的堆积将破坏线粒体膜的通透性,引起线粒体膜电位下降,最终导致肾脏细胞的凋亡[11]。同时,脂质过氧化终产物丙二醛可生成聚合物,与人体内蛋白质、脱氧核糖核酸发生反应,从而诱发细胞凋亡[12-13]。另外,镉对巯基有高亲和力,其与巯基蛋白结合,进而致线粒体膜功能紊乱,释放凋亡诱导因子而引起细胞凋亡[14]。
Twinfilin-1普遍存在于植物细胞以外的所有真核细胞中,可调控胞内弹性纤维的长度与排序,对于维持细胞形态、细胞结构、能量转换、细胞增殖、凋亡等动态运动有重要作用[15]。Li等[16]研究显示,Twinfilin-1在牛乳腺上皮细胞中受氨基酸和激素的诱导,可通过mTOR通路调控乳汁的生物合成和牛乳腺上皮细胞增殖。Sun等[17]研究发现,miR-30c可靶向抑制Twinfilin-1,抑制胰腺癌细胞增殖,并诱导其凋亡。本研究探讨了Twinfilin-1在镉诱导肾细胞重金属中毒发生中的作用,以LLC-PK1细胞为研究对象,经镉处理后发现细胞中Twinfilin-1表达下调,同时,细胞增殖、凋亡检测结果表明,Twinfilin-1过表达后可明显逆转镉诱导的肾细胞增殖能力降低、凋亡率升高及线粒体膜电位下降。推测Twinfilin-1可能是镉诱导肾细胞重金属中毒发生中的一个关键因素。
细胞凋亡过程涉及到凋亡相关蛋白表达的改变,Bcl-2蛋白家族是线粒体膜蛋白,Bax/Bcl-2是启动细胞凋亡的分子开关,其激活内源性线粒体凋亡信号通路,将引起线粒体因子的释放,进而活化Caspase蛋白家族,最终启动细胞凋亡[18-20]。进一步在蛋白分子水平探索Twinfilin-1过表达后引起凋亡/增殖失衡的机制结果显示,与模型组比较,Twinfilin-1过表达组Bax/Bcl-2、cleaved cas9/cas9及cleaved cas3/cas3水平降低,提示Twinfilin-1过表达可能通过下调Bax/Bcl-2水平,抑制Caspase3、9的活化,减少镉诱导肾细胞凋亡,但Twinfilin-1是直接还是间接影响上述蛋白表达还不清楚,仍有待深入分析。
4 结论
Twinfilin-1过表达可能通过下调凋亡关键因子Bax/Bcl-2水平,抑制Caspase3、9的活化,减少细胞凋亡,维持正常线粒体膜电位,从而保护镉诱导肾细胞重金属中毒,这为镉中毒患者的临床治疗提供了一定的理论依据。

