生物催化氨基酸C—N裂解反应的研究进展
武耀运,陈城虎,宋 伟,胡贵鹏,刘 佳,吴 静
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 生命科学与健康工程学院,江苏 无锡 214122)
氨基酸的脱氨反应,即氨基酸脱去氨基生成对应的酮酸和氨,是一种典型的C—N裂解反应。C—N裂解反应是生物有机体重要的生化反应。目前能催化C—N裂解反应的酶主要包括:转氨酶(AT,EC 2.6.4.X)[1]、氨基酸脱氢酶(AADH,EC 1.4.1.X)[2]、氨裂解酶(AL,EC 4.3.1.X)和氨基酸脱氨酶(TD,EC 4.3.1.19[3];AAD,EC 1.4.3.X[4])。AT、AADH、AL与TD、AAD相比,其不同之处主要在于:1)AT、AADH和AL的分子量大多数要比TD、AAD偏大;2)AT、AADH和AL的酶学性质大多不如TD、AAD;3)AT、AADH和AL稳定性比TD、AAD弱。其中,AADH和AT催化的氨基酸C—N裂解反应存在:1)反应可逆且催化效率极低;2)需要添加高成本的氨基受体[5];3)产品分离纯化较复杂,难以达到工业化规模高产量、高转化率和低成本等特点。而AL催化的氨基酸C—N裂解反应往往专一性过强,难以广泛应用于催化氨基酸C—N的裂解反应。
氨基酸脱氨酶能催化不可逆的氨基酸C—N裂解反应,根据所需辅因子的不同,可分为:1)5'-磷酸吡哆醛(PLP)介导的氨基酸脱氨酶,代表酶为苏氨酸脱氨酶(TD,EC 4.3.1.19)[3];2)黄素腺嘌呤二核苷酸(FAD)介导的氨基酸脱氨酶,代表酶有L-氨基酸脱氨酶(LAAD,EC 4.3.1.2)[4,6-7]和L-氨基酸氧化酶(LAAO,EC 1.4.3.X)[8]。因此,在结合笔者课题组近几年在生物催化氨基酸C—N裂解反应研究的基础上,主要概述了氨基酸脱氨酶的研究进展,并总结了其参与多酶级联反应合成精细化学品中的应用,展望了生物催化氨基酸C—N裂解的反应。
1 PLP介导的氨基酸脱氨酶
TD是PLP介导的氨基酸脱氨酶代表酶[3],能催化L-Thr的α和β位消除—NH2和—OH发生C—N裂解反应,产生2-酮丁酸和氨,是合成2-氨基丁酸[9]、2-羟基酸[10]等药物中间体的关键酶。TD的缺陷在于底物范围较窄,对大体积非天然氨基酸底物催化效率较低[3]。因此,近年来研究人员致力于在结构解析、阐释催化机制的基础上,通过蛋白质工程改造,提升其催化性能。
Gallagher等[11]研究发现,来源于大肠杆菌(E.coli)的EcTD具有PLP的催化结构域和调控蛋白聚合的调控结构域,而来源于鼠伤寒沙门氏菌(S.typhimurium)[12]的StTD仅含催化结构域[12],两者催化结构域高度相似。进一步通过解析CgTD的催化机制[13]发现(图1):PLP会与CgTD Lys70位的Nε以席夫碱的形式共价连接生成中间体1,当底物开始反应时,L-Thr的Nα位会去亲核进攻1C4'生成中间体2,之后C4'处发生转亚胺反应,生成化合物3,然后化合物3会对L-Thr去质子化生成化合物4,再对化合物4的L-Thr醌类中间体的β-羟基进行消除,生成化合物5。在此基础上,Lys70位的Nε对5C4'再次进行亲和攻击,生成化合物6,化合物6通过转亚胺反应,重新生成中间体1,并释放出产物亚胺,在水环境下,亚胺自发水解生成α-酮酸[3]。基于这一机制,Song等[3]通过同源建模获得了来源于谷氨酸棒杆菌(C.glutamicum)的CgTD蛋白结构,经蛋白通道计算后发现了“门”结构,遂提出“开门”策略,并结合丙氨酸扫描、组合位点、定点及迭代饱和突变策略,对CgTD蛋白质进行工程改造后,获得了宽底物谱且能催化大体积的非天然氨基酸的最佳突变体M7,M7可用于生产天然和非天然α-酮酸,包括2-氧-丁酸(83.4 g/L,转化率99.0%)、苯丙酮酸(72.5 g/L,转化率95.0%)、2-氧-戊酸(21.1 g/L,转化率91.0%)和2-氧-4-苯丁酸(29.9 g/L,转化率84.0%)。

图1 CgTD催化α,β-脱氨反应机制
2 FAD介导的L-氨基酸脱氨酶
FAD介导的LAAD是一种膜依赖型脱氨酶[4,6-7],可催化C—N裂解反应生成相应的α-酮酸和氨(图2)。LAAD主要存在于普罗登菌属(Providenciasp.)[14]、摩尔根菌属(Morganellasp.)[4]及变形杆菌属(Proteussp.)[6]的细胞膜中,可与细胞膜上的电子传递链耦联,FAD的电子能通过电子传递链传递给细胞膜上的氧化型细胞色素b,使O2分子还原为H2O,因此该酶又被称为FAD介导的H2O生成型氨基酸脱氨酶。目前,研究主要集中于来源于Proteussp.的LAAD,根据其催化特点可分为两类:Ⅰ型LAAD主要是来源于含黏性变形杆菌(P.myxofaciens)[6]的PmaLAAD和奇异变形杆菌(P.mirabilis)[5]的PmirLAAD,可催化L-Leu、L-Met等大体积的脂肪族氨基酸及L-Phe、L-Trp等芳香族氨基酸,此外,PmaLAAD对极性的L-Cys也有活性,而对小体积的非极性或带电氨基酸活性较低[6]。而Ⅱ型LAAD主要来源于普通变形杆菌(P.vulgaris)[15]的PvLAAD和奇异变形杆菌(P.mirabilis)[16]的Pm1LAAD,更适合催化带电荷的L-His、L-Arg等碱性氨基酸和含硫的L-Met,但PvLAAD对大体积非极性底物(如L-Leu)也具有催化活性。从结构上来看,Ⅰ型的PmaLAAD(PDB:5fjn)[6]和Ⅱ型的PvLAAD(PDB:5hxw)[7]均为单体蛋白且两者结构高度相似,均包含跨膜区域、底物结合域(SBD)、FAD结合域(FBD)及插入模块。在此基础上,为了改善LAAD催化性能,研究人员对LAAD进行了系列蛋白质工程改造:1)增强底物结合效率。借助易错PCR和基因融合筛选[17],调整底物结合口袋使突变酶与底物的亲和力增加,比野生酶催化活性提高了6.6倍,(D/L)-4-Phe转化率为49.5%[18];2)提高催化效率。通过分子对接[19](图3)和进化保守性分析,在构建小而精突变文库的基础上获得最佳突变体,对L-1-萘丙氨酸(L-1-Nal)的催化效率比野生酶提高了7倍[19];对PmirLAAD的底物口袋、底物结合力和底物入口通道,进行理性改造,显著提高了苯丙酮酸(72.5 g/L,转化率96.0%)、α-酮异丁酸酯(107.1 g/L,转化率98.0%)和α-酮-β-甲基戊酸酯(98.9 g/L,转化率99.0%)的催化效率[20];3)提高稳定性。通过对PvLAAD表面的INS疏水残基进行定点突变,提高了溶液中的稳定性;4)提高产物转化率。通过易错PCR和定点饱和突变获得突变体,并敲除E.coli中的L-Phe降解途径,能将L-Phe转化为10 g/L苯丙酮酸,转化率为100%,进一步通过加强FAD合成,还原型辅因子(FADH2)/FAD再生,可使PPA产量增加到31.4 g/L[21];5)减少产物抑制。通过修饰PmirLAAD产物结合区域周围的柔性环获得4突变体PmLAADM4,突变体转化酮缬氨酸的产物抑制率比野生型降低6.7倍[22];6)拓展底物谱。通过蛋白质工程改造,缩短氢化物转移距离拓展了LAAD的底物谱,高效催化6种L-氨基酸的氧化脱氨,直接合成α-酮酸类化合物(产量>100 g/L,转化率>90.0%)[5]。

图2 FAD介导的H2O生成氨基酸脱氨酶的反应原理

图3 L-1-Nal与PmaLAAD分子对接[19]
3 FAD介导的L-氨基酸氧化酶
另一类FAD介导的脱氨酶是L-氨基酸氧化酶(LAAO),在催化L-氨基酸发生C—N裂解反应的同时,FADH2将O2氧化成H2O2,并生成α-酮酸和氨(图4)。LAAD的分类及其催化底物特异性[6,8,15,23]见表1。这一类酶广泛存在动物(如毒蛇、哺乳动物的肝脏肾脏等器官)[24]、真菌[25]、蓝藻[25]及细菌[25-28]中,不同来源的LAAO底物范围不同,因此分为广谱型和专一型两类。

图4 FAD介导的H2O2生成氨基酸脱氨酶反应原理
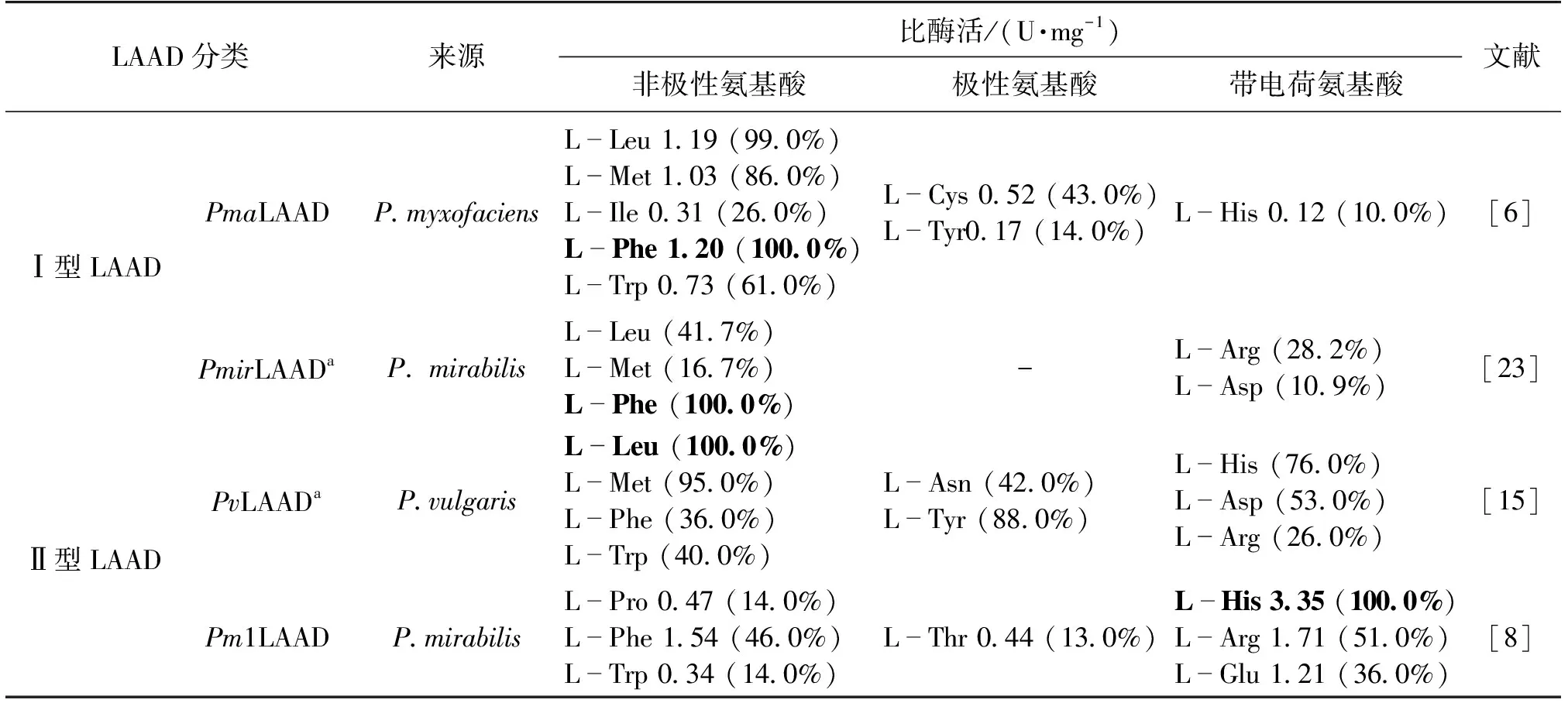
表1 LAAD分类及其催化底物特异性

专一型LAAO主要包括L-谷氨酸氧化酶(LGOX,EC 1.4.3.11)[30-31]、L-天冬氨酸氧化酶(LASPO,EC 1.4.3.16)[32]、L-精氨酸氧化酶(LAROD,EC 1.4.3.25)[33]及甘氨酸氧化酶(ThiO,EC 1.4.3.19)[34-35]等。这一类酶只能催化单一的L-氨基酸或者类似物的C—N裂解反应生成α-KG[31]、草酰乙酸[32]、2-酮精氨酸[33]、乙醛酸[35]以及氨和H2O2。目前对该类酶的研究主要包括: 1)通过核糖体结合位点(RBS)工程结合高密度发酵实现LGOX过表达,增加酶蛋白的产量,进而提升其发酵酶活力;2)通过包涵体复性的方式来提高E.coli表达LASPO的活性蛋白产量[32];3)发现并表征了Pseudomonassp.TPU 7192 来源的LAROD,鉴定其为FAD依赖型酶,并表明在不去除L-Arg氧化形成的H2O2的情况下,2-酮精氨酸会经过非酶催化转化为4-胍基丁酸[33];4)通过构建B.subtilis168菌株实现ThiO可溶性表达,并全细胞转化Gly生产乙醛酸[35]。此外,这些酶在催化反应过程中产生H2O2可被H2O2电极捕获,可用于临床检测、发酵生产、食品安全检测、L-氨基酸的定量分析、生物传感器、D/L-氨基酸的拆分等方面[30-31,36-37]。这些研究为解决L-谷氨酸氧化酶及L-天冬氨酸氧化酶表达量低这一难题提供了新的思路和方法,为对L-精氨酸氧化酶的结构及底物特异性机制解析、蛋白质工程改造与其催化氨基酸C—N裂解反应的应用奠定了基础。
除了上述酶外,目前已报道的底物专一性的H2O2生成型LAAO还有苯丙氨酸氧化酶[38]、色氨酸氧化酶[39]及赖氨酸氧化酶[40],这些酶可催化其专一性的底物生成对应的α-酮酸、氨和H2O2。与上述酶类似,该类酶的一个共性的问题是不易实现很好地异源表达,从而限制了该类酶在工业方面的应用。未来可以通过蛋白质工程策略实现这类酶的可溶性表达,加上结构及机制解析,使这类酶更好地发挥其功能。
4 氨基酸脱氨酶在多酶级联反应中的应用
多酶级联反应通过将多个酶进行组装,利用“一锅煮”的方法从廉价易得的底物出发,合成高价值目标产物。其中PLP介导的氨基酸脱氨酶主要集中在多酶级联生产L-2-氨基丁酸[9]、α-羟基酸(2-羟基丁酸)[3]及非天然α-酮酸[41]等产品;而FAD介导的氨基酸脱氨酶则主要集中在多酶级联生产天然α-酮酸[5]、D型氨基酸及其衍生物(D-Phe[42]、D-Tyr[43]、D-Trp及其对应的衍生物[44]、D-对羟基苯甘氨酸[45]和D-丹参素[46]等)、R/S-羟基酸(R/S-羟基蛋氨酸[47]、R/S-4-羟基苯基乳酸[48])、芳香醇[49-50]、7-氯吲哚-2-氨基丙酸[51]、α-氨基腈[52]、非天然α-氨基酸[52]和α-酮戊二酸[31]等产品(表2)。

表2 多酶级联反应生产精细化学品汇总
4.1 PLP介导的氨基酸脱氨酶在多酶级联反应中的应用
L-Thr脱掉侧链羟基后生成L-2-氨基丁酸(L-ABA),是合成抗癫痫药物的重要前体。但自然界中没有直接催化L-Thr形成L-ABA的酶,因此,研究者们设计了由TD、L-亮氨酸脱氢酶(LeuDH)和甲酸脱氢酶(FDH)组成的三酶级联路径(图5(a)),并通过构建共表达菌株、高密度发酵、全细胞转化等策略,生产L-ABA产量达到68.5 g/L,转化率为99.0%[9]。2-羟基丁酸(2-HB)是生产左乙拉坦和布拉西坦等抗癫痫药物的重要前体[41]。Yao等[10]通过构建SeD-LDH和OcL-LDH和EcTD、CbFDH三酶共表达菌株,实现了L-Thr转为78.0 g/L(R/S)-2-HB(图5(b)),其转化率≥90.0%,对映体过量(e.e.)值>99.0%[10]。非天然α-酮酸是精细化学合成中的重要组成部分,但目前缺乏用生物催化合成非天然α-酮酸的方法[41]。笔者所在的团队设计了一个CgTD和苏氨酸醛缩酶(TA)结合的双酶级联路径,将Gly和醛转化为9种多功能α-酮酸(图5(c)),从而建立了高效合成α-酮酸的平台[3]。
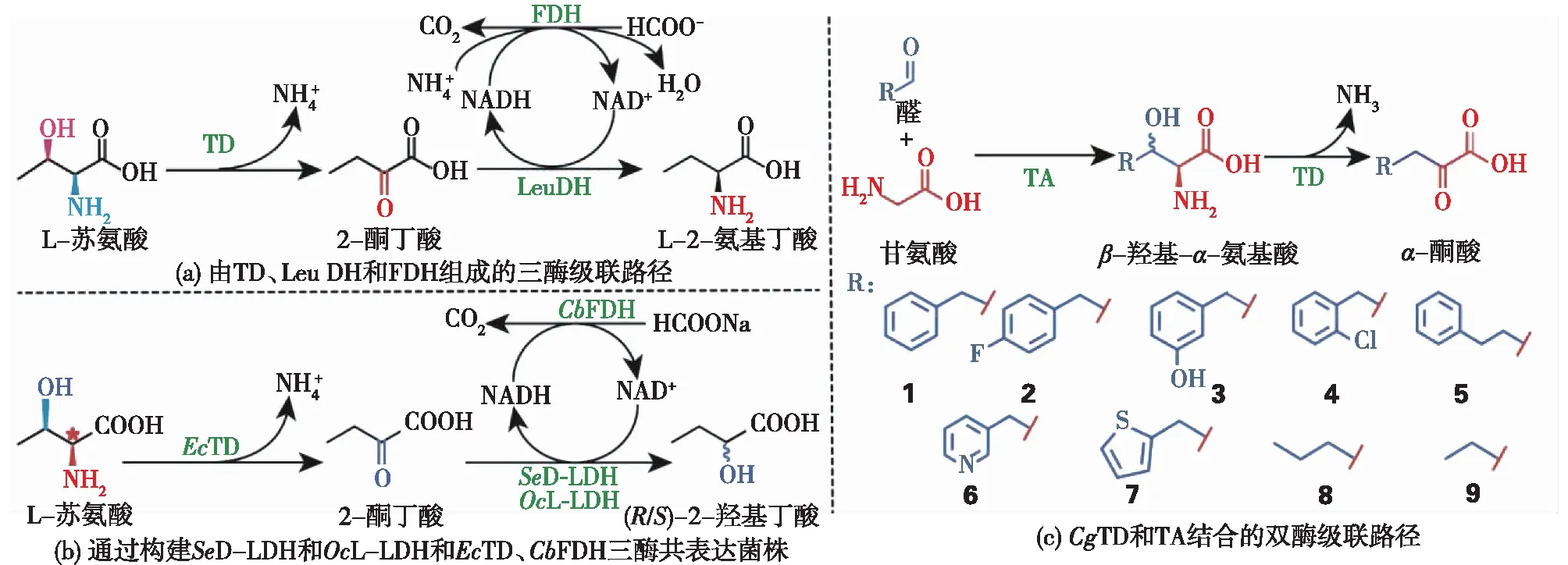
图5 PLP介导的氨基酸脱氨酶参与多酶级联反应
4.2 FAD介导的氨基酸脱氨酶在多酶级联反应中的应用
氨基酸脱氨酶广泛应用于催化L-型氨基酸合成D-氨基酸,典型案例包括: 1)由LAAD、内消旋-二氨基庚二酸脱氢酶(DAPDH)和葡萄糖脱氢酶(GDH)或甲酸脱氢酶(FDH)组成的三酶级联反应,催化α-氨基的构型翻转,用于催化合成D-Phe[42](产量57.8 g/L,转化率96.3%,e.e.值>99.0%,图6(a))和D-Tyr[43](产量18.1 g/L,转化率为45.3%,e.e.值>99.0%,图6(a));2)由苯丙氨酸裂合酶(PAL)[51]或色氨酸合成酶(TrpS)[44]、LAAD和D-氨基转移酶(DAAT)组成的级联反应用于合成不同的苯丙氨酸[53](图6(b))及色氨酸衍生物[44](图6(c));3)由LAAD、4-羟基扁桃酸合酶(HmaS)、(S)-扁桃酸脱氢酶(MDH)以及内消旋-二氨基庚二酸脱氢酶(DAPDH)四酶组成的级联反应可合成42.7 g/L D-对羟基苯甘氨酸(D-HPG)[45](转化率为92.5%,图6(d));4)由酪氨酸酚裂解酶(TPL)、LAAD、D-乳酸脱氢酶(DLDH)和葡萄糖脱氢酶(GDH)四酶组成的多酶级联反应以邻苯二酚和丙酮酸为原料,合成1.05 g/L D-丹参素(D-DSS)[46](图6(e))。

图6 FAD介导的氨基酸脱氨酶参与多酶级联反应生成D-Phe、D-Tyr、D-色氨酸衍生物、D-苯丙氨酸衍生物及D-丹参素
FAD介导的氨基酸脱氨酶可用于合成羟基蛋氨酸[47]及羟基苯基乳酸[48],如由LAAD、D/L-LDH和FDH组成的级联反应(图7(a))催化L-蛋氨酸合成羟基蛋氨酸(2-羟基-4-甲硫基丁酸)[47],该级联反应的第一阶段酮蛋氨酸转化率为99.6%,第二阶段(R/S)-羟基蛋氨酸的转化率及e.e.值均大于95.8%[47]。而以L-Tyr 为底物,通过LAAD、D/L-HicDH和FDH组成的级联催化路线(图7(b)),可生成(R/S)-4-羟基苯基乳酸(4-HPLA),转化率及e.e.值均大于98.0%[48]。同样以L-Tyr 为底物,由LAAD、丙酮酸脱羧酶(PDC)、乙醇脱氢酶(ADH)和GDH组成的级联反应则催化生成酪醇[49](图8(a)),32 h总产量能达到35.7 g/L,转化率为93.6%[49]。另一研究案例是以L-Phe或L-Tyr为底物,由LAAD、羟杏仁酸合成酶(HmaS)、(S)-扁桃酸脱氢酶(MDH)、苯甲酰甲酸脱羧酶(BFD)和苯乙醛还原酶(PAR)组成的五酶级联路线,可催化生成苯甲醇[50]或4-羟基苄醇[50](图8(b)),最终转化率分别为99.0%和93.6%。
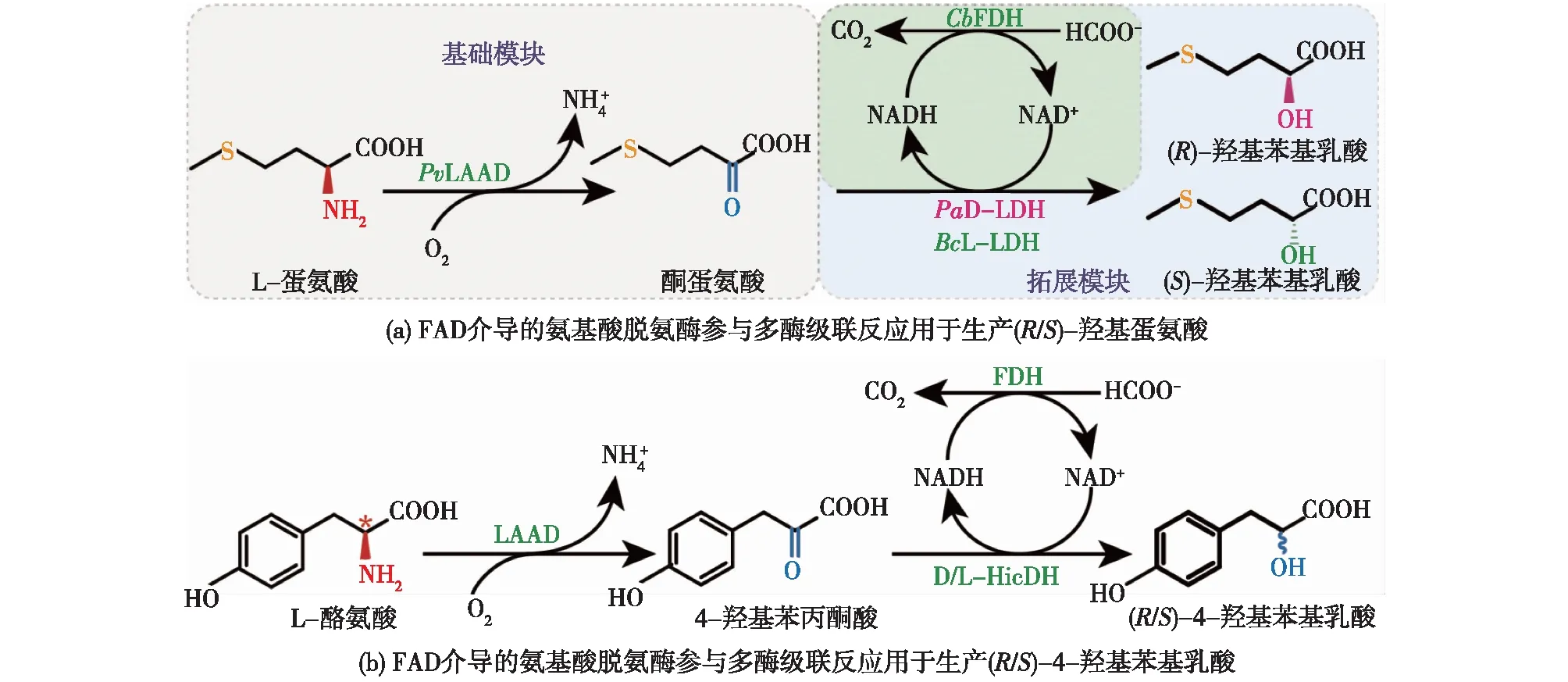
图7 FAD介导的氨基酸脱氨酶参与多酶级联反应用于生产(R/S)-羟基蛋氨酸及(R/S)-4-羟基苯基乳酸

图8 FAD介导的氨基酸脱氨酶参与多酶级联反应用于生产酪醇、苯甲醇及4-羟基苯甲醇
4.3 FAD介导的氨基酸氧化酶在多酶级联反应中的应用
FAD介导的氨基酸氧化酶可用于合成蝴蝶霉素前体7-氯吲哚-2-氨基丙酸、α-氨基腈、非天然α-氨基酸和α-酮戊二酸,主要案例包括: 1)以L-Trp为底物由色氨酸-7-卤化酶(Trp 7-halogenase)和LAAO级联反应生成7-氯吲哚-2-氨基丙酸,7-氯吲哚-2-氨基丙酸经进一步的生物合成步骤可生成蝴蝶霉素,7-氯吲哚-2-氨基丙酸转化率>90.0%[52](图9(a));2)以苯丙氨酸为底物使用氨基酸氧化酶与化学HCN水解反应级联合成α-氨基腈,然后α-氨基腈在氰水解酶AY487533的催化下合成非天然α-氨基酸-2EtPG产量为28.6 g/L,转化率达73.0%[53](图9(b));3)以L-Glu为底物将LGOX和Kcat耦联生产α-酮戊二酸,产量达103.1 g/L,转化率为 94.6%[31](图9(c))。
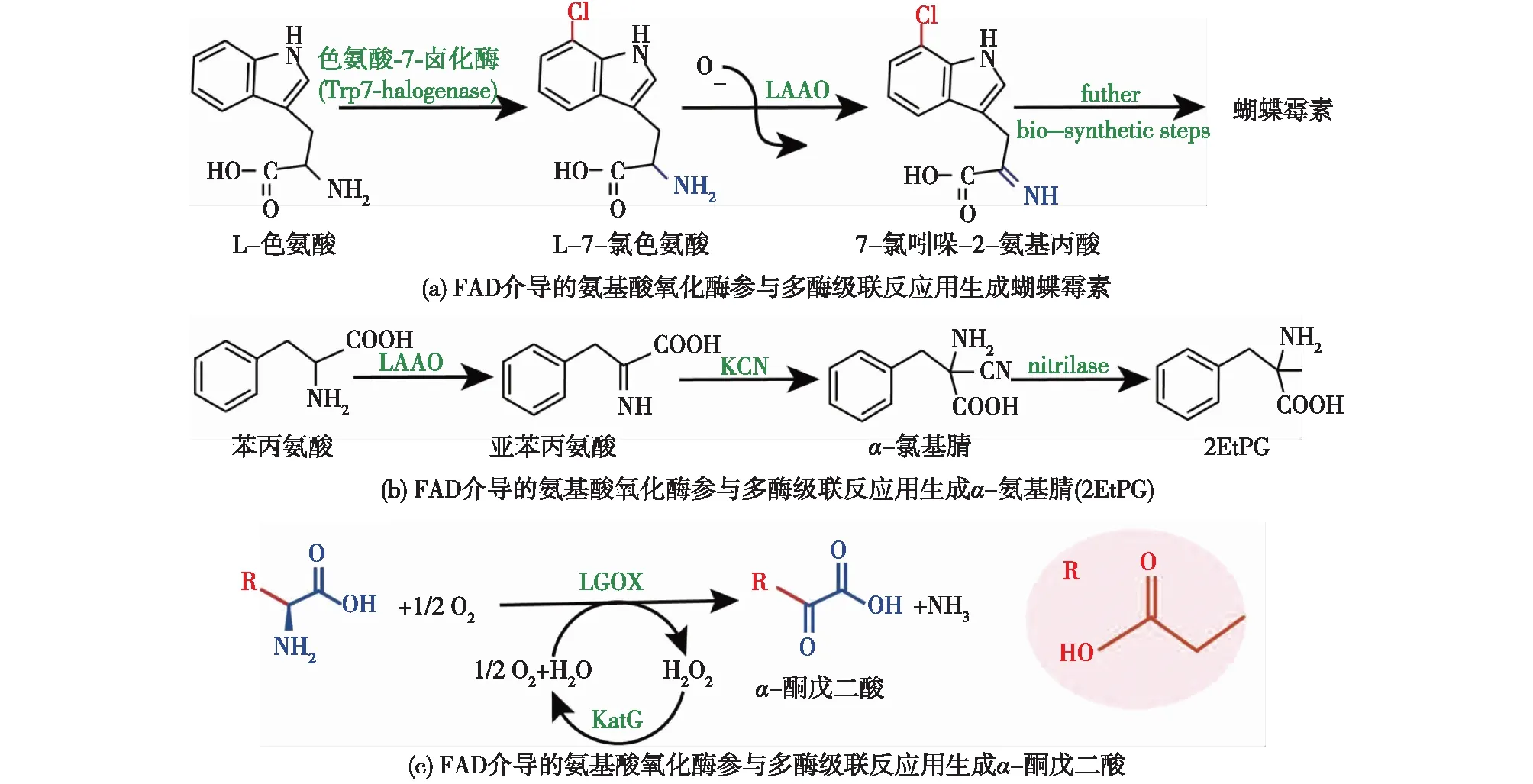
图9 FAD介导的氨基酸氧化酶参与多酶级联反应生成蝴蝶霉素、α-氨基腈(2EtPG)和α-酮戊二酸
5 结论与展望
针对氨基酸脱氨酶催化氨基酸C—N裂解脱氨反应相关研究,国内外的研究进展主要体现在2个方面:一是PLP介导的苏氨酸脱氨酶的结构解析、机制解析、蛋白质工程改造及其在多酶级联中的应用;二是FAD介导的氨基酸脱氨酶和氨基酸氧化酶的表达、蛋白质工程改造及其在多酶级联反应中的应用。然而,由于氨基酸脱氨酶/氧化酶自身在原核生物中表达量低、三维结构及其催化机制不够清晰、催化效率低、底物范围窄,转化过程条件繁多且复杂等瓶颈问题,导致多酶级联反应路线合成的目标产物产量、产率和生产强度较低。因此,为了提高氨基酸脱氨酶/氧化酶的催化性能,今后的研究需要:1)利用X线衍射及冷冻电镜等技术解析氨基酸脱氨酶/氧化酶三维晶体结构并借助动力学模拟、量子力学及密度泛函理论,解析酶催化机制;2)通过蛋白质工程改造策略对氨基酸脱氨酶/氧化酶进行理性改造,提高其催化性能;3)深入研究酶固定化技术,降低生产成本,为实现氨基酸C—N裂解的工业化应用奠定坚实基础。并将前述研究中涉及的重要新技术的革新意义延伸到生物催化领域中,主要包括:使用冷冻电镜解析蛋白结构新技术的革新指向结构生物学方向;利用计算化学解析催化机制指向理论生物化学计算方向;蛋白质理性改造新技术指向构建小而精的突变文库进而推进蛋白进化方向;酶固定化新技术为今后生物催化领域提出经济化应用的方向。

