超高效液相色谱-串联质谱法快速测定小麦中黄曲霉毒素B1
高晓芳,胡婷婷,洪 冰,弓浩然,郑婷婷,董磅礴,苏淼冉
(郑州市粮食科学研究所,河南 郑州 450001)
小麦在储存过程中因储存方式不当会导致黄曲霉毒素污染[1]。据报道[2],温度30 ℃、相对湿度80%、谷物水分在14% 以上的条件最适合黄曲霉繁殖和生长,并且在24~34 ℃,黄曲霉的产毒量最高。研究表明,黄曲霉毒素具有肝脏毒性[3-4],并且具有免疫抑制作用[5],是一种能够致癌、致畸、致突变的真菌毒素,被世界卫生组织(WHO)癌症研究机构确定为1A类致癌物,受到了全世界各个国家的广泛关注[6-7]。目前报道的黄曲霉毒素有20多种,其中黄曲霉毒素B1最为常见。为了保障谷物及其制品的安全,国际食品法典委员会(CAC)、欧盟、美国等均制定了粮食中真菌毒素限量标准[8],我国也在GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》中对黄曲霉毒素的限量标准作了明确的规定,每1 kg小麦中黄曲霉毒素B1不得超过5 μg[9]。目前,GB 5009.22—2016推荐的黄曲霉检测方法主要有同位素稀释液相色谱-串联质谱法、高效液相色谱-柱前衍生法、高效液相色谱-柱后衍生法和酶联免疫吸附法。其中,高效液相色谱-荧光检测法(HPLC-FLD法)是最常用的方法[10-11],但此方法操作比较繁琐,并且耗时长。本文采用同位素稀释液相色谱-串联质谱法对黄曲霉毒素B1进行检测,并且对直接稀释法和免疫亲和柱纯化法两种前处理方法的检测结果进行比较,以期建立一种快捷、便利的同位素稀释液相色谱-串联质谱法检测黄曲霉毒素B1的方法。
1 材料与方法
1.1 仪器
I-Class/XEVO TQ-S型超高液相色谱仪-三重串联四级杆质谱仪联用仪:WATERS公司;MLI104型水分磨:法国Chopin公司;PL-2002型电子天平(1/100):瑞士梅特勒-托利多公司;TGL-10C型高速台式离心机:上海市安亭电子仪器厂。
1.2 样品
小麦:郑州市库存小麦。
1.3 试剂
黄曲霉毒素B1标准品(纯度≥98%):农业农村部环境保护科研监测所;同位素内标13C17-黄曲霉毒素B1(纯度≥98%):坛墨质检科技股份有限公司;乙腈(色谱纯)、甲醇(色谱纯):美国默克公司;乙酸铵(色谱纯)、甲酸(色谱纯):天津市科密欧化学试剂有限公司。
1.4 溶液制备
1.4.1 标准溶液配置
(1)中间标准工作液:取适量黄曲霉毒素B1母液(2 μg/mL),用甲醇稀释,得到质量浓度为100 ng/mL的黄曲霉毒素B1中间标准工作液。
(2)同位素内标工作液:取适量同位素内标13C17-黄曲霉毒素B1(0.5 μg/mL),用甲醇稀释至100 ng/mL。
(3)标准系列工作溶液:准确移取黄曲霉毒素 B1中间标准工作液(100 ng/mL) 10、50、100、200、500、800、1 000 μL至10 mL容量瓶中,加入200 μL 100 ng/mL的同位素内标工作液,用初始流动相定容至刻度,配制质量浓度为0.1、0.5、1.0、2.0、5.0、8.0、10.0 ng/mL的系列标准溶液。
1.4.2 待测样品溶液制备
取样量1 kg,用高速粉碎机将其粉碎,过筛(粒径小于2 mm)。称取5 g试样(精确至0.01 g)于50 mL离心管中,加入100 μL同位素内标工作液,振荡混合后静置30 min。加入20.0 mL乙腈—水溶液(84+16),置于涡旋振荡器中振20 min,6 000 r/min离心10 min,玻璃纤维滤纸过滤,取上清液备用。
1.5 试样的净化
准确移取4 mL上清液,加入46 mL水,混匀,上免疫亲和柱,用2×10 mL水淋洗柱子,然后用1 mL甲醇洗脱亲和柱,收集全部洗脱液至试管中,并在50 ℃下氮吹至近干,加入1.0 mL初始流动相,涡旋1 min溶解残留物,0.22 μm有机滤膜过滤后上机。
1.6 超高效液相色谱-串联质谱条件的选择及优化
1.6.1 液相色谱条件
色谱柱:Waters ACQUITY UPLC BEH C18(2.1×50 mm,1.7 μm);柱温:40 ℃;流动相:盐溶液(A),含0.1%甲酸的4.0 mmol/L乙酸铵溶液,甲醇(B);流速:0.3 mL / min;进样量:5 μL。梯度洗脱程序见表1。
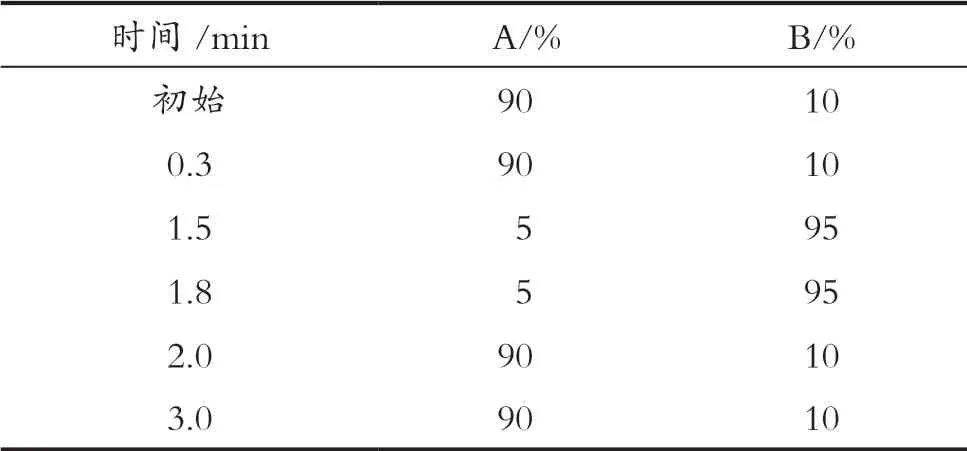
表1 UPLC梯度洗脱程序
1.6.2 质谱条件
(1) 离子源控制条件:离子源为电喷雾离子源(ESI);检测方式为ESI+,MRM多反应监测模式;毛细管电压2.5 kV;锥孔电压40 V;离子源温度150 ℃;锥孔反吹气流量150 L/h;雾化气温度450 ℃;质谱接口温度(HSID)280 ℃。
(2) 离子参数优化:将黄曲霉毒素B1的标准储备液用甲醇稀释定容至1 μg/mL,通过色谱柱-质谱进样法,分别评估正、负离子模式下黄曲霉毒素B1的电离情况。结果显示,在正离子模式下,黄曲霉毒素B1有较好的响应,并采用正离子模式优化质谱条件参数,参数优化结果见表2。

表2 离子选择参数表
2 结果与分析
2.1 相关系数和线性范围检测
配置质量浓度为0.1、0.5、1.0、2.0、5.0、8.0、10.0 ng/mL的黄曲霉毒素B1系列标准溶液,在确定的液质联用检测条件下进行测定,在1.72 min时检测到目标峰,总离子色谱图见图1。以黄曲霉毒素B1色谱峰与13C17-黄曲霉毒素 B1色谱峰的峰面积比值为纵坐标,黄曲霉毒素 B1质量浓度为横坐标进行线性回归。实验结果表明,黄曲霉毒素B1在0.1~10.0 ng/mL的质量浓度范围内线性关系良好,线性方程:If=1.777c + 0.005 23,其相关系数R2为0.999 7,标准曲线见图2。
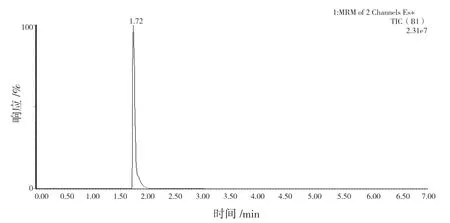
图1 总离子色谱图

图2 标准曲线
2.2 检出限和定量限
将空白小麦样品独立测试10次,样品空白平均值加上3倍的标准偏差确定方法的检出限(LOD)为0.004 μg/kg,样品空白平均值加上10倍的标准偏差确定方法的定量限(LOQ)为0.01 μg/kg。检出限与定量限均小于标准规定的检出限与定量限要求,能够满足小麦中黄曲霉毒素B1的检测要求[12]。
2.3 精密度和正确度(回收率)
选取不含黄曲霉毒素B1的小麦样品进行精密度和加标实验,分别在空白样品中添加不同浓度的标准溶液,使黄曲霉毒素B1最终浓度分别为0.1、4.5、9.0 μg/kg,在同样 的 液 质联用检测条件下进行测定。其相对标准偏差和回收率结果见表3。由表3可知,3个浓度水平的相对标准偏差为0.30%~11.50%,加标回收率为91.7%~100.9%,符合GB/T 27404附录F的要求。

表3 小麦中黄曲霉毒素B1的相对标准偏差和加标回收率
2.4 直接稀释法和免疫亲和柱纯化法对检测结果的影响
考虑到免疫亲和纯化法耗时长、费用高,且小麦基质中物质比较单一,杂质少、干扰少的特点,在前处理中,采用将提取液直接稀释后上机检测的方法,即准确转移4 mL提取液于另一15 mL离心管中,加入4 mL水,涡旋混匀后,6 000 r/min离心5 min,吸取上清液过0.22 μm有机滤膜后上机检测,并对两种前处理方法的结果进行比较,结果见表4。由此可知,直接稀释法检测结果的精密度为3.49%,回收率为93.8%,免疫亲和柱纯化法检测结果的精密度为3.10%,回收率为92.2%,采用两种不同前处理方法的检测结果均符合GB/T 27404附录F的要求。
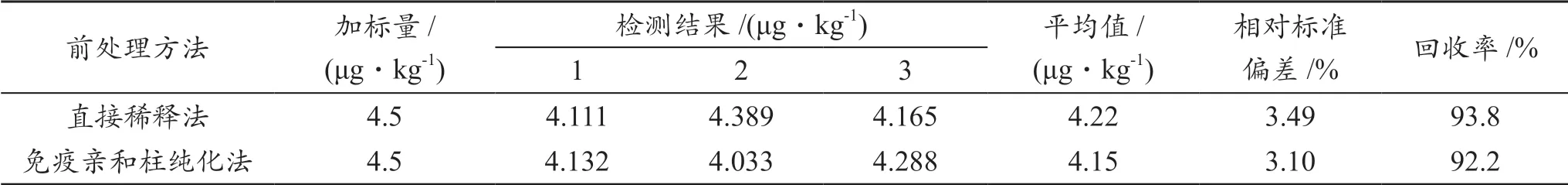
表4 两种前处理方法的检测结果比较
直接稀释法相较于免疫亲和柱纯化法更节省时间,节约成本,且减少了前处理过程中目标化合物的损失,因此直接稀释法更适合大批量样品的检测。
3 结 论
本实验基于GB 5009.22—2016中黄曲霉毒素B1检测方法——同位素稀释液相色谱-串联质谱法,并对样品的前处理方法、色谱及质谱条件作了优化,建立了快速准确定量分析小麦中黄曲霉毒素B1的同位素稀释液相色谱-串联质谱法。还考察了该方法的相关系数和线性范围,检测了方法的检出限和定量限,并通过加标回收试验检测了方法的精密度和准确度,结果均符合GB/T 27404附录F的要求,满足实验室快速、准确定量分析大批量小麦中黄曲霉毒素B1的检测需求。

