细胞外囊泡在肿瘤靶向治疗中的作用及应用
张宁 ,谢姝钰 ,常国欣,陈延 ,王岩,张静,邱宏
(1.中国科学院上海药物研究所糖类药物研究中心,上海 201203;2.中国科学院大学药学院,北京100049;3.南京中医药大学新中药学院,江苏 南京210023;4.广东药科大学中药学院,广东 广州510006;5.华南理工大学化学与化工学院,广东省功能分子工程重点实验室,广东 广州510640;6. 广州中医药大学青蒿研究中心,广东 广州510405)
细胞外囊泡(extracellular vesicles,EVs)已被证实可以介导细胞间短程和远程通讯[1-2],参与肿瘤、心血管疾病、神经退行性疾病和代谢性疾病等疾病的发生、发展,具有作为疾病诊断标志物、治疗药物、药物靶标和药物载体的潜能[3-6]。细胞可以通过多种生成途径生成和释放EVs,但囊泡一经释放,其生成途径便难于追踪[7]。目前,尚无有效的分离方法和明确的分子标志物可以区分不同生成途径产生的囊泡,这使得难以比较和重复不同实验室报道的EVs研究结果,也难以确定不同生成途径形成的囊泡功能差异[8-9]。此外,EVs的命名尚无统一标准[9]。肿瘤EVs在肿瘤发生、发展中主要起两方面的作用:一是促进肿瘤的生长;二是帮助建立促肿瘤转移微环境,促进肿瘤转移[10-11]。哺乳动物EVs在肿瘤发生、发展中的作用及诊疗方面的应用研究最为深入,细菌等微生物囊泡在肿瘤发生、发展中的作用逐渐受到关注[10-11]。EVs作为治疗药物和药物输送载体,目前面临最大的问题是如何重复大量的获得[3]。食用植物和中草药来源的囊泡可以通过多种机制发挥抗肿瘤作用,这些囊泡相对容易重复获得,而且安全,它们的抗肿瘤作用机制和药物递送作用因而受到极大关注[12-13]。本文简介哺乳动物EVs、细菌EVs和植物EVs的生成、定义、特征、制备、表征、摄取和体内分布与代谢,重点综述这些囊泡在肿瘤靶向治疗中的作用和应用及其工程化改造策略的研究进展、存在问题,展望EVs在肿瘤靶向治疗中的应用前景。
1 细胞外囊泡与肿瘤的发生、发展
1.1 细胞外囊泡的生成、定义和特征
EVs是一种由细胞产生的纳米级颗粒,介导细胞之间的短程与长程通讯,参与不同生理和病理过程的调控[14]。1946年,Chargaff等[15]研究凝血时发现,高速离心所得的粒子样沉淀物可以缩短血浆的凝血时间,首次观察到了具有生物活性的EVs。Wolf[16]在1967年首次用电镜表征了这些粒子样沉淀的形态,并将其定义为“血小板尘埃”。随着对EVs的了解逐渐深入,研究者根据EVs生成途径的不同将EVs分为外泌体(exosome)、微囊泡(microvesicle)和凋亡小体(apoptotic body)。在细胞中,早期内体(early endosome)向内凹陷,包裹胞质溶胶(cytosol)中的许多物质,形成腔内囊泡(intraluminal vesicle),这时早期内体发展为晚期内体(late endosome)即多囊泡体(multivesicular bodies,MVBs), 当 MVBs向 细胞质膜移动并与之融合时,释放出的囊泡为外泌体,其粒径一般为30 ~ 200 nm[17];细胞质膜向外出芽直接从细胞质膜脱落产生的囊泡称为微囊泡,其粒径一般为100 ~ 1 000 nm[18]。与外泌体和微囊泡不同,凋亡小体是在细胞凋亡过程中形成,粒径一般在1 000 ~ 5 000 nm[19]。目前的技术手段无法分离不同生成途径产生的囊泡[20]。根据2018年国际细胞外囊泡协会的指南,通常将EVs按粒径大小进行分类[21],200 nm及以下的囊泡称为小细胞外囊泡(small extracellular vesicles,sEVs),是目前研究的主要囊泡类型;大于200 nm的囊泡称为中/大细胞外囊泡(见图1)。EVs主要由脂质、蛋白质、核酸和小分子代谢物组成。虽然不同来源的EVs蛋白质组成有所差异,但是哺乳动物来源的囊泡一般均表达肿瘤易感基因101蛋白(tumor susceptibility gene 101,TSG101),凋亡连接基因2作用蛋白X(apoptosis linked gene 2 interacting protein X,ALIX),四次跨膜蛋白(tetraspanin)家族CD9、CD63和CD81等蛋白质,这些蛋白质可作为EVs的生物化学特征标志物[7,22]。EVs也表达ATP酶、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和丙酮酸激酶(pyruvate kinase,PK)等多种酶、主要组织相容复合物(major histocompatibility complex,MHC)-Ⅰ和 MHC-Ⅱ及热休克蛋白[7,22]。
1.2 细胞外囊泡的分离、纯化和表征
EVs的分离纯化技术主要包括超速离心法(ultracentrifugation,UC)[23]、聚合物沉淀法(polymer precipitation)[24]、 切向流过滤 法(tangential flow filtration,TFF)[25]、非对称场流(asymmetric flow field fractionation,AF4)[26]、尺寸凝胶排阻色谱(size exclusion chromatography,SEC)[27]、免疫亲和层析(immunoaffinity chromatography)[28]。一般 UC所得的囊泡纯度要高于SEC所得的囊泡纯度,但是后者的囊泡产量更高[29]。TFF可以处理大量样品,而且所得样品的纯度与UC所得样品的纯度接近。总之,上述方法均有一定局限性,虽然可以分离出具有某些特性的EVs群体,但很难实现外泌体和微囊泡之间的完全分离。因此,EVs分离纯化的具体条件在研究EVs的功能时非常重要。为方便不同实验室结果的比较和促进EVs研究的标准化,目前有研究者提出以EV-TRACK这一系统报告EVs的分离纯化具体参数和特征[8,30]。
1.3 细胞外囊泡的转运、摄取和体内分布与代谢
EVs的释放、转运、摄取和体内生物分布与代谢是研究其生物学功能的基础。在进行这些研究时,通常使用荧光分子或放射性同位素标记EVs[31]。EVs被供体细胞释放后转运至靶细胞,可以被靶细胞经由网格蛋白[32]、小窖蛋白或脂筏介导的胞吞[33],吞噬[34]和胞饮(巨胞饮、微胞饮等)等不同内吞机制摄取[35];也可与细胞膜融合将其内含物释放至靶细胞的胞质溶胶[36]。EVs进入细胞的途径可以通过使用各种内吞途径的特异性抑制剂或遗传学方法确定[37]。EVs内吞一般通过其表面分子与靶细胞受体相互作用实现,如囊泡表面的末端唾液酸和受体细胞表面硫酸乙酰肝素蛋白聚糖,均为内吞的分子媒介[38-39]。EVs与靶细胞质膜的融合也需要通过囊泡与质膜上的配体-受体相互作用实现。比如,单核细胞/巨噬细胞产生的囊泡通过囊泡表面的P-选择素糖蛋白配体,与血小板表面的P-选择素结合启动囊泡与细胞的融合[36]。EVs在被靶细胞摄取之后,多数进入内体和(或)溶酶体释放其内含物,但这与细胞内的pH和脂质种类有关[40-41]。内体和(或)溶酶体pH的中性化和胆固醇增加能够抑制囊泡与内体质膜的融合和内含物的释放[40-41]。受体细胞摄取EVs的效率较低,1 h内自发性摄取率仅为1%,但摄取的囊泡30%会被释放到胞质溶胶[42]。最近也有研究发现,EVs在内吞进入内体之后会通过晚期内体与核膜融合,将内含物释放至核浆中,这一过程由RAB7、囊泡相关膜蛋白相关蛋白A(vesicular associated membrane protein associated protein,VAP-A)和氧化甾醇结合蛋白相关蛋白3(oxysterol binding protein related protein 3,ORP3)形成的复合物介导[43]。美国食品和药品管理局(Food and Drug Administration,FDA)批准的药物伊曲康唑(itraconzale)和小分子PRR851可以抑制这一过程(见图1)[44]。

图1 细胞外囊泡的生成、释放、转运、摄取和装载货物的释放Figure1 Biogenesis, release, trafficking, uptake and cargo release of extracellular vesicles
EVs在体内的代谢分为2个过程:快速的分布期(distribution phase)与较长的肝和肾清除期(elimination phase)[45]。研究显示,EVs经小鼠尾静脉注射24 h后在肝、脾、肺和胃肠道中潴留最多,EVs的供体细胞类型和给药途径的改变均会影响EVs的生物分布[45]。Smyth等[46]研究发现,标记的EVs、人工合成脂质体与由EVs衍生的脂质体体内生物分布和清除率类似。未进入受体细胞的EVs可以通过多种机制被降解清除,比如,巨噬细胞等免疫细胞和内皮细胞通过吞噬作用,摄取循环血液中的肿瘤EVs并将其降解[47-48]。生物来源或人工合成的EVs在肝脏中很容易被迅速清除,限制了囊泡在靶细胞、靶组织或靶器官中的积累,而聚乙二醇(polyethylene glycol,PEG)修饰或使用肝摄取抑制剂可增加囊泡在体内的滞留时间[49]。EVs表达CD47和CD24等吞噬抑制分子,从而避免被吞噬降解[50]。表面表达CD47的受体信号调节蛋白α(signal regulatory protein α,SIRPα)的 EVs,可逃脱巨噬细胞的吞噬,从而提高生物稳定性和在体内的循环时间[51]。
1.4 细胞外囊泡在肿瘤发生、发展中的作用及机制
肿瘤的发生、发展是正常细胞经历一系列的转化,突破正常的生存和增殖限制,变成肿瘤细胞并从原发部位转移扩散的结果。肿瘤细胞的生存、生长和扩散依赖于肿瘤特征性功能的获得,功能包括细胞基因组的不稳定、促肿瘤炎症反应诱导、非突变性的表观遗传重编程、死亡抵制、细胞增殖信号的持续维持、肿瘤抑制基因逃避、细胞复制化永生赋能、血管生成诱导和(或)血管的可及、侵袭与转移激活、细胞代谢重编程和免疫监控逃逸等[52-53](见图2)。除了肿瘤细胞自身的改变,肿瘤细胞这些功能的获得也需要通过与肿瘤微环境的不同细胞如内皮细胞、周细胞(pericyte)、肿瘤浸润免疫细胞和肿瘤相关成纤维细胞相互通讯以相互赋能和相互驯化[52-53]。

图2 肿瘤的特征性功能Figure 2 Functional hallmarks of cancer
肿瘤细胞与其所处微环境细胞的相互赋能和相互驯化可以通过EVs的短程信息交流实现。2007年,Lötvall课题组研究发现,小鼠肥大细胞系MC/9、原代骨髓肥大细胞和人源肥大细胞系HMC-1产生的小EVs(文中以外泌体exosome出现)中含有信使核糖核酸(messenger ribonucleic acid,mRNA)和微小核糖核酸(microRNA,miRNA)等小核酸,但不含DNA;这些mRNA和miRNA在这些肥大细胞之间转运,而且供体细胞的mRNA运送至受体细胞之后能够被翻译成蛋白质[54]。小EVs作为细胞间信息交流介质这一重要现象在不同的生物系统被发现。比如,2010年3个不同的课题组分别发现,miRNA可以通过小EVs运送至免疫细胞[55]、内皮细胞[56]和肿瘤细胞[57];2008年表皮生长因子受体变体Ⅲ(epidermal growth factor receptor variantⅢ,EGFRvⅢ)也被发现可以被分选进入胶质瘤细胞产生的囊泡(文中称作微囊泡microvesicle),而且可以经由囊泡在不同细胞之间传送[57-58];2012年,Wnt蛋白也被报道可以通过小EVs实现远距离转运[59];2015年van Rheenen课题组以具有强转移能力的MDA-MB-231和弱转移能力的T47D移植瘤为模型发现,MDA-MB-231产生的小EVs(以前称作外泌体exosome)能转移至T47D细胞中,并改变T47D细胞行为,使其转移能力增强[60];同年Kalluri课题组研究发现,不同肿瘤细胞产生的小EVs中均含有磷脂酰肌醇锚定蛋白聚糖glypican-1,通过原位移植瘤和转基因小鼠胰腺瘤(Ptf1aCre/+LSL-KRasG12D/+TgfbrL/L,PKT)模型证实,小EVs中glypican-1可以作为胰腺癌的生物标志物,可区分胰腺癌与良性胰腺疾病和胰腺癌前体病变;而且作为标志物,glypican-1灵敏度显著高于常用的胰腺癌生物标志物CA19-9[61]。小EVs是肿瘤细胞和其所处环境不同细胞相互赋能和相互驯化以获得肿瘤特征性功能的物质媒介,也可以作为肿瘤诊断和预后的生物标志物[10,62]。
肿瘤细胞可以通过分泌小EVs抑制肿瘤免疫反应。肿瘤细胞能够分泌表达程序性死亡配体-1(programmed death ligand 1,PD-L1)的小 EVs,通过和CD8+T细胞表面程序性死亡受体-1(programmed death receptor-1,PD-1)结合,抑制CD8+T细胞的肿瘤细胞杀伤作用[63]。不同的肿瘤细胞分泌PD-L1的能力不一样,前列腺癌细胞PC-3和DU145要显著强于人源黑色素瘤细胞SK-MEL-28和前列腺癌细胞LNCaP,敲除PD-L1或小EVs生成的调控蛋白基因RAB27a均可抑制鼠源前列腺肿瘤细胞TRAMP-C2和结肠癌细胞WC38移植瘤的生长[63]。血浆和血浆来源的小EVs中的PD-L1水平,黑色素瘤患者要显著高于健康人,而且接种黑色素瘤细胞的小鼠也要高于不接种黑色素瘤细胞的正常小鼠[64]。干扰素-γ(interferon-γ,IFN-γ)处理能够增加囊泡中PD-L1的表达;血浆和血浆来源的小EVs中的PD-L1水平,对PD-1抗体治疗不响应的黑色素瘤患者高于对治疗有响应的患者[64]。
肿瘤侵袭和转移依赖在转移目标位点建立促肿瘤转移的微环境,原发部位的肿瘤细胞通过EVs转送物质驯化转移目标部位的内皮细胞、周细胞、免疫细胞和成纤维细胞等正常细胞,使这些细胞获得肿瘤特征性功能。EVs的这一远程信息交流作用已经有广泛研究。黑色素瘤细胞分泌的小EVs通过诱导骨髓前体细胞高表达MNNG HOS转化基因蛋白(MNNG HOS transforming gene,MET),将其驯化成促进血管生成和促进黑色素瘤细胞转移的表型CD45-c-KITlow/+TIE2+[65]。肿瘤分泌的小EVs可以促进血管生成相关基因的表达,促进血管/淋巴管内皮细胞生长、激活生长信号,促进肿瘤细胞与内皮细胞的黏附[66]。肿瘤分泌的小EVs也可以破坏血管屏障,促进肿瘤转移,比如乳腺癌细胞小EVs携带的miR105通过抑制血管内皮细胞黏附分子ZO-1的表达,从而破环血管屏障,促进乳腺癌细胞的转移[67]。由乳腺癌和肺癌患者的脑转移灶活组织分泌产生的EVs,表达Wnt相关蛋白-细胞迁移诱导和透明质酸结合蛋白(cell migration-inducing and hyaluronan binding protein,CEMIP),该蛋白可以在脑组织帮助建立促炎的血管微环境,促进肿瘤细胞的脑转移[68]。肿瘤细胞的EVs也可招募促进肿瘤发生、发展的巨噬细胞,在转移靶组织建立促转移微环境,比如胰腺癌EVs能够表达巨噬细胞迁移抑制因子(migratory inhibitory factor,MIF),招募肝组织特异性巨噬细胞样细胞Kupffer细胞,促进转化生长因子 β(transforming growth factor β,TGF-β)的分泌,进而促使肝星状细胞分泌纤维黏连蛋白(fibronectin),在肝建立促纤维化微环境,将巨噬细胞和中性粒细胞限制在肝,建立促肿瘤肝转移的微环境[69]。化疗也可以促进肿瘤细胞分泌促转移的EVs,通过建立促转移微环境来促进肿瘤转移,比如采用 10 mg · Kg-1紫杉醇(paclitaxel,PTX)治疗小鼠乳腺肿瘤病毒-多瘤病毒中等T抗原(mouse mammary tumor virus-polyoma virus middle T antigen,MMTV-PyMT)自发性小鼠乳腺癌和4T1乳腺癌细胞小鼠移植瘤,结果发现PTX可以通过促进肿瘤细胞分泌含有膜联蛋白A6(annexin A6,ANXA6)的EVs,从而促进肺部内皮细胞的激活,诱导C-C基序趋化因子配体2(C-C motif chemokine ligand 2,CCL2)的分泌和Ly6C+CCR2+单核细胞的扩增,促进促肿瘤肺转移灶的建立和肿瘤转移;接受PTX和阿霉素(doxorubicin,DOX)治疗的乳腺癌患者血浆来源的囊泡中ANXA6表达也显著增加[70]。肿瘤EVs上述作用的发挥需要这些囊泡能够被特异性地转运至相应的靶组织,这些肿瘤EVs表达的整合素分子是决定囊泡组织趋向性的关键分子,整合素 α6β4和 α6β1介导肺转移,而 αvβ5介导脑转移[71]。
2 不同来源细胞外囊泡在肿瘤靶向治疗中的作用及应用
EVs属于纳米粒,纳米粒可以通过高渗透长滞留效应(enhanced permeability and retention effect,EPR)实现肿瘤组织的被动靶向[72];同时也可以通过在EVs表面装载靶向性分子实现主动靶向。下文就哺乳动物产生的EVs、细菌囊泡和植物囊泡在肿瘤靶向治疗中的作用及应用做一介绍。
2.1 哺乳动物细胞外囊泡在肿瘤靶向治疗中的作用与应用
肿瘤细胞和其所处微环境的其他细胞可相互赋能和相互驯化,因此无论是肿瘤细胞来源的EVs还是非肿瘤细胞来源的EVs均可促进或抑制肿瘤的发生、发展。在肿瘤治疗中,需要充分发挥EVs对肿瘤发生、发展的抑制作用,通过工程化修饰提高其肿瘤治疗的靶向性、有效性和安全性。多项研究发现,肿瘤患者血液中小EVs水平较健康人群高[73-75],小EVs水平越高,患者的预后越差;干预EVs的生成、释放与摄取可以作为肿瘤靶向治疗的新策略[76]。
哺乳动物EVs的肿瘤治疗作用研究源于Raposo等[77]发现,B细胞产生的EVs含有与抗原多肽分子结合的MHC-Ⅱ,能诱导抗原特异性、MHC-Ⅱ限制性的T细胞效应。这一发现催生了基于EVs的肿瘤免疫靶向治疗研究。树突状细胞是机体内主要的一种抗原呈递细胞,其产生的EVs表达MHC分子,同时也表达T细胞共刺激因子。肿瘤抗原处理的树突状细胞分泌的EVs能够诱导杀伤性T细胞杀死肿瘤细胞[78]。天然的树突状EVs可以通过工程化改造而提高疗效和靶向性。研究显示,利用小鼠未成熟树突状细胞(imature dendritic cells,imDCs)获得表面表达内化RGD(internalizing Arg-Gly-Glu,iRGD)肽(序列为CRGDK/RGPD/EC)的囊泡,这些囊泡可靶向表达整合素αvβ3的癌细胞[79]。由抗原致敏的树突状细胞释放的小EVs可以增强癌症的免疫应答[80]。其他免疫细胞如巨噬细胞和自然杀伤细胞(natural killer cells,NK)来源的囊泡也可以激活免疫系统,抑制肿瘤生长[81]。最近研究发现,中性粒细胞来源的小EVs也可以通过诱导HGC27细胞凋亡,抑制胃癌细胞HGC27裸鼠移植瘤的生长[82]。
除了免疫细胞之外,其他非肿瘤来源的EVs自身或通过工程化改造也可以抑制肿瘤的生长。KRasG12DsiRNA/shRNA人源包皮成纤维细胞(human foreskin fibroblast)产生的小EVs能够有效地抑制胰腺癌细胞的生长;因表达“别吃我”的信号分子CD47,这些囊泡可以逃避血液中单核细胞以巨胞饮形式内吞清除,增长体内循环时间[83]。骨髓来源的间充质干细胞可生产包载KRasG12DsiRNA的GMP级囊泡,这些囊泡能够靶向胰腺癌细胞的小鼠移植瘤,抑制肿瘤的生长[84]。
鉴于带有与其亲代细胞一样的抗原,肿瘤细胞EVs可以作为疫苗,通过激活免疫系统抑制肿瘤生长。但肿瘤细胞EVs除了包含肿瘤抗原外,通常还含有特定的免疫调节蛋白如PD-L1[85]、Fas配体(Fas ligand,FasL)[86-88]、肿瘤坏死因子相关的细胞凋亡诱导配体(tumor necrosis factor related apoptosis inducing ligand,TRAIL)[88]和 TGF-β[89],这些蛋白质可以抑制机体的免疫应答反应,可能削弱肿瘤细胞EVs的免疫力,因此肿瘤细胞EVs不宜直接作为疫苗。但可以将肿瘤细胞EVs与树突状细胞等免疫呈递细胞孵育,然后以激活的免疫呈递细胞用于免疫治疗,比如在体外经肿瘤细胞EVs处理的树突状细胞,在体内能诱导CD8+T细胞依赖的抗肿瘤作用[90]。目前,肿瘤EVs在肿瘤治疗中多数需要经过工程化改造以增强其功能,比如在囊泡中加入促凋亡的分子FasL[91]或TRAIL[92-93];或加入具有免疫调节作用的细胞因子或化学趋向因子IL-18(interleukin-18,IL-18)和IL-2等[94-95];肿瘤EVs也常作为化疗药物的载体,以增强肿瘤抑制作用,降低化疗药物毒性,增强药物在肿瘤组织的渗透性和滞留时间[96-98]。
2.2 细菌囊泡在肿瘤靶向治疗中的作用与应用
早在1965年,营养缺陷型的大肠埃希菌(E.coli)就被发现能产生非细胞溶解所形成的球状膜泡[99],随后在霍乱弧菌(Vibrio cholerae)中也发现了细菌外囊泡(outer membrane vesicles,OMVs)[100]。大肠埃希菌和霍乱弧菌均为革兰阴性菌,革兰阳性菌很长一段时间被认为不能产生囊泡,直到2009年才从金黄色葡萄球菌(Streptococcus aureus)和枯草牙孢杆菌(Bacillus subtilis)中分离得到囊泡[101]。OMVs是细菌在生长过程中外膜向外突起形成的球形纳米囊泡,粒径大小为10 ~ 300 nm,主要由磷脂、蛋白质、脂多糖(lipopolysaccharide,LPS)和细胞周质等组成。虽然OMVs在60多年前已被发现,但它们一直被认为是细菌的代谢垃圾;后来临床研究发现,急性脑膜炎患者脑脊液中也存在OMVs[102]。研究发现,细菌还可产生外内膜囊泡(outer inner membrane vesicles,OIMVs)、细胞质囊泡(cytoplasmic membrane vesicles,CMVs)和管状膜样结构(tubeshaped membranous structure,TSMSs)[103-104]。最近研究发现,人体循环血液中也有细菌来源的EVs,这些囊泡可能是不同组织定植细菌介导跨器官信息交流的重要分子媒介[105]。
2.2.1 细菌囊泡的生成与制备 细菌囊泡主要通过膜起泡(membrane blebbing)和内溶素引起的细胞死亡(endolysin-triggered cell death)2种途径生成[103]。铁限制、假单胞菌奎诺酮信号(Pseudomonaquinolone signal,PQS)、疏水性分子和抗生素可以促进外膜起泡;而抗生素、DNA损害物质和肽聚糖(peptidoglycan,PG)降解酶则通过引起骤增性细胞裂解(explosive cell lysis)或引发出泡性细胞死亡,从而促进囊泡产生[103](见图3)。LPS、脂蛋白(lipoprotein,Lpp)和磷脂均参与了囊泡生成的调控,其中LPS的电荷和结构主要与OMVs的生成和蛋白质组成有关。LPS是革兰阴性细菌的基本结构单元,也是细胞表面发现的含量最丰富的抗原,在大肠埃希菌和沙门氏菌属(Salmonella)的外膜,LPS占比高达75%。鼠伤寒沙门氏菌(Salmonella typhimurium)在过表达具有催化活性的脂质A糖链3-O-位脱酰基酶PagL(PhoP/PhoQ induced lipase)后,OMVs生产增多,产量是其野生型菌株的4倍[106];但另一项报道发现敲除pagL后,囊泡生成没有显著改变,分别敲除pagC和pagP后,囊泡生成分别减少至原来的13.9%和23.0%[107]。在大肠埃希菌中,负责外膜外侧磷脂聚集的新脂蛋白Ⅰ(new lipoproteinⅠ,NlpⅠ)和外膜脂非对称维持蛋白E(maintenance of OM lipid asymmetry E,mlaE) 同时被敲除(ΔmlaEΔNlpⅠ)后,OMVs的生成较野生菌株高约30倍[108]。囊泡释放的外膜部位几乎没有脂蛋白键,而附着于肽聚糖层的脂蛋白数量减少会促使细菌OMVs形成[109]。细菌鞭毛蛋白也能调控OMVs释放,鞭毛合成缺失的细胞OMVs生成减少[110]。

图3 细菌囊泡及其生成机制Figure 3 Bacterial EVs and the underlying mechanism of biogenesis
细菌EVs一般通过结合差速离心、过滤和梯度离心分离纯化,值得注意的是,离心参数和过滤滤膜孔径均可影响其纯化效果[111]。综合运用不同原理的分离纯化方法,比如采用超滤、分子排阻色谱和密度梯度离心相结合的方法进行分离富集可以增加细菌EVs的产量并提高纯度[112]。
2.2.2 细菌囊泡介导的肿瘤治疗 肠道菌等细菌能够促进或抑制肿瘤的发生、发展,细菌囊泡在这一过程中起重要作用,但目前研究较少[113-114]。细菌囊泡可以促进细菌生存,运送细菌毒素、抗生素耐受蛋白和信号分子等物质并介导跨界信息交流[115];细菌囊泡递送毒素的同时也会激活宿主免疫系统,产生强烈的炎症反应,一方面可以促使肿瘤的免疫清除,另一方面也会对靶组织产生免疫毒性。
大肠埃希菌K-12 W3110E. coli是广泛用于细菌囊泡研究的菌株。研究发现,该大肠埃希菌脂质-A合成酶敲除株ΔmsbBK-12 W3110E. coli产生的囊泡能够选择性地靶向小鼠结肠癌CT-26移植瘤,并在瘤组织潴留;这些囊泡可刺激T细胞和NK细胞分泌IFN-γ,激活机体先天免疫系统并抑制肿瘤生长,从肿瘤接种后第7天开始静脉给药,每次5 µg,3天1次,给药4次即可清除结肠肿瘤,更重要的是这些小鼠再次接种肿瘤细胞不能形成移植瘤,提示囊泡治疗产生了免疫记忆;该囊泡也能抑制小鼠WC38结肠癌细胞移植瘤的生长、抑制小鼠乳腺癌细胞4T1和黑色素瘤细胞B16BL6的肺转移[116]。大肠埃希菌K-12 W3110E. coli和肠道沙门氏菌(Salmonella enterica)的囊泡静脉给药,每次5 µg,3天1次,给药4次也可清除小鼠结肠癌细胞CT-26的移植瘤[116]。革兰阳性菌金黄色葡萄球菌及其脂磷壁酸(lipoteichoic acid,LTA)缺失突变株和嗜酸乳杆菌(Lactobacillus acidophilus)产生的囊泡也能抑制CT-26移植瘤的生长[116]。细菌囊泡也可以作为免疫佐剂。比如,大肠埃希菌K-12 W3110E. coli囊泡以溶菌素和高pH处理,可降解其中脂质-A,减轻毒性,处理后作为免疫佐剂与黑色素瘤EVs共同免疫黑色素瘤细胞B16F10移植瘤荷瘤小鼠,可以激发Th-1型T细胞免疫并诱导抗肿瘤EVs IgG抗体产生,杀伤肿瘤细胞,大肠埃希菌囊泡效果比经典佐剂要好,而且能够增强PD-1抗体的疗效,实验过程中也未观察到系统毒性[117]。大肠埃希菌BL21来源的囊泡能特异性地靶向乳腺癌细胞4T1小鼠移植瘤组织并能够促使肿瘤微环境中巨噬细胞由M2向M1转化,但是其静脉注射后容易被抗体依赖的途径清除,同时也会产生免疫毒性;采用磷酸钙覆盖囊泡表面的方法可以克服囊泡静脉注射给药引发的抗体依赖性清除和免疫毒性,增强肿瘤治疗效果[118]。
益生菌副干酪乳杆菌(Lacticaseibacillus paracasei)PC-H1能够产生粒径约200 nm的囊泡LpEV,结肠癌细胞能摄取这些囊泡。LpEV在体外可以抑制结肠癌细胞HCT116、SW1116和SW620迁移和侵袭,还可通过激活PDK1/AKT/Bcl2通路诱导结肠癌细胞凋亡。将结肠癌细胞HCT116(1.5h106个细胞)单独或与LpEV(40 µg)同时接种到BALB/c裸鼠,结果显示LpEV能显著抑制结肠癌细胞HCT116小鼠移植瘤生长[119]。
2.3 植物细胞外囊泡在肿瘤靶向治疗中的作用与应用
植物EVs的可能来源包括胞外阳性细胞器(exocyst-positive organelle,EXPO) 、多 囊 泡 体(multivesicular body,MVB)[120]、液泡(vacuole)和自噬小体(autophagosome)(见图4)[121]。来源于非原质体液(anoplastic fluid)的囊泡称为植物EVs,由组织破碎(tissue rupture)液所得的囊泡称作植物纳米囊泡(plant derived nanovesicles,PDNVs)[122]。不同植物中囊泡的粒径不同,即使同一植物中也存在不同粒径的囊泡。拟南芥(Arabidopsis thaliana)叶片质外体汁液(apoplastic fluid)离心制备囊泡,分别得到直径为150 nm和10 ~ 17 nm 的杯状EVs[123];从本氏烟草(Nicotiana benthamiana)叶片质外体汁液中分离提取的囊泡直径介于30 ~ 220 nm之间,平均为(117f9)nm[124];而从向日葵(Helianthus annuusL.)种子离心制备所得囊泡直径在30 ~ 150 nm之间,形状为杯状[125]。多组学分析结果发现,植物来源的囊泡主要含有小核酸、蛋白质、脂质(主要是磷脂酸、磷脂酰胆碱和磷脂酰乙醇胺)和小分子代谢物[126]。在植物中EVs可以在细胞间运输多种物质,促进植物的生长发育,参与免疫信号传递过程中的蛋白质运输和特定RNA的选择性装载,建立和稳固植物细胞与细菌等微生物的共生关系[127]。

图4 植物细胞外囊泡生成机制Figure 4 Underlying mechanism of plant EVs biogenesis
植物EVs作为一种植物活性成分,本身可以通过多种机制抑制肿瘤的生长;同时也可以作为药物载体递送肿瘤治疗药物。植物EVs抑制肿瘤生长可以通过诱导肿瘤细胞凋亡和激活宿主免疫系统等作用实现。
2.3.1 免疫调节作用 人参(Panax ginsengCA Mey)来源的新型EVs样纳米粒(ginseng derived nanoparticles,GDNPs)能够显著促进M2(CD11b+F4/80+CD206+)向M1(CD11b+F4/80+CD86+)表型的极化并产生活性氧(reactive oxygen species,ROS),导致小鼠黑色素瘤细胞凋亡增加,显著抑制荷瘤小鼠黑色素瘤的生长,增加肿瘤组织中M1巨噬细胞;GDNPs诱导的巨噬细胞极化很大程度上取决于Toll样受体4(Toll like receptor 4,TLR4)和髓样分化抗原88(myeloid differentiation factor 88,MyD88)信号。GDNPs还促进M1巨噬细胞分泌肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、IL-12 和 IL-6等炎症因子[128];也促进极化的M1巨噬细胞分泌CCL5和CXCL9,诱导T细胞朝肿瘤组织募集,增强PD-1抗体的疗效[129]。因此,GDNPs可能作为癌症免疫治疗的一类新型纳米药物。
2.3.2 细胞增殖和凋亡调控作用 采用差速离心和葡萄糖梯度离心所得天冬囊泡(Asparagus cochinchinensisnanovesicles,ACNVs)含有脂质、核酸和蛋白质,能通过诱导细胞凋亡抑制肝癌细胞增殖,而对正常肝细胞的损伤较小;可能因为植物EVs不表达CD47等“别吃我”信号,这些囊泡在体内被快速清除,PEG修饰能够显著降低囊泡的清除速率[130];ACNVs和PEG修饰的ACNVs在200 mg · kg-1剂量下均能显著抑制HepG2裸鼠移植瘤的生长,但PEG修饰的ACNVs效果优于ACNVs,给药组肿瘤组织中脱氧核糖核苷酸末端转移酶介导的缺口末端标记(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)着色显著高于对照组,说明囊泡主要通过诱导细胞凋亡发挥作用;与对照组相比,给予PEG修饰的ACNVs的小鼠体质量无明显变化,而给予未修饰ACNVs的小鼠体质量显著降低,但ACNVs对心、肝、脾、肺和肾组织均无明显的急性毒性[130]。
从朝鲜树参(Dendropanax morbifera)、赤松(Pinus densiflora)、北美香柏(Thuja occidentalis)和日本扁柏(Chamaecyparis obtusa)树干汁液分离得到了DM-EVs、PD-EVs、TO-EVs和CO-EVs。乳腺癌细胞MDA-MB-231 和MCF7主要通过小窖蛋白介导的内吞作用摄取这些囊泡,而正常乳腺细胞MCF10A则通过网格蛋白和小窖蛋白介导的胞吞途径、小泡饮和吞噬作用摄取这些囊泡。DM-EVs和PD-EVs对乳腺肿瘤细胞MDA-MB-231和MCF7、皮肤肿瘤细胞A431均有细胞毒作用,而对正常乳腺细胞MCF10A和正常皮肤细胞HNF的细胞毒作用相对较弱,且DM-EVs作用强于PD-EVs,TO-EVs和COEVs 无显著作用;DM-EVs和PD-EVs单独使用作用不如顺铂,但二者联用的效果强于顺铂,而且比顺铂具备更好的肿瘤细胞偏好性杀伤作用[131]。
从甜橙(C. sinensis)、苦橙(C. aurantium)、柠檬(C. limon)和葡萄柚(C. paradisi)分离出的微米级(MVs)和纳米级囊泡(NVs)可特异性抑制乳腺癌细胞MCF7、人黑色素瘤细胞A375和肺腺癌细胞A549的增殖,对人正常皮肤角质形成细胞HaCat的生长没有影响;葡萄柚囊泡能够抑制G0/G1和G2/M细胞周期的转变,促进细胞周期抑制剂p21的上调,降低Cyclin B1的蛋白表达和G2/M检查点关键调节因子Cyclin B2的转录水平;葡萄柚囊泡还通过激活多聚ADP-核糖聚合酶-1(poly-ADP-Ribose polymerase-1,PARP-1)而引发A375细胞凋亡,抑制AKT和细胞外信号调节激酶(extracellular signal regulated kinase,ERK)信号通路的传导,从而降低细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)和组织蛋白酶(cathepsins)的表达,进而抑制肿瘤细胞迁移[132]。肺癌、结肠癌和白血病细胞经柠檬囊泡(limon derived extracellular vesicles,LDEVs)处理后,促凋亡分子Bad和Bax的mRNA水平增加,而促生存分子如生存素(survivin)和Bcl-xL的表达降低;LDEVs在体内激活TRAIL介导的细胞凋亡,抑制参与血管生成的细胞因子分泌,如血管内皮生长因子-A (vascular endothelial growth factor A,VEGF-A)、IL-6和IL-8,强烈地抑制肿瘤的生长[133]。LDEVs的抗肿瘤作用部分是通过抑制脂质代谢通路关键酶乙酰辅酶 A 羧 化 酶 (acetyl-CoA carboxylase,ACACA)的表达实现;沉默ACACA可以抑制细胞生长和诱导细胞凋亡,该作用是通过抑制丝裂原激活蛋白激酶(mitogen activated protein kinase,MAPK)信号传导和促进Bad介导的细胞凋亡实现;LDEVs只抑制结肠腺瘤细胞SW480、慢性髓系淋巴瘤细胞LAMA84和多发性骨髓瘤细胞MM1的生长,但不抑制人骨髓基质细胞HS-5的生长,因为LDEVs只抑制这些肿瘤细胞中ACACA 的表达,但不影响HS-5中ACACA的表达[134]。LDEVs以浓度依赖的方式抑制胃癌细胞AGS、BGC-823和SGC-7901的生长,很可能通过诱导ROS生成,上调生长阻滞DNA损伤可诱导蛋白45a(growth arrest and DNA damage inducible alpha,GADD45a)的表达,使胃癌细胞周期阻滞于S期并诱导胃癌细胞凋亡;体内实验也表明,SGC-7901小鼠移植瘤的体质量明显减轻,而且系统毒性较小[135]。
苦瓜 EVs(bitter melon extracellualr vesicles,BMEVs)可以抑制口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)细胞CAL-27和WSU-HN6的生长,这一作用是通过诱导肿瘤细胞S期细胞周期停滞和细胞凋亡实现;肿瘤细胞凋亡的诱导依赖于ROS的产生和JUN蛋白的上调;BMEVs显著下调了NOD样受体家族含pyrin结构域3炎症小体(NOD-like receptor family,pyrin containing domain 3,NLRP3)的表达,这一作用与BMEV中所含RNA部分片段有关;5-氟尿嘧啶(5-fuorouracil,5-FU)广泛用于癌症治疗,但5-FU介导的NLRP3激活使得OSCC细胞对5-FU产生耐药性;BMEVs在体内和体外均与5-FU发挥协同作用,克服细胞对5-FU的耐药,抑制OSCC细胞生长,这一作用与BMEVs抑制NLRP3的表达有关[136]。
2.3.3 肿瘤炎症反应抑制作用 大蒜囊泡(garlic derived vesicles,GDVs)能被肝癌细胞HepG2摄取,用胰蛋白酶降解其表面蛋白质后,肝癌细胞HepG2对GDVs的摄取显著减少;甘露糖特异性结合蛋白Ⅱ凝集素和CD98之间的直接相互作用在细胞对GDVs的摄取过程中起重要作用;阻断CD98受体可显著降低HepG2细胞对GDVs的摄取;在HepG2细胞中,GDVs通过LPS诱导的促炎因子IFN-γ和IL-6表达,发挥抗炎作用[137]。炎症反应可以促进肿瘤的发生、发展和转移[138],因此GDVs有可能用于肿瘤治疗。
2.3.4 抗肿瘤转移作用 在3D微流体模型中,朝鲜树参(Dendropanax morbifera)树干汁液来源的囊泡DM-EVs可抑制肿瘤相关成纤维细胞(cancer associated fibroblast,CAF)的生长,但对正常成纤维细胞的生长抑制作用较弱;此外,DM-EVs与黑色素瘤B16BL6-EVs同时给药、B16BL6-EVs预处理后DM-EVs多次给药或DM-EVs预处理后加入B16BL6-EVs,DM-EVs在 1 μg · ml-1或 10 μg · ml-1时,肿瘤相关成纤维细胞的生长均被显著抑制;这些作用可能与DM-EVs引起整合素和胶原蛋白等细胞外基质蛋白表达下调有关[139]。
3 细胞外囊泡的工程化改造
EVs具有良好的生物相容性,可以通过多种机制抑制肿瘤生长,但在实际应用中发现,EVs作为肿瘤靶向治疗药物或药物载体仍存在稳定性差、靶向性低和易被代谢清除等问题[140]。为此,研究者对EVs进行工程化改造以弥补天然EVs在靶向性、有效性和代谢清除等方面的不足;改造既可以在囊泡内腔也可以在囊泡表面进行,但通常在囊泡内腔和囊泡表面2个层面同时进行(见图5)。
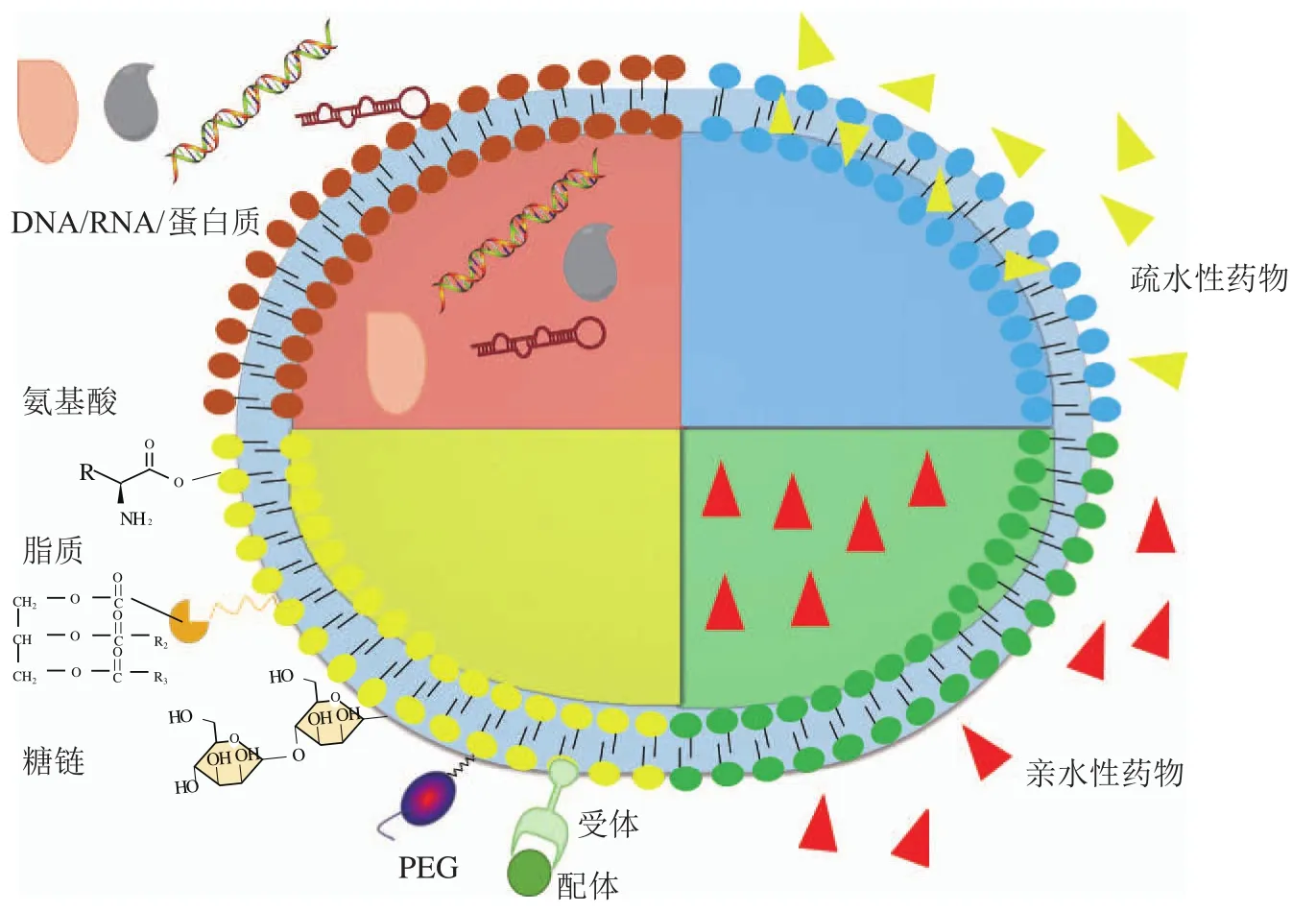
图5 细胞外囊泡工程化改造的策略和方法Figure 5 Strategy and method for EVs engineering
3.1 细胞外囊泡内腔货物包载
EVs货物的包载可以通过操控囊泡内含物的细胞分选系统载入[141-144],也可以在EVs生成释放后将货物载入分离纯化的囊泡,因此,EVs货物包载既可以直接通过物理化学技术包载到EVs,也可以间接地通过亲代细胞遗传工程修饰将特定的分子包载到EVs。
3.1.1 基于亲代细胞的细胞外囊泡货物包载 通过遗传工程修饰,利用亲代细胞中EVs货物的分选途径,将目标分子包载入EVs,转染和(或)转导是一种常用的包载方法。质粒和病毒是在靶细胞中表达目标分子的常用分子生物学工具(见图6)。在转染质粒或转导病毒后,产生EVs的亲代细胞可以表达相应的核酸和蛋白质等分子。比如,笔者团队利用过表达血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)的HEK293细胞生产了表达ACE2的EVs[145]。囊泡也可以作为蛋白质的输送载体。在亲代细胞中以光响应可切割多肽作为连接子,表达凋亡蛋白(apoptin)与EVs膜蛋白质CD9的融合蛋白,细胞生成的囊泡能包载该融合蛋白,光照后凋亡蛋白即被释放[146]。为了测试骨髓基质细胞(marrow stromal cells,MSCs)EVs是否可以用作输送抗肿瘤miRNA的载体,Katakowski等[147]用miR-146b表达质粒转染MSC,并收集MSC释放的EVs,发现获得的EVs可显著降低胶质瘤细胞的异种移植瘤生长速度。脂肪来源的间充质干细胞和肿瘤细胞等不同细胞经转染或转导表达miRNA的表达载体后,均能产生带有相应miRNA的EVs。比如脂肪间充质干细胞在转染表达miR-122的质粒后,能够生成表达miR-122的EVs,而且瘤内注射该囊泡能够增强肝癌细胞对索那非尼的响应[148]。细胞在转染寡核苷酸之后产生的EVs也携带转染入细胞的寡核苷酸,比如乳腺癌细胞4T1、肝癌细胞HepG2和卵巢癌细胞SKBR3在经脂质体lipofectamine 2000转染Cy5-anti-miR-21后产生的EVs载有Cy5-anti-miR-21,而且这些囊泡还能够抵抗癌细胞对DOX的耐药性[149]。目前,有多种基因工程方法被用来增加核酸在囊泡内的富集[150],比如将囊泡标志物分子基因与RNA结合蛋白基因连接在一起表达融合蛋白,可以将RNA分子富集在囊泡[151]。小分子化合物与亲代细胞孵育产生的EVs也可以包载小分子化合物如DOX[152]。

图6 基于亲代细胞遗传修饰的细胞外囊泡货物包载Figure 6 EVs cargo encapsulation based on genetic engineering in the parental cells
3.1.2 基于物理化学技术的细胞外囊泡货物包载 物理化学方法包括共孵育、电转、化学转染、超声、挤压、冻融循环、去污剂破膜和低渗透析等,其中共孵育、电转、化学转染和超声是常用的方法。
共孵育是常用的小分子货物包载方法,通过将靶分子与囊泡孵育,利用EVs膜两侧的靶分子浓度梯度,促使靶分子渗透进入囊泡[153]。EVs是脂质包裹的中空腔结构,表面是疏水性的,一些脂溶性的分子可以通过相似相溶的原理与EVs共孵育后包载入囊泡,EVs的载药效率主要取决于药物分子的疏水性。比如,疏水性的姜黄素与小鼠淋巴瘤细胞EL4产生的EVs共孵育被装入囊泡,可提高其溶解性和稳定性,体内给药后能够提高姜黄素的生物利用度[153]。从甘蓝(cabex)和红甘蓝(rabex)中提取的纳米囊泡能够促进哺乳动物细胞(HaCaT和HDF)的增殖而不会引起细胞毒性;DOX与红甘蓝纳米囊泡共孵育可将DOX包载到囊泡中,且所得囊泡能有效抑制结肠癌细胞增殖[154]。
电转技术是通过对悬浮在缓冲液中的EVs施加电场,使EVs膜产生瞬时孔隙,随后促进药物或核酸通过孔隙扩散到EVs内部,将相关分子包载到EVs内,载药过程结束后,囊泡膜的完整性恢复[155]。DNA经由电转在EVs的包载率与DNA大小和囊泡的粒径有关,1 000 bp以上的DNA包载率仅为250 bp的DNA包载率的1/10,可能原因包括电击产生的临时膜孔径太小和大DNA扩散速度慢等,因此电转技术多用于EVs的siRNA或miRNA包载[156]。电转的效率可能跟囊泡的来源有关,因此不同来源的囊泡电转条件需要摸索优化[157]。电转可能导致RNA和EVs聚集,从而降低EVs的负载能力[158];在电转缓冲液加入膜稳定剂如海藻糖(trehalose),可以降低电转引起的EVs集聚[159-160]。电转技术不仅可以用于囊泡的核酸包载,也可用于小分子的包载[161]。小分子包载效率与囊泡数量、小分子浓度有关,比如囊泡的数量和DOX的浓度均与DOX囊泡的包载率呈正相关[162]。
化学转染是直接将货物包载入EVs的常用方法。脂质体转染是一种重复性好、简便有效的货物装载方法[163];但脂质体转染也存在转染效率低的缺点[164]。脂质体常用于将核酸包载至EVs[165],比如,通过脂质体转染,加载有miR-184的甘蓝囊泡能有效抑制肿瘤的生长[154]。CaCl2与DNA等核酸结合,可促进核酸与细胞质膜结合;热激(heat shock)通过改变膜流动性,促进核酸进入细胞。有研究结合CaCl2转染和热激将核酸分子包载到囊泡中,例如将miR-15a与0.1mol·L-1CaCl2冰上孵育30 min,42 ℃热激60 s,然后再于冰上孵育5 min可以将miR-15a高效地包载到EVs[166]。
超声处理可将PTX等小分子和蛋白质等多种分子包载到EVs中。大麻二醇通过超声可以包载入人脐带间充质干细胞产生的EVs中,这种囊泡可以抑制三阴性乳腺癌MDA-MB-231细胞移植瘤的生长[167]。RAW264.7细胞产生的EVs通过超声可以有效地包载过氧化氢酶(catalase),包载效率要高于共孵育法和冻融法,与挤压法相当[168]。研究发现,超声处理的EVs粒径、膜完整性和细胞内吞均受影响[169]。RAW264.7细胞来源的EVs在经超声包载PTX之后粒径变大、zeta电位升高,包载效率要高于电转和共孵育法[169]。然而,也有研究未见超声对囊泡性状的改变,例如人源脂肪组织干细胞分泌的EVs通过超声能够有效包载小分子酪氨酸激酶抑制剂,包载效率比共孵育法高4倍,且不会引起囊泡聚集[170]。这些差异可能跟所用的囊泡来源不同有关。
3.2 细胞外囊泡膜表面工程化改造
EVs是一种脂膜结构,膜上嵌合了不同的蛋白质,囊泡表面也以糖脂、糖蛋白质等糖复合物的形式表达不同的糖链,故可通过遗传学操作以及生物偶联技术将荧光探针、靶向肽及药物分子、纳米抗体和适配体等生物活性分子与脂质、蛋白质和糖链偶联并表达在EVs膜表面[171]。EVs膜工程化改造包括基于亲代细胞遗传修饰、代谢工程的EVs膜表面分子展示及基于物理化学技术的EVs膜表面分子展示。
3.2.1 基于亲代细胞的细胞外囊泡膜表面分子展示EVs表面加入靶向肽等功能性分子可以增强囊泡的靶向性,常见的办法是将靶向性分子替换EVs表面高丰度的跨膜蛋白的胞外区表达融合蛋白。溶酶体相关膜蛋白2b(lysosome associated membrane protein 2b,Lamp2b)和四次跨膜蛋白家族成员CD9、CD63、CD81是常见的EVs膜蛋白,这些分子的胞内区常用做构建融合蛋白的骨架。表皮生长因子受体(epidermal growth factor receptor,EGFR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)等肿瘤细胞高表达的受体酪氨酸激酶的配体是常用的构建具有肿瘤靶向融合蛋白的分子。利用自源性树突细胞表达序列为YTIWMPENPRPGTPCDIFTNSRGKRASNG的脑靶向肽RVG(rabies viral glycoprotein)与Lamp2b的融合蛋白Lamp2b-RVG,序列为ASSLNIA的肌肉组织靶向肽(muscle specific peptide,MSP)与Lamp2b的融合蛋白Lamp2b-MSP,生成分别表达Lamp2b-RVG和Lamp2b-MSP的囊泡,这些囊泡可以分别特异性地进入神经细胞Neuro2A和肌肉细胞C2C12,这些囊泡载入siRNA后,可以有效地敲低受体细胞中的靶基因表达;通过电转载入GAPDH的siRNA后,Lamp2b-RVG囊泡可以在多个脑区敲低GAPDH的表达,但未见Lamp2b-MSP囊泡在肌肉组织的蓄积[172]。EGFR是一种在肿瘤细胞表面高表达的跨膜糖蛋白[173-174]。通过对供体HEK293细胞进行遗传操作,将能与EGFR结合的GE11肽(YHWYGYTPQNVI)与PDGFR跨膜区以融合蛋白形式表达在囊泡表面,可靶向EGFR高表达的乳腺癌细胞[165]。糖基化是一种广泛的蛋白质翻译后修饰方式,在Lamp2b-靶向肽融合蛋白上多处引入糖基化位点,以防止肽的降解和增加融合蛋白在细胞与囊泡的表达,由此所得的囊泡对神经母细胞瘤细胞的靶向能力增强[175]。乳糖黏蛋白(lactadherin)的C1C2结构域能够与磷脂酰丝氨酸特异性结合,靶向肽等功能性分子也常通过与C1C2结构域融合形成融合蛋白以实现在囊泡表面的表达[176]。衰变加速因子(decay accelerating factor)来源的磷脂酰肌醇锚定信号肽与EGFR的抗体EGa1或R2结合,也可以将抗体展示在囊泡膜表面[177]。改造细菌囊泡膜整合蛋白毒素,将具有肿瘤靶向性的抗体、配体(ligand)或亲合体(affibody)替换毒素的胞外区,也可以将靶向性的多肽比如整合素αvβ3靶向肽RGD等偶联至囊泡表面,从而实现囊泡的肿瘤靶向[178]。溶细胞素A是大肠埃希菌囊泡表面含量最高的毒力蛋白,是常用于构建肿瘤靶向融合分子的靶蛋白。HER2的亲合体[179]和表皮生长因子(epidermal growth factor,EGF)[180]均可用于和溶细胞素A构建融合蛋白,实现细菌囊泡的肿瘤靶向。
尽管靶向肽等功能性分子借助膜融合蛋白技术成功实现了在EVs膜表面的展示,但这一方法仍需改进以克服如下不足:1)复杂、耗时,通常较难操作;2)融合蛋白可能会在EVs生成与分泌过程中降解,而不是分选到EVs中,并且重组蛋白与EVs膜蛋白的融合可能损害这些膜蛋白的功能;3)靶向配体容易降解;4)大多数干细胞和原代细胞并不适合基因工程方法,因为它们通常难以进行转染。
不适合遗传修饰展示的分子可以通过代谢标记的方式实现展示。代谢标记通常是将特定的标签分子通过细胞代谢整合到EVs的表面,这些分子包括脂质、氨基酸和糖类物质等。目前,脂质的代谢标记主要基于磷酸脂。叠氮修饰的胆碱通过脂质合成途径可生成叠氮化的磷酸酰胆碱,而磷脂(包括磷脂酰胆碱)是细胞质膜和EVs膜的主要成分,因而可以整合到EVs膜上;通过生物正交反应(bioorthogonal reaction)可以将靶向分子或货物展示在膜上[181]。氨基酸的代谢标记主要通过在膜蛋白中引入可以进行生物正交反应的非天然氨基酸,例如在间充质干细胞中6-叠氮-L-去甲亮氨酸可以通过甲胺酰tRNA合成酶L274G突变体(methionyl tRNA synthetase,MetRSL274G)整合入膜蛋白质,L-叠氮高丙氨酸也可整合入膜蛋白质[182]。单糖的代谢标记主要利用唾液酸生物合成途径在细胞膜表面末端唾液酸中加入生物正交反应基团,用于连接靶向性配体或治疗性药物等分子,叠氮修饰的全乙酰基甘露糖胺是常用的代谢标记底物[183]。例如,经代谢标记整合到EVs膜表面的末端唾液酸,通过其带有的叠氮,可与PEG化的透明质酸发生反应,这一修饰可以增强所得囊泡对CD44高表达的风湿性关节炎组织的主动靶向能力[184]。这些策略同样适用构建靶向肿瘤的囊泡。
3.2.2 基于物理化学技术的细胞外囊泡膜表面分子展示 生物正交反应是细胞和EVs表面修饰的常用化学方法[185-186]。生物正交反应一般均是具有反应高效、选择性好和反应模块化特点的点击化学(click chemistry)反应。铜催化的叠氮炔环加成和张力催化的叠氮炔环加成是在EVs表面进行生物偶联的常用点击化学方法。铜催化的叠氮炔环加成是点击化学的一个代表性反应,该反应耗时短、特异性高,并且在水溶性缓冲液中有较好的相容性。该法修饰对囊泡的结构与功能影响小,例如不改变囊泡的大小,不影响囊泡与受体细胞的结合[186]。但铜离子往往容易对EVs造成损害,因此,张力催化的叠氮炔环加成比铜催化的叠氮炔环加成更多地被用于将EVs与靶向肽进行偶联[187]。氨基和巯基借助酰胺化等生物正交偶联反应也可将荧光探针、同位素造像剂和靶向肽修饰到EVs膜表面[39]。除了生物正交反应,酶促反应也用于将EVs表面分子与靶向肽等目标分子通过共价键连接。有研究利用转肽酶Sortase A和蛋白连接酶OaAEP1,可将EGFR靶向肽和EGFR纳米抗体以共价键形式偶联到EVs上,无需对供体细胞进行任何遗传修饰[188]。
靶向性配体等功能性分子也可以利用疏水性分子通过相似相溶的原理,嵌入EVs脂质双层结构,锚定在EVs膜表面。例如,将EGFR的纳米抗体R2或EGa1和PEG分别与磷脂缀合,形成的复合物可以通过磷脂锚定在EVs膜表面,这一修饰不影响囊泡形态、粒径分布和囊泡蛋白质组成,但可以增强EVs对EGFR高表达的肿瘤细胞的靶向性,同时延长囊泡在血液中的循环时间[189]。不对称siRNA(hydrophobically modified siRNA,hsiRNAs)在经过胆固醇等疏水性脂质修饰后,可以通过脂质锚定在囊泡表面,或通过脂质介导的融合进入囊泡,siRNA的包载效率主要同脂质与siRNA的连接方式和所用连接子类型有关[190]。siRNA的疏水性决定了siRNA-EVs复合物的负载效率和沉默活性[191],这种修饰不影响囊泡的大小和完整性[192]。为克服囊泡表面遗传修饰的缺陷和不足,研究人员设计了一种称作DNA拴缆的分子,将拴缆DNA与胆固醇连接形成DNA拴缆-胆固醇分子,在室温下与囊泡涡旋5 min,即可通过胆固醇将拴缆DNA锚定在囊泡表面;通过与DNA拴缆互补配对的DNA,可以将荧光分子、活性分子和靶向分子展示在囊泡表面[193]。
3.3 货物包载策略与细胞外囊泡膜表面分子展示技术联用
为同时增强EVs的靶向性和减毒增效,多数研究倾向于将货物包载和EVs膜表面分子展示结合在一起。
通过蔗糖梯度分离所得食用生姜30%蔗糖级分囊泡和45%蔗糖级分囊泡中的脂质47%为磷脂酸,15%为双半乳糖二酰甘油,27%为单半乳糖二酰甘油。提取分离这些生姜囊泡脂质,采用装备200 nm聚碳酸酯膜的脂质体挤压仪制备空载的合成囊泡,所得的合成囊泡能够有效包载DOX,而且能够通过吞噬作用被细胞摄取,囊泡经由叶酸(folic acid,FA)修饰后可被结肠癌细胞CT-26高效地摄取,在体内主动特异性靶向CT-26移植瘤并有效地抑制肿瘤生长;FA纳米载体在酸性环境下可更加快速地释放这种药物,从而降低DOX的严重副作用[194]。将与P-选择素具有高亲和力的岩藻依聚糖作为外涂层;生物相容性好的阳离子聚合物ε-多聚赖氨酸(ε-poly-lysine,ε-PLL)作为中间层;包裹载有DOX的生姜衍生脂质载体,成功构建了叠层生姜衍生脂质载体(layer-by-layer ginger lipid vectors,LbL-GDLV),这使得LbL-GDLV通过与肿瘤细胞P-选择素结合实现肿瘤的主动靶向;在Luc-HT-29和HCT-116异种移植瘤模型中,负载DOX的LbLGDLVs可显著抑制肿瘤生长,显示出比游离DOX更好的治疗效果;更重要的是,LbL-GDLVs具有良好的生物相容性,显著减轻了游离DOX的心脏毒性,避免了结肠肿瘤细胞对游离DOX的耐药性[195]。为了增强生姜源囊泡(ginger derived exosome like nanovesicles,GDENs)与KB口腔肿瘤细胞的结合,将尾部接有胆固醇和头部接有FA的三路结(three way junction,3WJ)结构域的proHead RNA分子通过胆固醇插入囊泡表面;包载生存素(survivin)siRNA后形成的FA-3WJ/GDEN/siRNA囊泡能够有效敲低细胞中生存素的表达,效果与脂质体转染相当;静脉给药后该囊泡还能在体内有效抑制人源口腔表皮癌细胞KB裸鼠移植瘤的生长[196]。
葡萄柚囊泡衍生脂质制成的纳米载体(grapefruit-derived nanovectors,GNVs)可有效地递送不同物质,包括信号转导与激活因子3(signal transducer and activator of transcription 3,STAT3)小分子抑制剂JSI-124、PTX等化疗药物、生物素化增强型黄色荧光蛋白(enhanced yellow fluorescent protein,eYFP)的 DNA表达载体、荧光素酶的DNA表达载体、荧光素酶siRNA和生物素化蛋白质(如生物素化的CD4抗体或CD8抗体)。装载JSI-124的GNVs可以显著抑制STAT3的激活,有效抑制小鼠胶质瘤细胞GL26的移植瘤生长,并且显著延长小鼠的存活时间[197]。GNVs经FA修饰可实现对肿瘤的主动靶向,在小鼠结肠癌细胞CT26移植瘤模型和人结肠癌细胞SW620的SCID小鼠移植瘤模型中,GNVs-FA在肿瘤组织中的分布分别比GNVs多1 300倍和1 600倍[197]。通过肝素的羧基结合靶向胶质瘤αvβ3的cRGD肽,载入己二酸二肼-阿霉素构建肝素纳米粒子(doxoruicin nanoparticles,DNs),再将葡萄柚EVs通过葡萄柚EVs表面高丰度的磷脂酰乙醇胺,和肝素纳米粒上的肝素自由羧基反应,制备酸敏感的仿生阿霉素胶质瘤靶向囊泡(EV-DNs);所得囊泡能够通过受体介导的转胞吞作用和膜融合穿越血脑屏障,并深层次穿透到脑肿瘤组织内部,显著增强药物在脑肿瘤部位的富集,抑制肿瘤的生长,提升原位脑胶质瘤小鼠的生存期[198]。
细菌囊泡用于肿瘤靶向治疗,通常需要做两方面的处理:一是减毒,二是囊泡表面修饰以提高囊泡对肿瘤细胞和组织的靶向性。去除细菌囊泡表面的毒素有很多方法,遗传学改造是广泛应用的一种。例如大肠埃希菌K-12 W3110E. coli的毒性主要与LPS中脂质A(lipid A)有关,可以通过敲除其中脂质A合成酶基因msbB,减低其产生的囊泡的毒性[179]。因此,ΔmsbBK-12 W3110E. coli菌株广泛被用于制备工程化的细菌囊泡。除了ΔmsbBK-12 W3110E. coli菌株,鸟苷5'-二磷酸-3'-二磷酸合成缺陷的鼠伤寒沙门菌等其他减毒细菌也被用于生产药物递送的细菌囊泡[199]。细菌囊泡减毒也可以通过使用溶菌酶降解囊泡表面的内毒素,或采用内毒素去除试剂盒去除内毒素;表达人TRAIL片段(氨基酸序列114 ~ 281)的大肠埃希菌囊泡采用溶菌酶去除内毒素,然后在膜表面通过棕榈酸接上αvβ3整合素靶向配体RGD(G)或RGP(P),并将光敏剂(photosensitizer)吲哚菁绿(indocyanine green,ICG),通过融合效应及ICG与RGD或RGP的电荷相互作用,加载到不同囊泡表面,分别形成ICGRGD-OMVs(I-G-OMVs)和 ICG-RGP-OMVs(I-POMVs),同时制备ICG-OMVs;在近红外光的刺激下,I-P-OMVs能诱导针对B16F10黑色素瘤细胞C57BL/6小鼠移植瘤的光热光动学反应,引起播散性的肿瘤细胞凋亡[178]。
4 结语与展望
哺乳动物EVs、细菌EVs和植物EVs均已被证实具有抗肿瘤作用且可作为抗肿瘤药物递送载体,而且作用机制多样,几乎可以调节所有的肿瘤特征性功能[200]。EVs在临床中的应用受到了广泛的关注,但是EVs作为一种新型治疗手段,还有许多问题亟待解决:1)药物质量的稳定可控是药物安全性和有效性的保证,目前尚无EVs大量生产方法,仍缺乏确定的特征性标志物。目前迫切需要将EVs分离纯化的流程和药效评价的流程标准化,使得不同实验室的结果、同一实验室不同批次结果具有可比性。2)EVs生成、内含物装载、转运与摄取和内含物在靶细胞的释放机制等仍处于探索期,这些机制研究的进展可以帮助制备安全性更好、疗效更显著、毒副作用更小的EVs诊疗药物。3)因多数植物和细菌的基因组序列未知,极大地限制了基于鸟枪法(Shotgun)的蛋白质组学技术在植物囊泡和细菌囊泡蛋白质内含物鉴定方面的应用,进而阻碍这些囊泡作用的物质基础和作用机制研究,也阻滞了这些囊泡蛋白质类特征标志物的发现和鉴定,所以需要发展新的特别是从头测序的蛋白质组学技术用于这些囊泡蛋白质的鉴定。4)EVs的长期安全性和有效性仍需更多的试验进行评价。目前虽然有超过300项的临床试验在评价EVs的各种治疗作用,但是尚无基于EVs的治疗药物被各国药物监管机构批准用于临床实践,未来需要更多的研究去评价EVs对肿瘤等疾病的治疗效果和安全性,为EVs诊疗药物的临床应用铺平道路。

