人源性结肠癌组织异种移植模型在个体化药物治疗中的应用研究
刘建辉,谭邓旭,秦 靖,张彩勤,师长宏*
(1. 西安医学院附属宝鸡医院宝光分院 陕西 宝鸡 721006;2.空军军医大学实验动物中心陕西 西安 710032)
在全世界范围内,结肠癌患者死亡率高居第二,近年来随着人们生活方式的改变,其发病率不断上升。虽然早期结肠癌使用手术联合化疗取得一定的效果,但其治愈率仍非常有限[1-2]。肿瘤的一个显著特征就是具有异质性,选择适合患者的治疗药物对提高治疗效果尤为重要[3-4]。肿瘤异种移植模型是临床前药物筛选的重要工具。其中,患者来源的异种移植模型(patient-derived xenograft,PDX)是将患者新鲜肿瘤组织直接移植于免疫缺陷动物体内建立的肿瘤模型,因此,较好地维持了原发瘤的生物学特性。PDX 模型为临床患者药物治疗效果评估、发病机制研究等提供了可靠的实验工具,避免了化疗药物的盲目使用,并减少毒性及不良反应[5-7]。目前,关于结肠癌PDX 模型单药筛选的研究报道较少。本研究尝试建立了3 例结肠癌PDX模型,并对临床常用化疗药物的治疗效果进行评估,期望为结肠癌的个体化治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性BALB/c 裸小鼠80 只,6~7周,购自常州卡文斯实验动物有限公司,生产许可证号:SCXK(苏)2016-0010。所有动物饲养在空军军医大学实验动物中心屏障设施内,温度23~25 ℃,相对湿度40%~60%,饲料、垫料和饮用水均灭菌处理。本研究通过了空军军医大学实验动物福利及伦理委员会批准(审批号:20180512)。
1.1.2 样本收集 3 例结肠癌肿瘤组织(D31427,D34562,D34603)均收集于西京医院,已获得患者及其家属的同意,均签到了相关知情同意书。同时本研究获得了西京医院医学伦理委员会的批准(批准编号:2015432)。样本D31427 为结肠癌,中分化腺癌;样本D34562 为乙状结肠癌,中分化腺癌;样本D34603为乙状结肠癌,黏液腺癌。
1.2 方法
1.2.1 PDX 模型建立及生长特性 将患者肿瘤样本保存于无菌高糖DMEM(Gbico)培养基内放于冰盒取回实验室;使用无菌生理盐水清洗肿瘤组织,然后在无菌平皿内将肿瘤组织剪成2 mm3的小块(P0 代)与等量基质胶(美国BD 公司)混匀;使用套管针将3~5 块肿瘤组织移植到裸小鼠背部皮下,生长出的肿瘤命名为P1 代。P1 代肿瘤组织离体后继续移植到裸小鼠体内获得P2 代肿瘤;将P2 代肿瘤继续传代至裸小鼠体内,获得肿瘤组织生长速度稳定的P3 代肿瘤,P3 代PDX 模型肿瘤组织用于实验研究。动物模型建立及传代过程使用20只裸小鼠。
1.2.2 H&E 染色 将肿瘤组织使用无菌生理盐水清洗干净后,固定于4%多聚甲醛24 h 后,石蜡包埋,切片,染色,在显微镜下采集图像。
1.2.3 免疫组织化学染色(IHC) 将石蜡切片脱蜡,水化,修复抗原;封闭内源性过氧化物酶,4 ℃条件下孵育癌胚抗原(carcino-embryonic antigen,CEA)1∶100(上海艾博抗体有限公司)过夜;PBS 清洗干净多余一抗,37 ℃孵育二抗(DAB)1∶200(北京百奥莱博)90 min;PBS 清洗多余二抗,DAB 显色,复染,显微镜下采集图像。
1.2.4 肿瘤化疗药物的治疗 结肠癌PDX 肿瘤D42317、D34562 和 D34603 分别接种 20 只裸小鼠,PDX 模型肿瘤生长后即使用游标卡尺测量肿瘤体积,计算公式为:肿瘤体积(V)=肿瘤长度(L)×肿瘤宽度(W)2/2。将每例标本建立的模型随机分为4 组,每组5 只,分别是对照组(CON)、伊立替康(Iri‐notecan,CPT-11)组、5-氟尿嘧啶(5-Fluorouracil,5-FU)组、奥沙利铂(Oxaliplatin,OXA)组,肿瘤体积生长至100~150 mm3时开始给药,CPT-11 注射剂量为100 mg/kg,每周 1 次;5-FU 注射剂量为 10 mg/kg,每周 2 次;OXA 注射剂量为 5 mg/kg,每周 3 次,给药方式均为腹腔注射。
每周测量肿瘤体积2 次,获得不同时间点肿瘤体积,绘制曲线。在测量肿瘤体积的同时称量裸小鼠体重。每组裸小鼠肿瘤体积有任一只达到1 000 mm3以上时即停止实验,异氟烷将裸小鼠麻醉致死,收集样本。
1.2.5 血浆CEA 表达水平检测 治疗结束后,心脏血液采血收集各组裸小鼠血液,收集于抗凝管内,5 000 r/min 离心,将血浆分离,由西京医院检验科检测血浆CEA表达水平。
1.3 统计学方法
研究数据均录入SPSS20.0进行数据分析,计量资料采用()表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PDX模型肿瘤组织生长曲线
连续监测3例P3代PDX 模型肿瘤体积变化,其中D31427 在移植后第20 天即呈现增殖现象,而D34562,D34603 则在移植后第35 天呈现较明显的增殖(图1)。与传统肿瘤细胞系移植模型相比,PDX肿瘤生长速度较慢,用药窗口期更长。
2.2 PDX模型肿瘤组织与人体肿瘤组织形态比较
当PDX 模型传至第3 代时,将肿瘤组织取出进行H&E 染色,并与人肿瘤组织染色结果对比,光学显微镜下显示,3 例PDX 模型肿瘤组织基本保持了原发肿瘤组织的形态(图2)。

图2 PDX模型肿瘤组织与人体肿瘤组织H&E染色对比(×40)
2.3 PDX 模型肿瘤组织与人体肿瘤组织CEA 表达水平对比
当PDX 模型传至第3 代时,将肿瘤组织取出进行IHC 染色,并与人肿瘤组织染色结果对比,结果显示,3 例PDX 模型肿瘤组织CEA 表达水平与人肿瘤组织基本一致(图3),均表达阳性。3例肿瘤样本IHC结果显示肿瘤样本在传代过程中保持了原发肿瘤标志物的表达水平,进一步说明PDX 模型与患者肿瘤的相似性,应用PDX 模型进行药敏试验更能反映临床患者的状况。

图3 PDX模型肿瘤组织与人体肿瘤组织CEA表达水平对比(×40)
2.4 PDX模型单药治疗效果评估
使用不同类型的化疗药物对3 例结肠癌PDX模型治疗 1 月后,结果显示,CPT-11、5-FU、OXA 治疗均可显著抑制肿瘤生长,与对照组相比肿瘤体积显著变小(P<0.05),其中CPT-11 治疗效果最为显著,其次是5-FU 和OXA(图4)。3 例结肠癌PDX 样本均显示CPT-11 治疗效果最明显,无疑对临床患者化疗药物选择具有指导意义。

图4 PDX模型单药治疗效果评估
2.5 PDX模型单药治疗安全性评估
化疗药物对3 例结肠癌PDX 模型治疗时动态监测裸小鼠体重变化,对药物安全性进行评价。结果显示各治疗组裸小鼠体重波动均不明显,体重下降未超过裸小鼠体重的20%;其中,OXA 对D34562和D34603模型裸小鼠体重影响最大,而CPT-11、5-FU相对安全性较高(图5)。结合药物疗效,CPT-11是治疗这3 例结肠癌PDX 模型疗效最好、毒性及不良反应最小的化疗药物。

图5 PDX模型单药治疗安全性评估
2.6 PDX模型血浆CEA水平的变化
化疗药物对3 例结肠癌PDX 模型治疗一月后,分离各组裸小鼠血浆,检测其CEA水平。结果显示,与CON组相比CPT-11,5-FU,OXA治疗均可显著降低CEA 水平(P<0.05);且CPT-11 治疗组CEA 水平显著低于5-FU 和OXA 治疗组(P<0.05);在D34562和D34603 模型中,5-FU 治疗后血浆CEA 水平显著低于OXA 组(P<0.05,图6)。不同PDX 模型在不同药物治疗差异性的表现充分说明了PDX 异质性,对临床前药敏试验和个体化治疗具有指导意义。
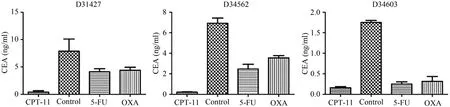
图6 PDX模型血浆CEA表达水平对比
3 讨论
癌症是一类由于基因突变而导致的细胞恶性增殖疾病,每个患者的肿瘤样本都具有自身的异质性,对每种药物的治疗反应具有较大的差异,特别是一些靶向治疗药物,因此选择合适的模型做临床前试验,是保证患者治疗效果的一个关键因素[8-11]。与传统的肿瘤细胞系相比,PDX 模型较好地保持了原发肿瘤的特征,包括细胞的异质性和分子生物学特征等。另外,PDX 模型可以扩增大量的肿瘤组织,液氮保存后方便以后研究使用[12,13]。正是因为这些优势[14],PDX 模型为患者的个体化治疗提供了更可靠的研究工具。
本研究中我们成功地建立了3 例结肠癌PDX模型,经过传代后肿瘤组织生长稳定,建模时间保持在1.5~2 个月之间。CEA是临床公认的广谱肿瘤标志物,包括结肠癌、肺癌、胃癌等,其表达水平高低与患者病情严重程度具有较高的正相关性[11]。本研究结果显示这些肿瘤组织与人肿瘤组织相比较好地保留了原发肿瘤的组织形态特征和CEA的表达。
CPT-11、5-FU 和 OXA 均是结肠癌临床一线化疗药物,但不同患者对药物敏感性不同[6],选择合适的药物对患者至关重要。本研究中我们选择上述三种化疗药物对PDX 模型进行治疗,研究了不同PDX模型对不同化疗药物的反应。结果显示CPT-11 在3例PDX 模型中均显示出良好的治疗效果,5-FU 的效果差异较大,而OXA 对小鼠体重的影响较大。若将这些药物盲目使用,可能部分患者治疗效果不佳,甚至会产生很大的毒性及不良反应。进一步检测PDX 模型血浆中CEA 水平,结果显示CCPT-11、5-FU 和OXA 均体现出良好的治疗效果,特别是CPT-11 治疗后CEA 水平明显低于5-FU 组和OXA治疗组。在D34562和D34603模型中,5-FU治疗组血浆CEA 水平明显低于OXA 组,从分子水平反映了不同药物治疗效果的差异。CPT-11 在3 例结肠癌PDX 模型中均显示出良好的治疗效果且毒性及不良反应最小,对临床结肠癌患者化疗药物选择具有一定的指导意义。PDX 模型应用于个体化治疗也可进行针对性药物筛选,以便给患者提供最佳的治疗方案,延长患者生存期,体现个体化治疗的优势[14]。 综上所述,我们成功建立了 3 例结肠癌PDX 模型,该模型较好地保持了人源性肿瘤组织的特征,药物筛选发现CPT-11 在结肠癌治疗中效果最好且安全性高,为结肠癌患者的个体化治疗提供了良好的动物模型和筛选方案。

