高原红细胞增多症与消化性溃疡出血的关系
许 颖,次仁央金
(1.北京大学第一医院消化内科,北京 100034; 2.西藏自治区人民医院消化内科,拉萨 850000)
我国西藏地区消化性溃疡高发,如合并消化道出血则可能危及患者生命。高原红细胞增多症(high altitude polycythemia,HAPC)是发生在我国西藏等高原地区的一种独特疾病,由于高原长期低氧可诱发红细胞过度代偿增多,导致血液黏滞度增加、血流减慢,从而影响全身各器官组织灌注,加重组织缺氧。HAPC可直接影响消化道黏膜微循环,造成黏膜缺血缺氧性损伤。有研究发现我国西藏地区HAPC患者消化性溃疡的发生率高于非HAPC者[1],但是,HAPC是否增加消化性溃疡患者的出血风险目前尚不清楚。本研究旨在分析消化性溃疡出血的危险因素,着重对HAPC与消化性溃疡出血的关系进行探究,从而为我国西藏地区消化性溃疡的诊治提供依据。
1 资料与方法
1.1 研究对象及方法
采用回顾性病例对照研究的方法,选择2015年1月1日—2021年4月30日在西藏自治区人民医院消化内科行胃镜检查明确为消化性溃疡出血的住院患者398例为病例组,选择同一时期在泌尿外科住院的非肿瘤且无消化性溃疡、无消化道出血病史的2 974例患者作为对照组,应用SPSS 26.0进行个案控制匹配,按照相同性别、年龄±2岁、相同的民族(藏族、汉族),以及相同居住地海拔高度(按<4 000 m和≥4 000 m分组)进行1 ∶1病例匹配,最终病例组与对照组各纳入393例患者病例资料。所有患者均在海拔>2 500 m的我国西藏地区居住时间超过1年,且年龄≥18岁。收集两组患者合并HAPC的情况;同时对消化性溃疡出血其他可能的危险因素[居住地、吸烟、饮酒、服用非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)/抗凝药物、合并慢性疾病(如高血压、糖尿病、心脏病、高脂血症、脑血管病、慢性肺病、关节病等)]两组患者发生情况,进行数据分析。
本研究已经西藏自治区人民医院伦理委员会审查批准(ME-TBHP-21-KJ-062)。
1.2 HAPC诊断标准
根据2004年第6届国际高原医学与低氧生理学学术会议颁布的青海诊断标准,对于长期居住于海拔>2 500 m的世居者或移居者中,男性血红蛋白>210 g/L,女性>190 g/L者,并排除慢性肺病、慢性呼吸功能紊乱或某些慢性病变引起低氧血症继发红细胞增多者,诊断为HAPC[2]。对于消化性溃疡出血患者,如既往无HAPC病史,出血停止后血红蛋白数值仍然符合诊断标准者,也诊断为HAPC。
1.3 统计学分析

2 结果
2.1 病例匹配后患者的一般资料
病例组有393例患者,其中男性331例,女性62例,年龄为(45.47±15.16)岁,藏族353例,汉族40例,居住地海拔高度<4 000 m者316例,≥4 000 m者77例。与对照组1 ∶1匹配后,两组的性别、年龄、民族、居住地海拔高度之间差异无统计学意义(P>0.05,表1)。
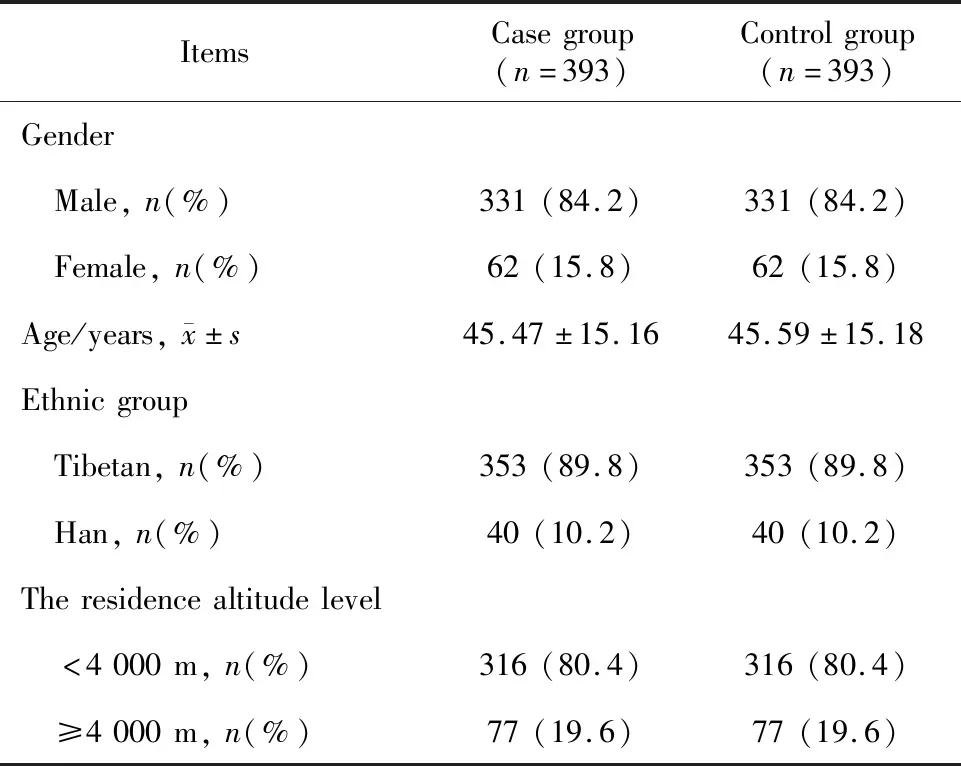
表1 病例组与对照组一般资料表Table 1 General information of the case group and the control group
2.2 我国西藏地区消化性溃疡出血与HAPC及其他危险因素的关系分析
病例组中合并HAPC的患者为28例(7.1%),对照组为5例(1.3%),组间差异有统计学意义(P<0.001), 合并HAPC患者较未合并HAPC者,发生消化性溃疡出血风险显著增加。对可能存在的导致消化性溃疡出血的混杂因素病例组与对照组相比,在居住地、吸烟、饮酒、服用NSAIDs/抗凝药物方面组间差异有统计学意义(P<0.05);在合并慢性病方面,二组患者在合并高血压、糖尿病、心脏病、高脂血症、脑血管病、慢性肺病以及关节病方面差异有统计学意义(P<0.05,表2)。
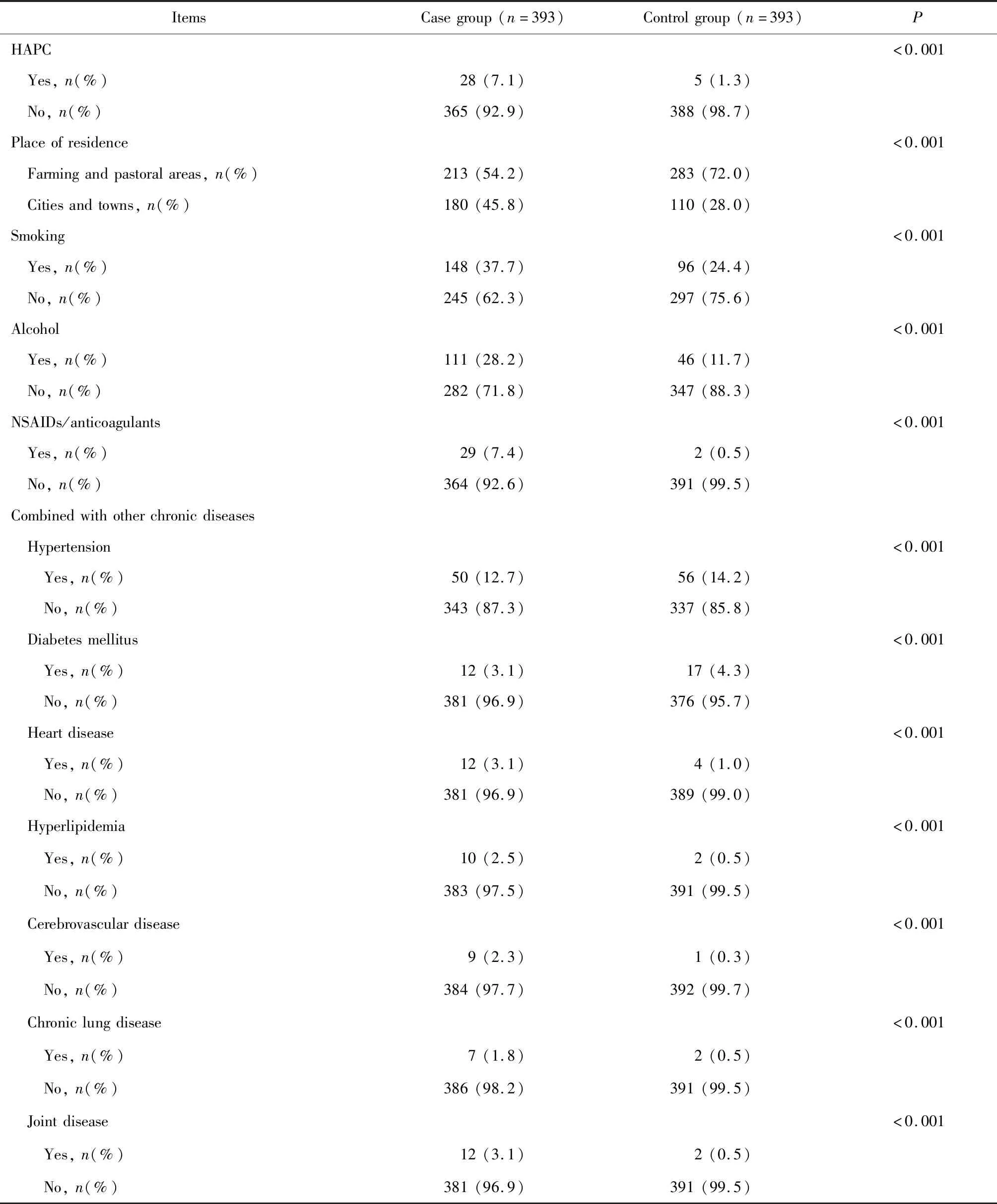
表2 消化性溃疡出血危险因素单因素分析表Table 2 Univariate analysis of risk factors for peptic ulcer bleeding
2.3 我国西藏地区消化性溃疡出血危险因素的多因素Logistic回归分析
将上述单因素分析与消化性溃疡出血可能有关的危险因素纳入Logistic回归模型,分析发现HAPC、居住在城镇、饮酒、服用NSAIDs/抗凝药物为消化性溃疡出血的独立危险因素。合并HAPC患者较未合并HAPC者,发生消化性溃疡出血风险显著增加,单因素分析其OR值为5.953,在调整了居住地、饮酒、服用NSAIDs/抗凝药物等混杂因素后P=0.002,OR=5.270,95%CI:1.806~15.380(表3)。
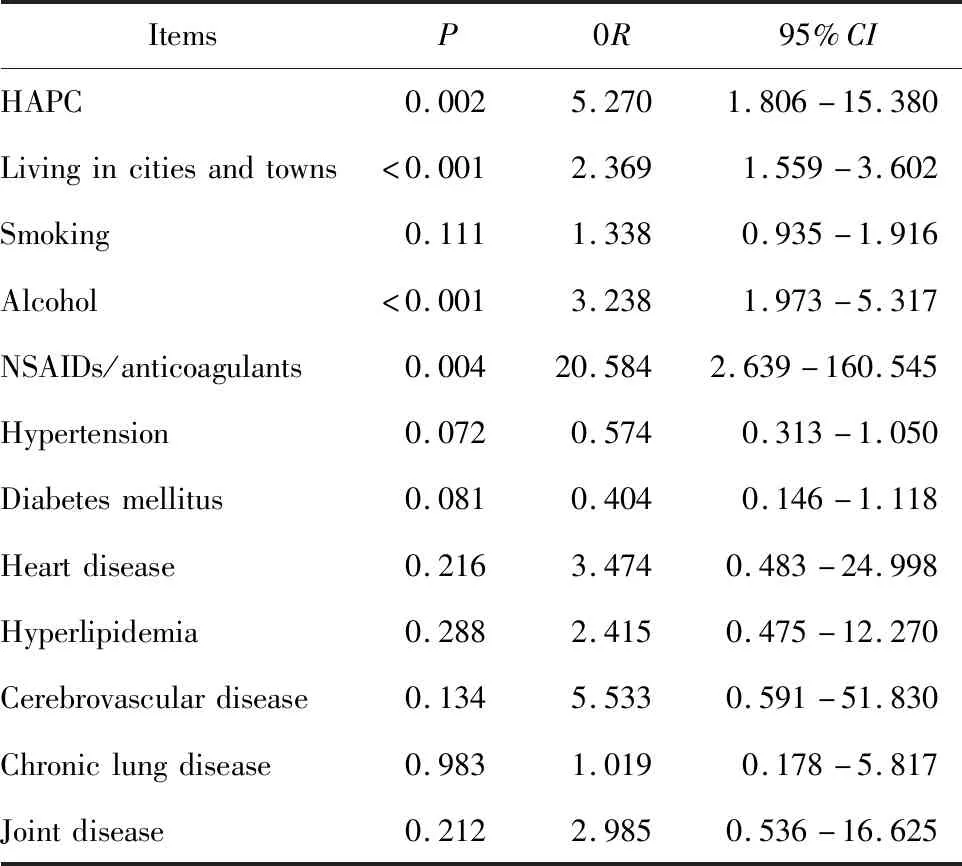
表3 消化性溃疡出血的危险因素多因素Logistic 回归分析Table 3 Multivariate Logistic regression analysis of risk factors for peptic ulcer bleeding
3 讨论
HAPC是由于高原低氧环境引起的红细胞过度代偿性增生的一种常见慢性高原病。有学者报道我国西藏地区18岁以上成人总患病率为6.62%[3];男性多于女性,汉族多于藏族;世居藏族人群的患病率为1.2%~2.6%,移居汉族人群为5.6%[4-5]。随着海拔升高HAPC患病率逐渐增加,在青藏高原海拔2 261~2 980 m地区患病率为1.05%,在3 128~3 980 m地区为3.75%,在4 000~5 226 m地区为11.83%[4]。本研究采取回顾性病例对照的方法,旨在探讨在我国西藏地区HAPC是否增加消化性溃疡出血的风险。前期研究显示[6-7],我国西藏地区消化性溃疡患者男性多于女性,藏族多于汉族,因此本研究把性别、年龄、民族、居住地海拔进行匹配以消除混杂因素的影响。
本研究发现我国西藏地区合并HAPC患者较未合并HAPC者,发生消化性溃疡出血风险显著增加,OR值为5.953;Logistic回归模型在调整了居住地、饮酒、服用NSAIDs/抗凝药物等混杂因素后,OR值为5.270。我国西藏地区居民由于医疗条件及健康意识所限,很少进行定期体检,很多患者并不明确其基础血红蛋白水平,而消化性溃疡出血的患者由于失血会导致血红蛋白下降,从而掩盖其原本合并存在的HAPC,因此本课题组推测实际OR值可能会更高。HAPC会造成血液黏滞度增加,缺氧导致胃黏膜血流障碍,微血管血栓形成,黏膜缺血,胃黏膜防御机制下降,继发糜烂及溃疡[8];此外,HAPC还可造成胃黏膜壁细胞过度增殖,胃酸分泌过多,胃黏膜细胞凋亡显著增加,细胞总体数量减少,同时胃黏膜微血管数量及直径显著增加,从而进一步增加出血的风险[9]。
消化性溃疡出血的危险因素包括男性、吸烟、年龄≥60岁、服用NSAIDs、复合溃疡、多发溃疡、无痛性溃疡等[10]。本研究发现除HAPC外,居住在城镇、饮酒、服用NSAIDs/抗凝药物也是我国西藏地区消化性溃疡出血的危险因素。居住于城镇患者相较于农牧区患者,吸烟及饮酒者更多,易造成消化道黏膜损伤引起出血。我国西藏地区患者喜欢饮用青稞酒及啤酒,酒精可以直接破坏胃黏膜屏障,也可以通过炎症介质的释放诱导胃黏膜损伤,并通过抑制一氧化氮和前列腺素的合成和分泌削弱受损胃黏膜的修复能力,从而引起黏膜水肿、糜烂、出血和坏死[11]。消化性溃疡出血患者组合并心脑血管疾病及关节病多于对照组,因此使用NSAIDs/抗凝药物的概率更高,药物通过局部和系统作用损伤胃黏膜上皮,易造成溃疡形成[6]。
本研究存在以下局限性:第一,幽门螺杆菌与消化性溃疡及出血关系密切,消化性溃疡患者中幽门螺杆菌检出率明显高于普通人群[6],我国西藏地区人群幽门螺杆菌的感染率为57.6%~58.9%[12-13],HAPC合并上消化道出血患者幽门螺杆菌感染率更高达89.2%[14],本研究病例组消化性溃疡出血者仅少数患者进行幽门螺杆菌检测,对照组也未行此检查,故不能明确幽门螺杆菌感染在其中发挥的作用,后续有待进一步随访消化性溃疡出血患者幽门螺杆菌感染情况加以证实;第二,虽然研究设计控制了部分混杂因素,也采取随机模型选择对照组,但仍然可能存在选择偏倚,且对既往病史的追溯产生的回忆偏倚也可能影响结果;第三,本研究样本量偏少,有待进行多中心的大样本流行病学调查,进一步证实HAPC与消化性溃疡出血的关系。
综上所述,在调整了居住地、饮酒、服用NSAIDs/抗凝药物等可能的混杂因素后,HAPC与我国西藏地区消化性溃疡出血的发生风险增加有关,OR值为5.270。对于HAPC合并消化性溃疡患者应积极诊治,以免出现消化道出血等严重并发症。

