小麦蓝矮植原体RNA沉默抑制子互作蛋白的筛选与分析
杨彦君,丁 磊,马 欢,吴云锋
(西北农林科技大学 植物保护学院 农业部西北黄土高原作物有害生物综合治理重点实验室,陕西 杨凌 712100)
植原体(phytoplasma)是一种多态不规则且无细胞壁的单细胞原核生物。据统计,全世界由植原体引发的植物病害达800多种[1],我国有100余种。我国对植原体病害的报道早在明末《沈氏农书》中就有桑萎缩“凡桑一癃,再无医法,断不可留者”的记载[2],植原体病害对经济林木以及农作物造成严重的经济损失。小麦蓝矮植原体(WBD phytoplasma)是一种重要的粮食作物病害,引起植株矮化、丛枝增多、叶尖发黄,感病植株大多因不能正常抽穗而不结实,导致西北干旱麦区减产,发病较重的麦区产量损失可达到60%~80%,甚至绝收[3-6]。因此,对小麦蓝矮植原体的致病机制、与寄主互作关系及其防控技术的研究至关重要。
随着对细菌、真菌、线虫、卵菌、植原体分泌的效应蛋白进行广泛研究,人们对病原物与寄主的互作有了更多的认知[7]。例如稻瘟菌的效应蛋白MoHrip2,通过促进稻瘟菌的侵入以及侵入后的菌丝蔓延使其致病力提高[8];禾谷镰刀菌的效应蛋白FgHrip1,可能作为信号分子激活小麦的水杨酸通路[9]等。农业部西北黄土高原作物有害生物综合治理重点实验室前期从小麦蓝矮(WBD)植原体基因组中筛选发现,SWP16是植原体RNA沉默抑制子,能够抑制寄主的RNA沉默防御系统[10]。目前,国内外对植原体RNA沉默抑制子鉴定及其与寄主的互作蛋白均无相关研究报道。因此,本研究以效应蛋白SWP16为诱饵,利用酵母双杂交系统从小麦cDNA文库中筛选靶标蛋白,探究WBD的互作蛋白,并运用Uniprot对其进行Gene Ontology(GO)注释分析,该研究结果可为植原体病害防治提供新的思路。
1 材料与方法
1.1 试验材料
小麦蓝矮植原体病原以及所用载体,均由农业部西北黄土高原作物有害生物综合治理重点实验室提供。小麦膜系统cDNA文库由西北农林科技大学植物保护学院王保通教授和李强副研究员惠赠。
1.2 试验方法
1.2.1 诱饵载体的构建 根据小麦蓝矮植原体SWP16的基因序列[11]设计带有SfiⅠ酶切位点的特异引物。提取感染小麦蓝矮植原体病株的总DNA,PCR扩增SWP16基因。PCR扩增体系:cDNA 2 μL,2×Prime STAR Max 12.5 μL,上下游引物(100 μmol/L)各1 μL,ddH2O 8.5 μL。PCR反应条件:98 ℃变性10 s,退火15 s,退火温度为引物(链解温度(Tm)±3) ℃;72 ℃延伸30 s,34个循环。PCR扩增所用的引物序列为:SWP16-STE-F:AGCAATCTATTTTATGTAATggccattacggccA-TGATGAACACAAAAAGAA;SWP16-SUC-F:G-CATGCCAAAATATCTGCAATggccattacggccA-TGATGAACACAAAAAGAA;SWP16-STE/SUC-R:GATATCGAATTCCTGCAGATggccgaggcggc-cTTCTTTATTATATTATT。反应产物用琼脂糖凝胶电泳检测,切胶回收后通过同源重组的方法将目的基因SWP16构建到2个诱饵载体pBT3STE和pBT3SUC上,分别命名为pBT3STE-SWP16和pBT3SUC-SWP16,通过引物对测序验证。
1.2.2 最佳筛库条件的确定 将以下6个组合:阳性对照pTSU2-APP+pNubG-Fe65,阴性对照pTSU2-APP+pPR3-N,功能验证(判断酵母是否能够正常表达出融合蛋白)pBT3STE-SWP16+pOst1-NubI和pBT3SUC-SWP16+pOst1-NubI,自激活检测(判断诱饵蛋白是否会与空文库质粒互作)pBT3STE-SWP16+pPR3-N和pBT3SUC-SWP16+pPR3-N共转进酵母感受态菌株NMY51中,随后将转化物涂布在DDO(SD-Trp-Leu)和QDO(SD-Trp-Leu-His-Ade)固体培养基上,28 ℃培养并观察菌落生长状态。制作含0,5,10,15,20,25,30 mmol/L 3-AT的QDO平板,以OD600值为0.01时自激活酵母菌斑完全不生长为最佳筛选条件。
1.2.3 小麦cDNA文库的筛选与复筛验证 先将诱饵载体转化到NMY51酵母菌中制备诱饵感受态,再将文库质粒转入并分别涂布在加入适当3-AT浓度的DDO(3个)和QDO(40个)选择培养基上,在28 ℃培养箱中培养48~96 h,挑取单菌落重新在与筛库条件相同的选择培养基上进行培养,重复3次后依然生长的克隆认为阳性克隆[12]。
1.2.4 二次互作验证 将获得的阳性克隆重新在QDO选择培养基上培养,并进行α-半乳糖苷酶检测(每100 mL培养基加入200 μL α-半乳糖苷酶,并对阳性克隆进行避光培养)。挑取显蓝菌斑使用裂解液处理,并用高保真酶RCP扩增检测,PCR反应体系及反应条件同1.2.1节。有扩增条带的送测序,无扩增条带的提质粒后再测序。
1.2.5 生物信息学分析 将上述测序结果在NCBI BLAST(http://blast.nbi.nlm.nih.gov/Blast.cgi)中进行比对,得到的候选蛋白使用Uniprot进行Gene Ontology(GO)注释(http://www.uniprot.org)[13],最后将所得结果在Excel 2020中整理汇总。
2 结果与分析
2.1 诱饵载体的构建
用小麦蓝矮植原体总DNA为模板,扩增得到210 bp的SWP16基因条带,通过同源重组法连接至pBT3STE和pBT3SUC载体上(图1)。转化大肠杆菌后挑取阳性克隆进行测序,经DNAMAN 9.01软件比对序列无误。
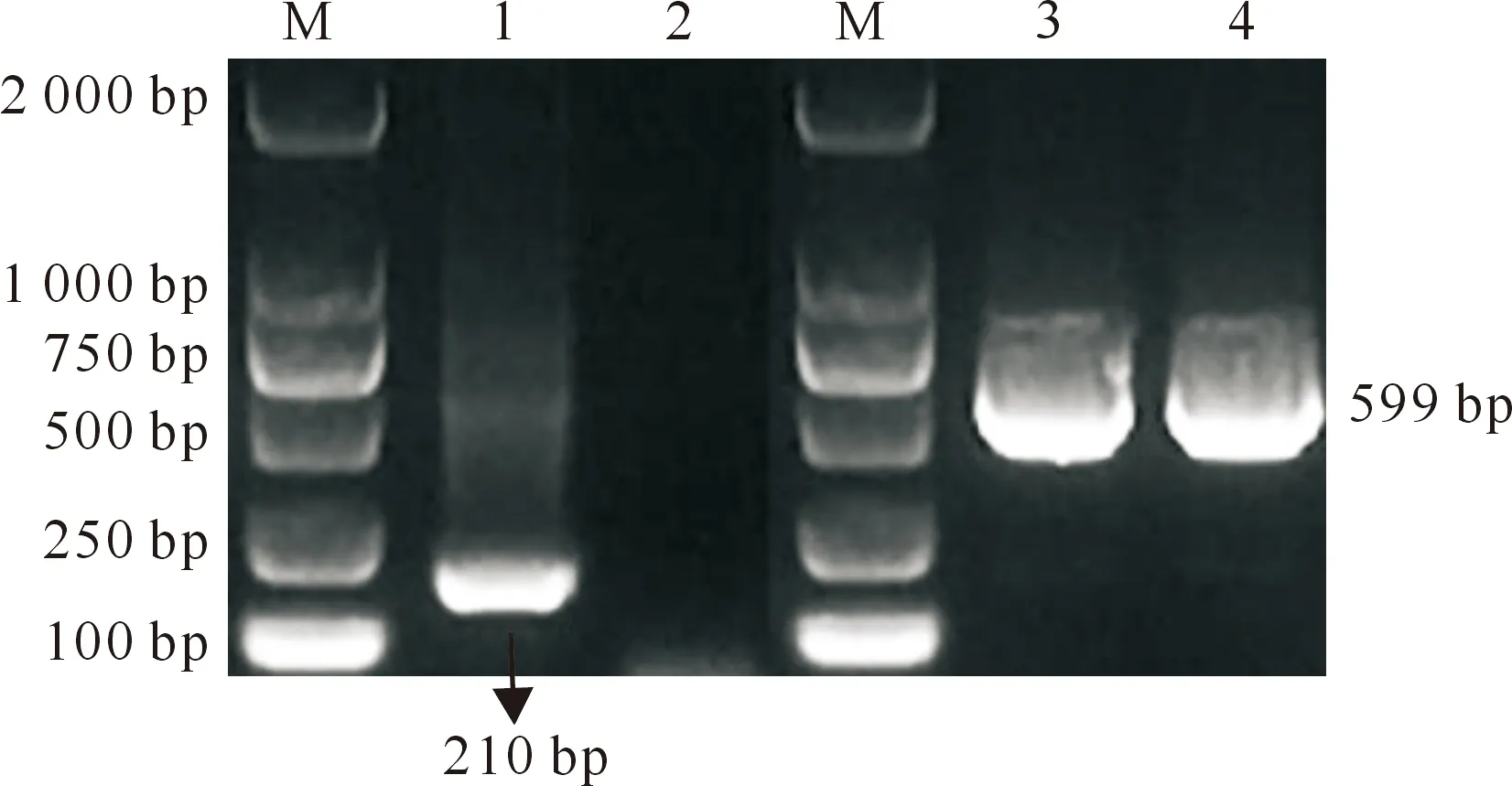
M.DL2000;1.SWP16;2.阴性对照;3.pBT3STE-SWP16;4.pBT3SUC-SWP16
2.2 最佳筛库条件的确定
不同组合在DDO(SD-Trp-Leu)和QDO(SD-Trp-Leu-His-Ade)固体培养基平板上的生长状况如图2所示。
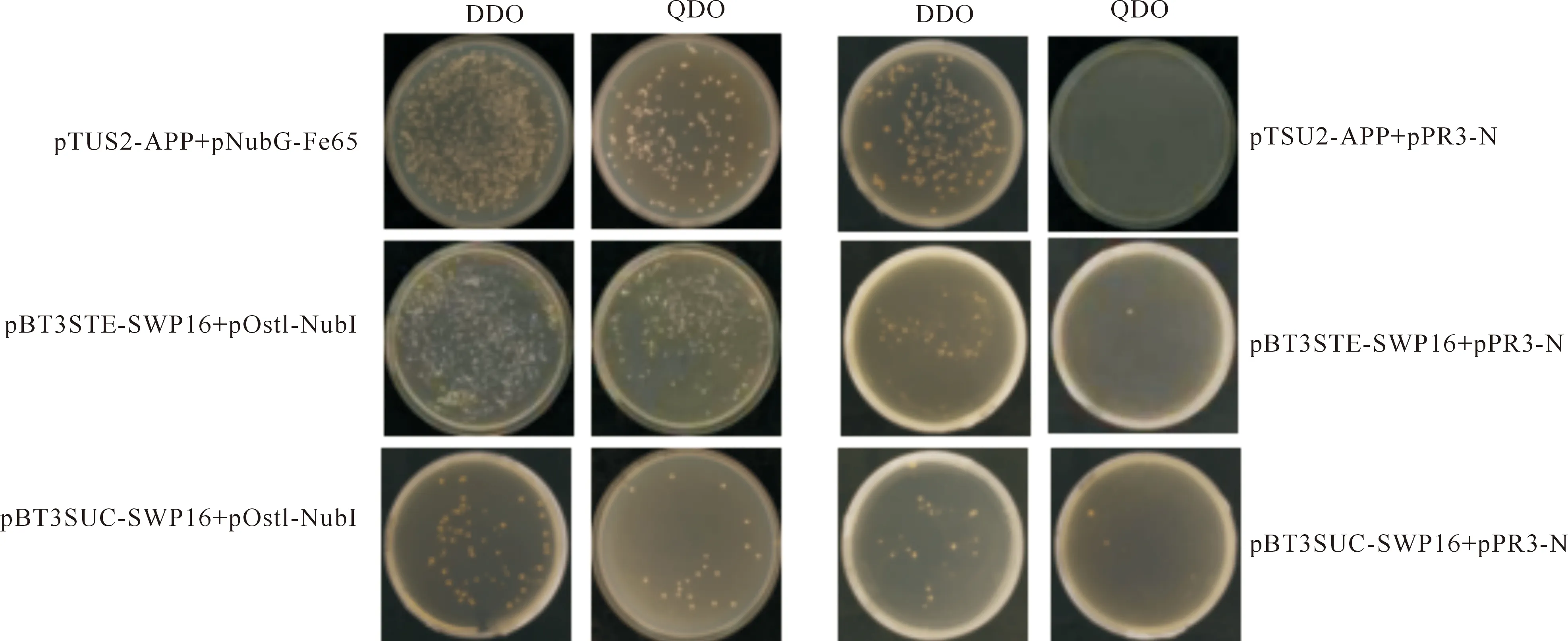
图2 诱饵蛋白的功能验证和自激活测试
由图2可知,阳性对照pTSU2-APP+pNubG-Fe65可以在DDO和QDO平板上正常生长,阴性对照pTSU2-APP+pPR3-N不能在QDO上生长,说明酵母结构功能可靠。为了验证诱饵蛋白是否可以在酵母体内正常行使功能,将2个功能验证组合pBT3STE-SWP16+pOst1-NubI和pBT3SUC-SWP16+pOst1-NubI共转进酵母NMY51后,在DDO和QDO选择性培养基上28 ℃培养48~96 h,结果表明两者均能在DDO和QDO培养基上正常生长,说明pBT3STE-SWP16和pBT3SUC-SWP16都可以在酵母中正常表达出融合蛋白N-Cub-LexA-VP16,Cub与pOst1-NubI表达的NubI互作从而激活下游报告基因的表达,使菌落在选择培养基上生长,且pBT3STE-SWP16活性更好。
2个自激活检测组合pBT3STE-SWP16+pPR3-N和pBT3SUC-SWP16+pPR3-N均可在DDO培养基上正常生长,说明共转化成功;而在QDO选择培养基上基本不生长,说明自激活活性较低,即诱饵蛋白基本不与空文库质粒互作,可以进行筛库试验。
综合比较后发现,pBT3STE-SWP16在QDO选择培养基上的功能活性更好且自激活活性较低,因此选择pBT3STE-SWP16作为筛库的诱饵蛋白,确定20 mmol/L 3-AT为筛选文库的最佳浓度(图3)。

图3 20 mmol/L 3-AT 的QDO培养基
2.3 互作蛋白的筛选与二次验证
将诱饵载体pBT3STE-SWP16与小麦文库质粒共转酵母NMY51后,涂布在40个含有20 mmol/L 3-AT的QDO平板上,28 ℃培养48~96 h后挑取单菌落重新在与筛库条件相同的选择培养基上进行3次重复培养,对依然生长的阳性克隆进行α-半乳糖苷酶检测,全部正常生长且显蓝色(显蓝越明显互作越强烈)。挑取显蓝菌斑使用裂解液处理后扩增测序,对测序结果进行Blast分析整理,结果显示从小麦文库中共获得20种互作蛋白(表1),复筛验证和α-半乳糖苷酶检测结果(图4)显示,20种候选蛋白全部与SWP16互作。

A.复筛验证;B.α-半乳糖苷酶检测
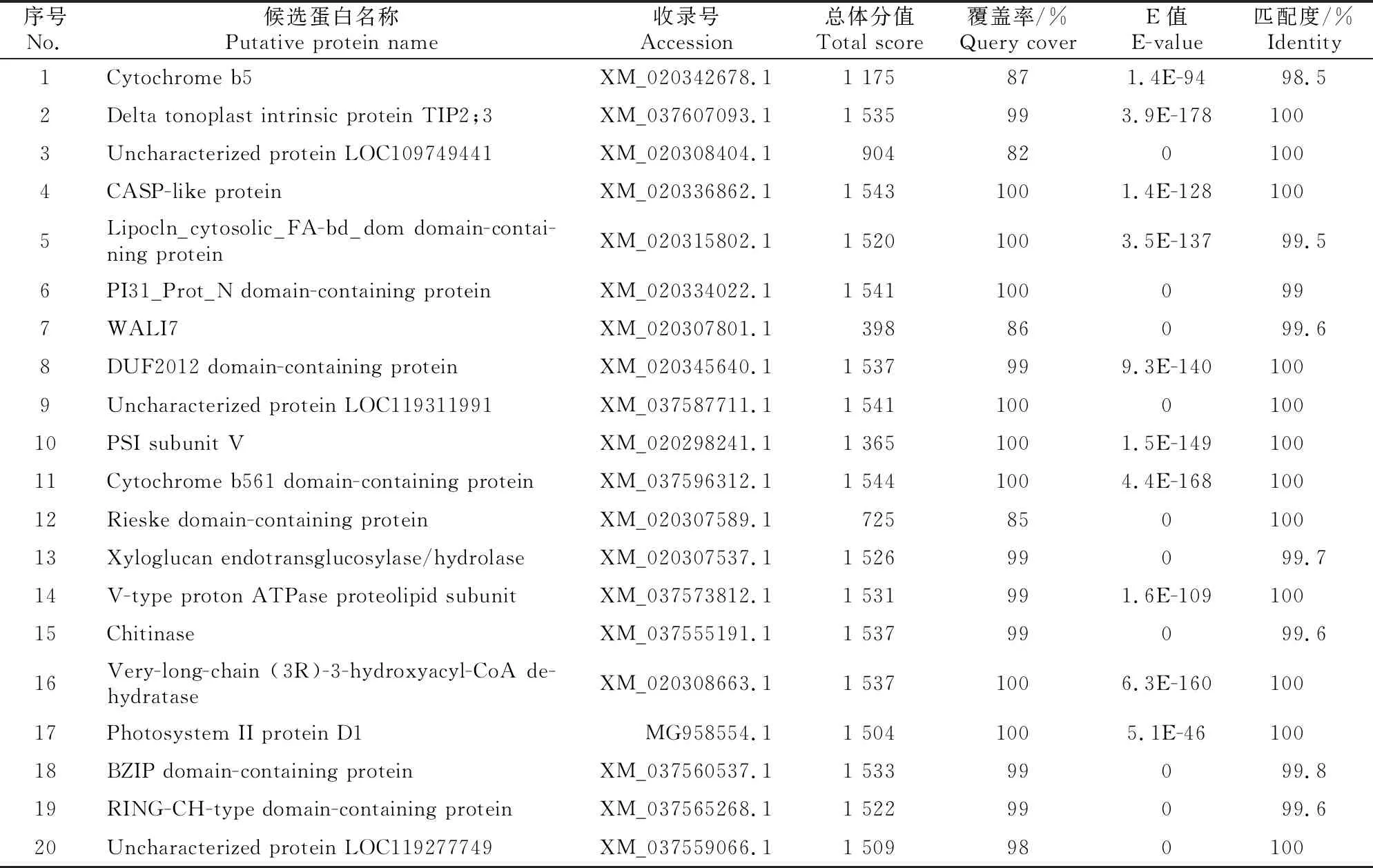
表1 与SWP16互作的小麦文库蛋白
2.4 生物信息学分析及通路预测
用Blast在小麦(Triticumaestivum)基因组中比对到20种互作蛋白基因,GO注释分析表明,其中14种互作蛋白参与运输、pH调节、光合作用、内质网应激反应、蛋白质泛素化等生理过程,剩余6种互作蛋白参与的生理过程未知;分子功能包括几丁质酶活性、反转运蛋白活性、脱水酶活性、转移酶活性、转录因子活性等11类;其中18种互作蛋白存在于6种细胞组分中,包括线粒体(1个)、内质网(3个)、细胞膜(7个)、细胞质(2个)、叶绿体(4个)、细胞壁(1个),另外2个候选蛋白定位未知(图5)。
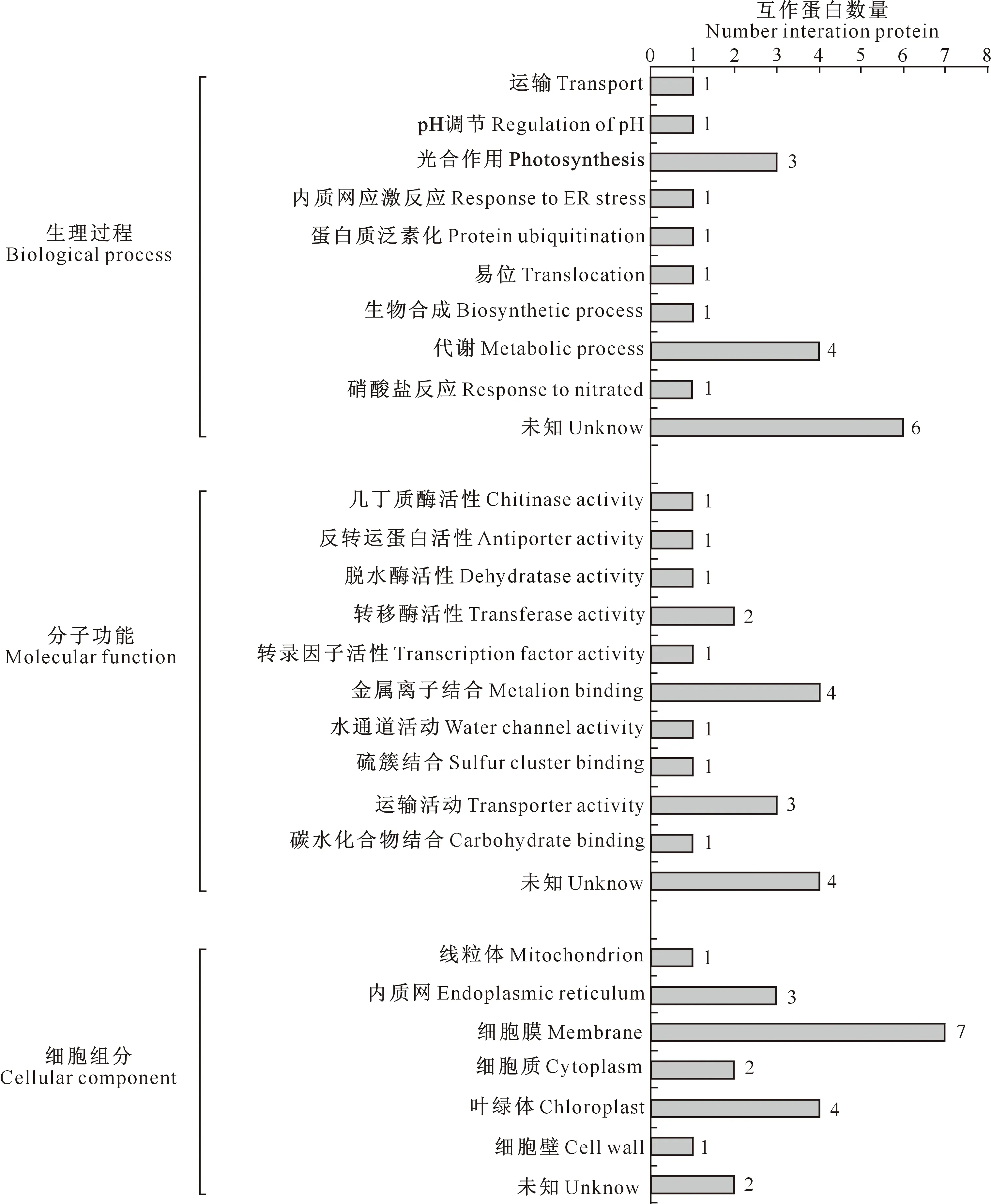
图5 小麦互作蛋白的生物学信息分析
3 讨 论
本研究以小麦蓝矮植原体SWP16为诱饵,从小麦cDNA文库中筛选到细胞色素b5、液泡膜相关蛋白,水解蛋白等20种互作蛋白。其中一部分是与光合作用相关的寄主蛋白,例如细胞色素B561、Rieske蛋白、PSI亚基Ⅴ、光系统Ⅱ蛋白D1等,其中细胞色素B561是一种负责电子传递的整膜蛋白,在植物生长发育、抗毒素防御反应方面具有重要作用,并且能够防止植物在干旱条件下由于过度光照而受损[14-15];对Rieske蛋白进行基因沉默后,在拟南芥和烟草上都可以观察到相似的褪绿、黄化、矮化,植株长势弱,发育迟缓等现象[16];光系统Ⅱ蛋白D1的周转可以缓解PSⅡ光抑制程度, 而抑制D1蛋白周转可导致O3胁迫下植物叶片发生更加严重的光抑制[17];PSI亚基Ⅴ影响植物光合作用的铁离子跨膜转运蛋白活性[18]。除此之外,Rieske 蛋白、光系统Ⅱ蛋白D1、BZIP还参与了光合作用中的光合电子传递、光系统Ⅱ的电子传递途径。研究认为,植物受植原体侵染后与光合作用受阻密切相关,例如毛泡桐在患丛枝病后光系统Ⅱ叶绿素a/b结合蛋白表达量均下调[19],在枣疯病的研究中也发现关键光合基因在感病品种中下调[20],由此推断SWP16与寄主蛋白互作可能影响小麦的光合作用。筛库还获得部分与细胞凋亡相关的蛋白,比如细胞色素b5、CASP蛋白。其中细胞色素b5通过与cytP450以及cytc之间的相互作用来调节微粒体单加氧酶中活性氧物质的产生,进而引发细胞调亡[21-22]。因此,推测SWP16可能与细胞色素b5结合后促进细胞凋亡,从而进一步促进植原体侵染。另外,与SWP16互作的还有一些与逆境胁迫相关的蛋白,当植物处于盐胁迫条件下,V-ATPase显示出高度的可塑性和灵敏性,对细胞的正常生命活动起着重要的调节作用[23];含Wali7结构域的蛋白质在植物与金属离子的耐受/解毒中起作用,参与植物的pH调节进而影响植物发病[24]。除此之外,还得到了目前研究较少的一些蛋白质,如DUF2012转录因子结构域蛋白、超长链(3R)-3-羟酰基-CoA脱水酶等,它们与植物的互作关系有待进一步探究。
自从本实验室首次完成小麦蓝矮植原体基因组测序[25],先后鉴定出植原体丛枝效应蛋白SWP1[26]、RNA沉默抑制子SWP16[10]和激发宿主防御反应以及抑制坏死反应的效应蛋白[27],极大推动了植原体效应蛋白的致病机理研究,提升了我国植原体领域的国际地位。本研究进一步通过酵母双杂交试验筛选获得了20种与小麦蓝矮植原体效应蛋白SWP16互作的蛋白,并对其进行了分析注释,有助于进一步推动对小麦蓝矮植原体病害的研究和防控。

