昼夜节律变化对RORs表达及RORs激动剂SR1078对角膜上皮创伤修复的影响
徐鹏洋 李志杰 薛芸霞
1暨南大学基础医学院病理生理学系,广州 510632;2暨南大学基础医学院眼科研究所,广州 510632
角膜上皮细胞通过不断更新的方式来保持角膜上皮的稳态,角膜上皮细胞更新节律异常会造成角膜上皮稳态的失衡,引起角膜上皮缺损[1]。角膜损伤的修复是一个复杂的过程,主要过程为创口区域炎症反应的触发引起炎症细胞从角膜缘周围血管渗出,清除损伤区域的坏死组织,并伴随着炎症反应的消退,使基底细胞重塑角膜基质。视黄酸相关孤儿受体(retinoic acid-related orphan receptors,RORs)由RORα、RORβ和RORγ 3个成员组成,分布在全身各个部位,在生理节律调节、新陈代谢紊乱、炎症发生以及免疫系统调节等生理病理过程中扮演重要角色。ROR基因转录具有节律性,当小鼠RORα缺失时,会扰乱生物钟基因Bmal1的调控,引起昼夜节律的异常[2]。相关研究表明,小鼠缺乏RORα/RORγ可显著降低Cry1、Bmal1、Rev-Erbα和Per2等时钟基因的活性[3]。RORs激动剂SR1078能够合成RORα/γ,提高RORα和RORγ RNA的表达活性,促使RORα/RORγ与目的基因启动子上的ROR调控元件(ROR response element,RORE)结合,刺激RORα/RORγ目的基因的表达[4]。昼夜节律是生命适应内部环境周期变化演变而来的内在计时机制,其中环境对机体的节律性改变最大的机制是光照/黑暗循环,在维持细胞活动(如激素分泌、细胞增生和细胞内代谢等)的转化及有序性和协同性方面发挥重要作用。研究表明,不同的光照条件下角膜上皮的有丝分裂能力会发生明显改变,影响角膜创伤修复的能力[5-7]。可见光的光子会破坏DNA和细胞膜、线粒体等细胞器,并通过产生活性氧和破坏细胞色素而影响细胞的呼吸作用[8-9]。研究发现昼夜节律对角膜的正常生长发育和角膜厚度变化具有较大影响[10],角膜上皮的更新具有日节律性[7],光照节律也能够引起大鼠视网膜中时钟基因的表达发生改变[11]。越来越多的证据表明,许多疾病的发生与基因突变或环境因素引起的昼夜节律改变密切相关[12],RORα/RORγ在角膜、大脑、胸腺、肝脏和肺脏等多种组织中均有表达,目前关于RORα/RORγ的相关研究主要聚焦于各种癌症、脑部及淋巴细胞发育的研究,而RORα/RORγ对角膜影响的相关研究较少。本研究拟探讨SR1078对角膜上皮修复的动力学影响,观察不同昼夜节律下RORα/RORγ表达量的动态变化及SR1078作用下角膜创伤修复动力学以及分裂细胞的动态变化,为SR1078对角膜上皮细胞创伤修复的调控及其影响因素的研究提供新的实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物 选取SPF级健康无眼疾雌性6~8周龄C57BL/6小鼠222只(购于广东省医学实验动物中心),饲养于(24±2)℃、SPF级动物房中,饲养过程中自由进食。本研究严格遵循美国视觉与眼科学研究协会制定的ARVO声明,经暨南大学实验动物伦理委员会审核批准(批文号:JN-A-2002-01)。
1.1.2主要试剂及仪器 SR1078(1246525-60-9)(美国MedChemExpress公司);磷酸盐缓冲液(phosphate buffered saline,PBS)(广州瑞泰生物科技有限公司);RNAsimple总RNA提取试剂盒(北京天根生化科技有限公司);体积分数10% Triton-X100、水合氯醛、荧光素钠、牛血清白蛋白(bovine serum albumin,BSA)(广州斯佳生物技术有限公司);4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染液(上海碧云天生物试剂公司);ReverTra Ace qPCR RT试剂盒、SYBR Green Master Mix(日本Bio-Toyobo公司);引物(美国Thermo Fisher公司)。实时荧光定量PCR仪、梯度PCR仪(美国Bio-Rad公司);高尔夫样刀(美国Accutome公司);SZ61体式显微镜、正置荧光显微镜(日本Olympus公司)。
1.2 方法
1.2.1小鼠分组及干预 根据小鼠饲养室接受的光照节律不同,采用随机数表法将180只小鼠分为昼夜节律正常组、全昼组、全夜组、昼夜颠倒12 h组、昼夜颠倒3周组,每组36只;根据接受的干预不同,采用随机数表法将48只小鼠角膜损伤模型分为SR1078组和PBS对照组,每组24只。各组小鼠造模前均置于可控制光照(光照强度300 lx)及黑暗时间的节律箱中,其中昼夜节律正常组、PBS对照组和SR1078组节律箱的连续光照时间为7:00~19:00,连续黑暗时间为19:00~次日7:00;昼夜颠倒12 h组光干预节律时间相反;昼夜颠倒3周组黑暗/光照模式同昼夜颠倒12 h组,但连续3周;全昼组为连续24 h光照状态;全夜组为连续24 h黑暗状态。SR1078组和PBS对照组于角膜上皮损伤及修复模型造模后0 h分别采用SR1078溶液和PBS每隔6 h点眼1次,持续至造模后48 h。根据Zeitgeber Time计时法,以开始光照时间7:00记为ZT0,以关闭光照时间19:00记为ZT12。
1.2.2实时荧光定量PCR法测定角膜中RORα和RORγ mRNA表达量 采用颈椎脱臼法将不同光干预节律组小鼠处死,每组各时间点(ZT1、ZT5、ZT9、ZT13、ZT17、ZT21)获取3只小鼠,双眼含带角膜缘的完整角膜。采用RNAsimple总RNA提取试剂盒提取总RNA,通过ReverTra Ace qPCR RT试剂盒合成cDNA,总反应体系为30 μl,反应条件为:33 ℃ 20 min,96 ℃ 7 min,3 ℃ 3 min,置于-20 ℃保存备用。采用SYBR Green Master Mix在Applied Biosystems 7900HT实时PCR系统中进行定量PCR,分别以小鼠RORα和RORγ为引物,RORα正向引物序列为5’-TCAGCA GAGCAATGCCACCTAC-3’,反向引物序列为5’-TGGA CATCCGACCAAACTTGAC-3’;RORγ正向引物序列为5’-CAAGTCATCTGGCATCCACTACGG-3’,反向引物序列为5’-GCGGCTGGTTCGGTCAATGG-3;以GAPDH为内参,GAPDH正向引物序列为5’-GAAGGAC ACTGAGCAAGAG-3’,反向引物序列为5’-TGCAGCG AACTTTATTGATG-3’。热循环方案为:95 ℃ 510 s,60 ℃ 15 s,72 ℃ 15 s。采用2-ΔΔCt法计算各组不同时间点RORα和RORγ mRNA相对表达量。
1.2.3角膜上皮损伤及修复模型的建立 PBS对照组和SR1078组各选取3只小鼠,参照文献[13]中的方法,小鼠腹腔内注射质量分数10%水合氯醛(0.05~0.1 ml)进行全身麻醉,在解剖台用直径0.2 cm的环钻标记小鼠双眼角膜中央区域,采用高尔夫样刀机械性刮除标记区域的角膜上皮。采用质量分数2%荧光素钠点眼评估角膜上皮缺损面积。造模后即刻(0 h)开始,每隔4 h采用Adobe Photoshop CC2019软件测量角膜上皮缺损面积,直至角膜完全上皮化。计算并比较2个组小鼠角膜上皮缺损率。角膜上皮缺损率=造模后某时间点上皮缺损面积/造模后0 h角膜缺损面积×100%。造模后0 h角膜上皮缺损率为100%。
1.2.4全角膜铺片及免疫荧光染色法观察角膜上皮基底细胞分裂数 分别于造模后12、18、24、30、36、42和48 h采用颈椎脱臼法处死PBS对照组和SR1078组小鼠各3只,摘取双侧眼球,体积分数2%甲醛溶液中固定40~60 min。在PBS中取出含角膜缘的完整角膜。用调速摇床振荡器将角膜上皮置于PBS中清洗3次,每次5 min,置于质量分数2% BSA溶液200 ml中封闭15 min,用手术刀片将角膜上皮分为中央相连的4个瓣,角膜上皮面朝上呈放射状置于载玻片上,滴加含有DAPI的封片剂,盖上盖玻片,4 ℃避光保存。正置荧光显微镜下观察角膜上皮分裂细胞,DAPI染色细胞的细胞质呈亮蓝色,细胞核为白色,未分裂的角膜上皮基底细胞呈圆形或椭圆形,分裂细胞呈哑铃状。
1.2.5小鼠角膜分区及上皮分裂细胞计数 根据文献[14]的方法对角膜进行分区(图1),从角膜缘到角膜中央共将角膜分为5个区,在5个区的角膜中选取经角膜中央的纵向和横向2条相互垂直的径线,荧光显微镜下在其横向径线和纵向径线分别均匀选取9个目标视野进行观察并拍照,评估分裂细胞的增生及迁移情况,各视野分裂细胞之和作为完整角膜的分裂细胞数,对PBS对照组和SR1078组小鼠角膜上皮分裂细胞数量进行比较。

图1 角膜分裂细胞计数分区示意图Figure 1 Schematic diagram of corneal zoning
1.3 统计学方法

2 结果
2.1 各组不同时间点小鼠角膜RORα和RORγ mRNA相对表达量比较
昼夜节律正常组、全昼组、全夜组、昼夜颠倒12 h组和昼夜颠倒3周组不同时间点小鼠角膜RORα mRNA相对表达量总体比较差异均有统计学意义(F分组=143.28,P<0.001;F时间=30.11,P<0.001),其中与昼夜节律正常组比较,全夜组小鼠在ZT5、ZT9、ZT13和ZT17角膜中RORα mRNA相对表达量均显著降低,全昼组小鼠在ZT5、ZT9和ZT13角膜中RORα mRNA相对表达量均显著降低,昼夜颠倒12 h组RORα mRNA相对表达量在ZT9、ZT13和ZT17均显著降低,昼夜颠倒3周组RORα mRNA相对表达量在ZT9、ZT13、ZT17和ZT21均显著降低,差异均有统计学意义(均P<0.05)(表1)。

表1 各组不同时间点小鼠角膜中RORα mRNA相对表达量比较(x±s)Table 1 Comparison of the relative expression level of RORα mRNA in mouse cornea at various time points among different groups (x±s)组别样本量不同时间点RORα mRNA相对表达量ZT1ZT5ZT9ZT13ZT17ZT21昼夜节律正常组62.43±0.082.63±0.287.40±1.274.40±1.044.67±1.312.83±0.97全夜组60.66±0.020.34±0.45a2.35±0.59a0.69±0.07a1.07±0.28a2.11±0.82全昼组62.19±0.121.12±0.18a1.43±0.18a0.93±0.25a3.33±0.992.97±0.60昼夜颠倒12 h组61.59±0.552.24±0.353.73±0.21a2.19±0.23a2.37±0.55a1.71±0.14昼夜颠倒3周组60.96±0.191.05±0.240.22±0.21a0.91±0.49a1.09±0.01a0.13±0.03a 注:F分组=143.28,P<0.001;F时间=30.11,P<0.001.与各自时间点昼夜节律正常组比较,aP<0.05(两因素方差分析,Tukey检验) ROR:视黄酸相关孤儿受体 Note:Fgroup=143.28,P<0.001;Ftime=30.11,P<0.001.Compared with the normal circadian rhythm group at corresponding time points,aP<0.05(Two-way ANOVA,Tukey test) ROR:retinoic acid-related orphan receptor
昼夜节律正常组、全昼组、全夜组、昼夜颠倒12 h组和昼夜颠倒3周组不同时间点小鼠角膜RORγ mRNA相对表达量总体比较差异均有统计学意义(F分组=91.27,P<0.001;F时间=66.34,P<0.001),其中与昼夜节律正常组比较,全夜组和全昼组小鼠角膜RORγ mRNA相对表达量在ZT13、ZT17、ZT21均显著降低,昼夜颠倒12 h组RORγ mRNA相对表达量在ZT13和ZT17均显著降低,昼夜颠倒3周组RORγ mRNA相对表达量在ZT9、ZT13、ZT17和ZT21均显著降低,在ZT5显著增加,差异均有统计学意义(均P<0.01)(表2)。
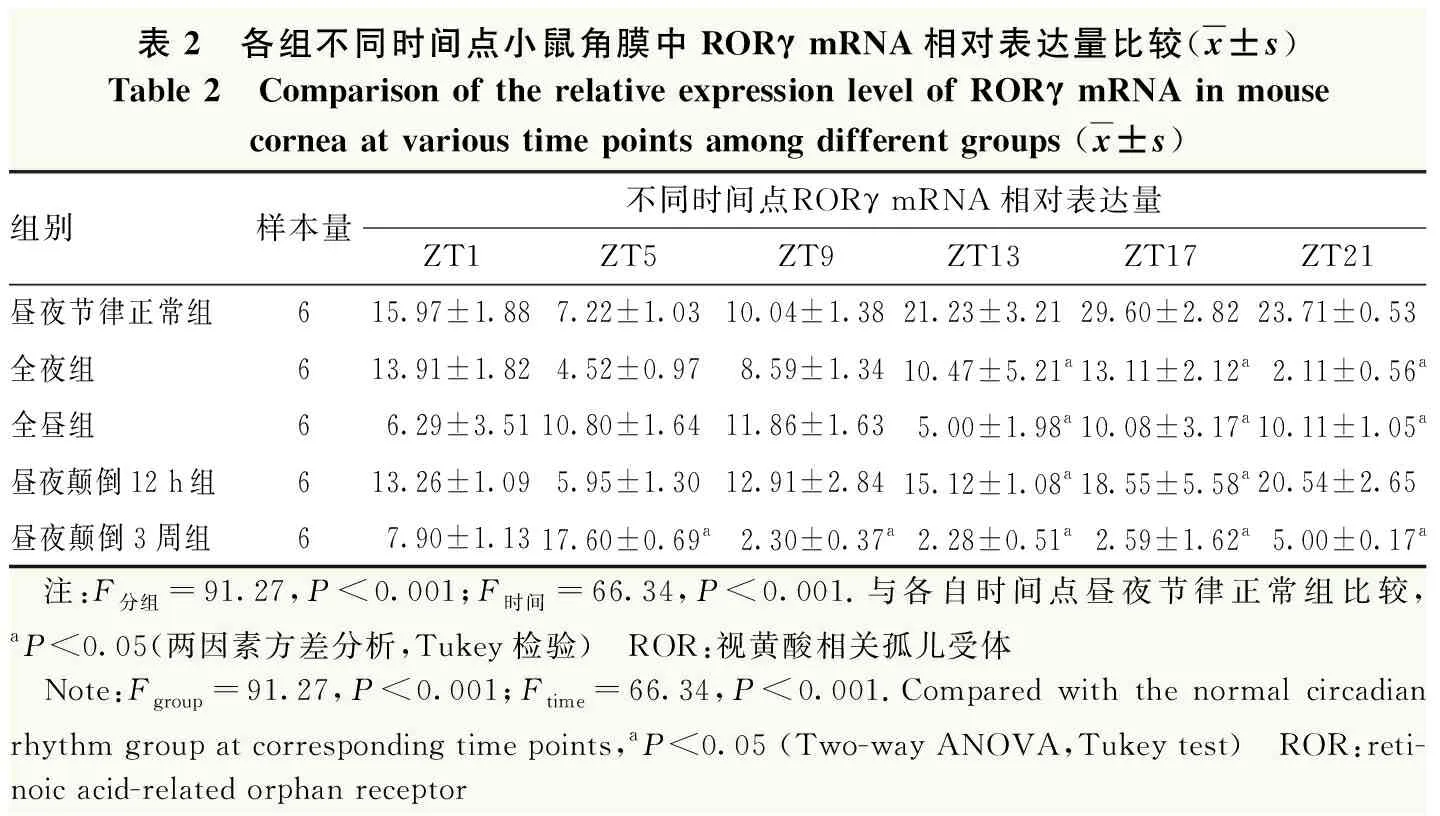
表2 各组不同时间点小鼠角膜中RORγ mRNA相对表达量比较(x±s)Table 2 Comparison of the relative expression level of RORγ mRNA in mouse cornea at various time points among different groups (x±s)组别样本量不同时间点RORγ mRNA相对表达量ZT1ZT5ZT9ZT13ZT17ZT21昼夜节律正常组615.97±1.887.22±1.0310.04±1.3821.23±3.2129.60±2.8223.71±0.53全夜组613.91±1.824.52±0.978.59±1.3410.47±5.21a13.11±2.12a2.11±0.56a全昼组66.29±3.5110.80±1.6411.86±1.635.00±1.98a10.08±3.17a10.11±1.05a昼夜颠倒12 h组613.26±1.095.95±1.3012.91±2.8415.12±1.08a18.55±5.58a20.54±2.65昼夜颠倒3周组67.90±1.1317.60±0.69a2.30±0.37a2.28±0.51a2.59±1.62a5.00±0.17a 注:F分组=91.27,P<0.001;F时间=66.34,P<0.001.与各自时间点昼夜节律正常组比较,aP<0.05(两因素方差分析,Tukey检验) ROR:视黄酸相关孤儿受体 Note:Fgroup=91.27,P<0.001;Ftime=66.34,P<0.001.Compared with the normal circadian rhythm group at corresponding time points,aP<0.05 (Two-way ANOVA,Tukey test) ROR:reti-noic acid-related orphan receptor
2.2 PBS对照组与SR1078组小鼠角膜上皮缺损率比较
随着造模后时间的延长,SR1078组和PBS对照组小鼠角膜上皮荧光素染色面积逐渐缩小,造模后48 h角膜染色消失,角膜上皮光滑。造模后12 h SR1078组小鼠角膜上皮荧光素染色面积小于PBS对照组,造模后24 h 2个组角膜上皮染色面积接近(图2)。造模后12 h,SR1078组角膜上皮缺损面积明显小于PBS对照组。造模后不同时间点PBS对照组与SR1078组小鼠角膜角膜上皮缺损率总体比较差异均有统计学意义(F分组=74.01,P<0.001;F时间=5 171.48,P<0.001),其中造模后12 h SR1078组角膜上皮角膜缺损率明显低于PBS对照组,差异有统计学意义(P<0.05);造模后18 h和24 h,2个组角膜上皮角膜缺损率比较差异均无统计学意义(均P>0.05)(表3)。

图2 PBS对照组和SR1078组造模后各时间点角膜荧光素染色面积变化 随着造模后时间的延长,2个组小鼠角膜荧光素染色面积均逐渐缩小,造模后12 h SR1078组小鼠角膜荧光素染色面积小于PBS对照组,造模后48 h 2个组角膜荧光素染色均消失 PBS:磷酸盐缓冲液;SR1078:视黄酸受体相关孤儿受体激动剂Figure 2 Comparison of corneal fluorescein staining area at various time points between the PBS control group and SR1078 group The corneal fluorescein staining area was gradually shrunk in the two groups over time.The corneal fluorescein staining area was smaller in the SR1078 group compared with the PBS control group at 12 hours after modeling.The corneas were clear at 48 hours after modeling in both groups PBS:phosphate buffered saline;SR1078:retinoic acid receptor-related orphans receptor agonist

表3 PBS对照组和SR1078组小鼠角膜创伤后不同时间点角膜上皮缺损率比较(x±s,%)Table 3 Comparison of corneal epithelial defect rate at different time points between PBS control group and SR1078 group (x±s,%)组别样本量创伤后不同时间点角膜上皮缺损率0 h12 h18 hPBS对照组6100.000±0.00045.717±1.90220.122±3.421SR1078组6100.000±0.00025.997±2.969a19.118±3.270 注:F组别=74.01,P<0.001;F时间=5 171.48,P<0.001.与PBS对照组比较,aP<0.05(两因素方差分析,LSD-t检验) PBS:磷酸盐缓冲液;SR1078:视黄酸受体相关孤儿受体激动剂 Note:Fgroup=74.01,P<0.001;Ftime=5 171.48,P<0.001.Compared with the PBS control group,aP<0.05 (Two-way ANOVA,LSD-t test) PBS:phosphate buffered saline;SR1078:retinoic acid receptor-related orphan receptor agonist
2.3 小鼠角膜上皮缺损率与RORα和RORγ mRNA相对表达量的关联性
RORα和RORγ mRNA相对表达量与小鼠角膜上皮缺损率均呈中度正相关(r=0.614、0.537,均P<0.01)。RORα mRNA相对表达量是小鼠角膜上皮缺损率高的主要影响因素,其对角膜上皮缺损率的影响量约为38%,线性回归方程为Y=33.153X-43.052(F=20.58,P<0.001);RORγ mRNA相对表达量对小鼠角膜上皮缺损率的影响量约为29%,线性回归方程为Y=2.764X-1.364(F=13.11,P<0.001)(图3)。
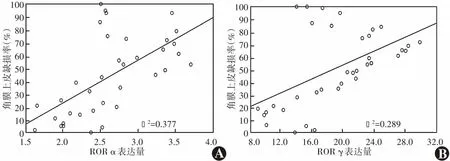
图3 RORα和RORγ mRNA相对表达量与角膜上皮缺损率的关联分析(Pearson线性相关分析,一元线性回归分析,n=36) A:RORα mRNA表达量与角膜上皮缺损率呈中度正相关(r=0.614,P<0.01),其对角膜上皮缺损率的影响约为38%(R2=0.377) B:RORγ mRNA表达量与角膜上皮缺损率呈中度正相关(r=0.537,P<0.01),其对角膜上皮缺损率的影响约为29%(R2=0.289) ROR:视黄酸相关孤儿受体Figure 3 Association analysis of relative expression of RORα,RORγ mRNA and corneal epithelial defect rate(Pearson linear correlation analysis,unary linear regression analysis,n=36) A:RORα mRNA expression and corneal epithelial defect rate was positively correlated (r=0.614,P<0.01),and the contribution of RORα mRNA expression to corneal epithelial defect rate was 38% (R2=0.377) B:RORγ mRNA expression was positively correlated with corneal epithelial defect rate (r=0.537,P<0.01),and the contribution of RORγ mRNA expression to corneal epithelial defect rate was 29% (R2=0.289) ROR:retinoic acid-related orphan receptor
2.4 SR1078组与PBS对照组小鼠角膜上皮分裂细胞数量比较
DAPI染色后荧光显微镜下可见角膜上皮基底细胞的细胞质呈亮蓝色,细胞核呈白色。未分裂的细胞呈圆或椭圆性,分裂细胞呈哑铃状(图4)。造模后不同时间点SR1078组与PBS对照组小鼠角膜上皮分裂细胞数量总体比较差异有统计学意义(F分组=160.55,P<0.001;F时间=83.57,P<0.001),其中造模后24、30、36 h SR1078组分裂细胞数目显著少于PBS对照组,差异均有统计学意义(均P<0.05)(表4)。
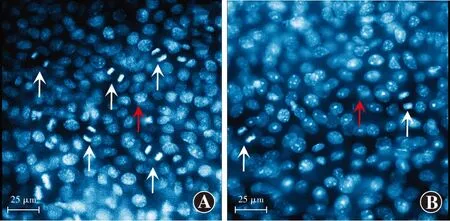
图4 造模后36 h PBS对照组与SR1078组小鼠角膜上皮基底细胞分裂细胞数比较(DAPI ×40,标尺=25 μm) 完整角膜上皮基底细胞呈圆或椭圆形(红箭头),分裂的细胞呈哑铃状(白箭头) SR1078组角膜上皮分裂细胞数明显少于PBS对照组 A:PBS对照组 B:SR1078组Figure 4 Comparison of the number of mouse corneal epithelial mitotic cells between the PBS control group and SR1078 group at 36 hours after corneal trauma(DAPI ×40,bar=25 μm) The normal cells (red arrow) were round or oval,and the mitotic cell (white arrow) was dumbbell-like.The number of mitotic cells was less in the SR1078 group compared with the PBS control group A:PBS control group B:SR1078 group

表4 各组小鼠角膜创伤后不同时间点分裂细胞数量比较(x±s,个/角膜)Table 4 Comparison of the number of mitotic cells at various time points between the two groups (x±s,pcs/cornea)组别样本量创伤后不同时间点分裂细胞数量12 h18 h24 h30 h36 h42 h48 hPBS对照组638±733±8128±3150±26221±3180±2130±9SR1078组625±252±3 53±2a74±10a75±13a43±229±3 注:F分组=160.55,P<0.001;F时间=83.57,P<0.001.与PBS对照组比较,aP<0.001(两因素方差分析,LSD-t检验) PBS:磷酸盐缓冲液;SR1078:视黄酸受体相关孤儿受体激动剂 Note:Fgroup=160.55,P<0.001;Ftime=83.57,P<0.001.Compared with the PBS con-trol group,aP<0.001 (Two-way ANOVA,LSD-t test) PBS:phosphate buffered saline;SR1078:retinoic acid receptor-related orphan receptor agonist
3 讨论
研究表明,RORα/RORγ的缺乏会引起组织中时钟基因Cry1、Bmal1、E4bp4、Rev-Erbα和Per2的峰值表达水平显著降低[15]。时钟基因的表达受环境的调控,其中主要的环境因子为光周期。光线从视网膜直接投射传送到视交叉上核(suprachiasmatic nucleus,SCN),SCN再将节律信号传送至其他器官,发挥组织生物钟同步化的作用[16],生物钟是由4个时钟基因Clock、Bmal1、Per2和Cry组成的正负调节所调控,这一回路是“转录-翻译-逆转录”机制构成的反馈环路[17]。有研究表明,当小鼠受到连续光照或处于12 h时差反应的条件下时,通过昼夜节律控制去甲肾上腺素分泌,交感神经系统会明显改变造血干细胞向外周血的昼夜节律释放[18]。考虑到角膜上皮有丝分裂中的昼夜节律变化,推测调控时钟基因的RORα/RORγ可能在一天中的不同时间存在差异表达,并且它们的表达量可能受环境明暗周期变化的调节,进而影响动物的生理病理过程。本研究采用实时荧光定量PCR法测定正常昼夜节律下24 h内小鼠角膜中RORα/RORγ mRNA表达量的动态变化,发现与正常昼夜节律比较,在24 h持续光照或黑暗条件下小鼠角膜中RORα/RORγ mRNA表达量呈下降趋势,说明RORα/RORγ mRNA表达量会受到小鼠昼夜节律的影响。在连续24 h的黑暗或光照模拟状态下,小鼠由于生物钟节律的紊乱,角膜中RORα/RORγ mRNA的表达量在某些时间段发生异常变化。为了验证小鼠角膜中RORα/RORγ mRNA的表达量是否与生物钟紊乱有关,本研究又设立了昼夜颠倒12 h组和昼夜颠倒3周组对上述结论进行验证,发现当小鼠昼夜节律与正常小鼠完全颠倒时,小鼠角膜中RORα/RORγ mRNA表达量同样呈降低趋势,且随时间的延长该效应越明显。相关研究表明,RORα/RORγ对于机体昼夜节律的调控具有重要作用,RORα对机体节律性的调控主要是由bmal1基因通过与RORE位点结合而调控基因转录,而Bmal1基因是生物节律体系中的重要因子,其含量随着时间的变化不断呈现规律性的增长和消退,其中RORα能激活Bmal1基因,而REV-ERBα的作用则相反,与RORα竞争性地结合RORE位点,从而抑制或激活Bmal1基因的转录[19]。对斑马鱼的研究中也同样说明,斑马鱼的Per2基因可通过与RORα结合增强bmal1b基因的表达[20]。
根据相关研究,斑马鱼肠道细胞分裂具有节律性[21],角膜缘的干细胞也同样具有节律性,且对创伤十分敏感,角膜上皮细胞受到损伤时,基底细胞会迅速进行分裂以补足损伤区域,以完成再分化过程。研究表明,小鼠角膜创伤后12 h和18 h角膜再上皮化速度加快,角膜上皮分裂细胞的正常节律受到睡眠颠倒的影响而发生改变[22]。本研究中通过SR1078的作用对小鼠角膜创伤模型进行恢复实验,在创伤修复过程中应用SR1078点眼,但与PBS对照组比较总体恢复时间无明显变化,而给药后的小鼠角膜上皮分裂细胞数明显少于PBS对照组,这也许意味着RORα/RORγ的增多具有抑制创伤修复的作用。根据相关研究,时钟基因在细胞分化生长方面具有重要作用,如Per基因具有抑制细胞生长和抑制肿瘤的功能,Per2基因的缺失会引起小鼠异常的细胞凋亡和癌症的发生,也会导致细胞分裂的错误发生,使正常的细胞分裂过程受到干扰[23-24]。因此根据本研究结果我们推测,SR1078点眼后,小鼠角膜中RORα/RORγ的表达量增多,阻碍了小鼠角膜上皮分裂细胞的分化,可能是由于大量外源性RORα/RORγ的侵入,使RORα/RORγ调控的基因表达发生改变,如RORγ通过RORE对BMAL1基因的表达过剩,同时RORα和Per2基因的大量结合,引起Per2基因减少,使时钟基因无法正常表达。
角膜创伤修复的目的是促进角膜上皮修复过程,并使阻碍角膜创伤的因素降到最低。有效阻断影响角膜创伤修复过程的不良因素可最大程度地促进角膜创伤的修复过程,并减轻其所造成的不良反应发生风险。本研究全昼组小鼠的持续光照可产生焦躁情绪,引起应激反应,对实验结果可能造成一定误差。但本研究仍然提示,正常昼夜节律的扰乱加速了角膜创伤修复的过程,其原因可能是机体对外界昼夜周期的变化发生反应,导致RORα/RORγ的表达量下降,促进了角膜上皮细胞的分裂过程。角膜作为视觉系统重要的屈光介质之一,与外界直接接触发生损伤的风险极大,因此了解与角膜创伤修复相关调节因子的昼夜节律变化对角膜创伤修复的防治具有重要意义。本研究针对SR1078是否对角膜创伤修复产生影响这一问题,通过昼夜节律的改变对角膜中RORα/RORγ的表达量进行分析,分别从组织和细胞水平研究RORα/RORγ激动剂SR1078对角膜上皮细胞分化的影响,阐释SR1078在角膜创伤修复中的作用机制,为角膜创伤修复的临床防治提供新的理论基础。
综上所述,RORα/RORγ激动剂SR1078对角膜创伤修复的过程能够产生调节作用。光线不规律照射破坏了小鼠正常昼夜节律,激活REV-ERBα与RORα竞争性结合RORE位点的活性,从而抑制或激活Bmal1基因的转录,进而使小鼠角膜中RORα和RORγ mRNA的表达量下降,而SR1078通过促进角膜上皮RORα和RORγ的表达,使小鼠角膜上皮分裂细胞数目下降,抑制角膜创伤后修复。SR1078对时钟基因作用的机制仍需进一步研究。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明徐鹏洋:实施研究方案、采集数据、制作图表、撰写及修改论文;李志杰:指导研究方案、修改论文;薛芸霞:设计与指导研究方案、审核研究数据、修改论文

