“痛风关节康”对高尿酸血症和痛风性关节炎模型动物干预作用的机制研究
何婧琳 杨丽萍 朱潇旭 段小花
(云南中医药大学民族医药学院,云南省傣医药与彝医药重点实验室,云南昆明 650500)
痛风是嘌呤代谢紊乱导致血中尿酸升高引起的一组临床症候群,是一种常见的关节炎疾病,主要临床表现为关节剧痛、红肿发热[1]。据统计,痛风的患病率约2%,在40岁以上伴有代谢综合征的男性中尤其常见[2]。痛风发作时疼痛剧烈,严重影响患者的生活质量。近年来,痛风患病人数正逐年增加,不仅造成医疗成本增加,也加剧了社会成本消耗[3]。临床将持续高水平的尿酸状态定义为高尿酸血症,目前认为高尿酸血症是痛风发生的基础[4]。高水平的尿酸导致不溶性尿酸盐结晶在关节处沉积,形成痛风石,当痛风石晶体脱落,诱导炎症级联反应,从而导致剧烈的疼痛[5]。
目前痛风的治疗药物有针对痛风发作期的药物和降尿酸药物。前者主要为抗炎镇痛药,如秋水仙碱、非甾体抗炎药和激素类药物,这类药物消炎止痛快,但没有降尿酸的作用,且大多数药物不良反应明显;后者如别嘌呤醇、苯溴马隆等药物,这类药物可以通过抑制尿酸产生或促进尿酸排泄而实现降尿酸的作用,但对急性发作的关节炎不仅无益,还会加重症状或延长病程,亦伴随不同程度的不良反应[6-7]。尽快终止急性关节炎发作、降低血尿酸水平,是目前国内外临床治疗急性痛风性关节炎的基本策略。因此,研发同时能抗炎镇痛又能改善血尿酸代谢的药物,是目前痛风药物研究的重要方向之一。
痛风关节康是云南少数民族地区民族民间医生治疗痛风性关节炎的常用经验方,长期临床实践表明该方兼具安全性和有效性。本实验建立高尿酸血症和痛风性关节炎动物模型,研究痛风关节康治疗痛风的作用机制,为痛风关节康的临床应用以及后续进一步开发研究提供实验依据。
1 实验材料
1.1 实验动物 SPF级Wistar大鼠,体质量(200±20)g,雌雄各半。SPF级昆明种小鼠,体质量(18±22)g,雌雄各半。大小鼠均购自成都达硕实验动物有限公司,合格证号:SCXK(川)2013-24。动物饲养和实验均符合《医学实验动物管理实施细则》要求和云南中医药大学动物伦理委员会的相关规定。
1.2 主要试剂和药物 痛风关节康药物组成:羌活10 g、独活10 g、威灵仙10 g、鸡血藤30 g、钩藤15 g、络石藤15 g、海风藤15 g,上述药物分别加相当于药材量7倍、5倍和3倍量的冷水,第一次浸泡30 min后依次煮沸45 min、35 min和25 min,合并3次滤液,浓缩备用,由云南省傣医药与彝医药重点实验室制备。酵母(英国OXOID公司,批号1173143);苯溴马隆(宜昌长江药业有限公司,批号:1108003);秋水仙碱片(昆明制药集团股份有限公司,批号:11BF);尿酸钠(Sigma,批号:BCBF1330V);尿酸(UA)测试盒(货号:C012-2),黄嘌呤氧化酶(XOD)测试盒(货号:A002-1),肌酐(Cr)测试盒(货号:C011-2),尿素氮(BUN)测试盒(货号:C013-2),均购自南京建成生物工程研究所;大鼠骨保护素(OPG)Elisa试剂盒(货号:CKE30510R),大鼠白介素-6(IL-6)Elisa试剂盒(货号:CK-E30646R),大鼠肿瘤坏死因子-α(TNF-α)Elisa试剂盒(货号:CK-E30635R),大鼠白介素-1β(IL-1β)Elisa试剂盒(货号:CK-E30419R),均购自苏州卡尔文生物科技有限公司;小鼠瘦素(LEP)Elisa试剂盒(伊莱瑞特生物科技有限公司,货号:CK-E20015M)。
1.3 主要仪器 全波长扫描式多功能酶标仪(VaricsKar);超 纯 水 机Smart 2 Pure UV/VF(美 国Thermofisher);台式高速冷冻离心机(美国赛默飞世尔Primo R);混合器(江苏省海门市实验仪器有限公司)。
2 实验方法
2.1 痛风性关节炎大鼠模型制备及给药方法 按照随机数字表法将48只Wistar大鼠分为正常对照组、模型组、阳性对照组和痛风关节康低、中、高剂量组,每组8只,雌雄各4只。正常对照组灌胃给予生理盐水,其余各组大鼠分别灌胃给予秋水仙碱(28 mg/kg)、痛风关节康(生药量分别为9.9、29.7、49.5 g/kg),连续灌胃4 d后,除正常对照组外的其余各组大鼠在右侧踝关节腔注射尿酸钠晶体(5 mg/只),正常对照组则注射无菌生理盐水,5 h后取血检测相关指标。
2.2 高尿酸血症小鼠模型制备及给药方法 按照随机数字表法将48只昆明种小鼠分为正常对照组、模型组、阳性对照组和痛风关节康低、中、高剂量组,每组8只,雌雄各半。正常对照组予等量生理盐水灌胃,其余各组小鼠每日灌胃给予酵母(20 g/kg),于灌胃的第4日开始,各给药组同时分别灌胃给予苯溴马隆(20 mg/kg)及痛风关节康(生药量分别为14.3、42.9、71.5 g/kg),各组继续灌胃4 d后取血检测相关指标。
2.3 生化及免疫检测 用10%水合氯醛腹腔注射麻醉各组大鼠和小鼠,腹主动脉取血后1000×g离心15 min,取上清液,-20 ℃分装冷藏,分别按相应的试剂盒说明书操作,使用酶标仪测定各组动物血清中UA、XOD、Cr、BUN、LEP、OPG、IL-6、TNF-α和IL-1β水平。
2.4 统计学方法 实验数据以(x-±s)表示,采用SPSS 17.0软件进行单因素方差分析,两两比较采用LSD检验,P<0.05表示差异有统计学意义。
3 实验结果
3.1 痛风关节康对急性痛风性关节炎大鼠的影响
3.1.1 各组大鼠血清UA和XOD水平比较 与正常对照组比较,模型组大鼠血清UA和XOD水平均显著升高(P<0.05,P<0.01);阳性对照组和痛风关节康中、高剂量组大鼠血清UA水平明显低于模型组(P<0.05,P<0.01),各给药组大鼠血清XOD水平均明显低于模型组(P<0.01);痛风关节康中、高剂量组大鼠血清XOD水平明显低于阳性对照组(P<0.05)。上述指标痛风关节康各剂量组组间比较,差异均无统计学意义(P>0.05)。见表1。
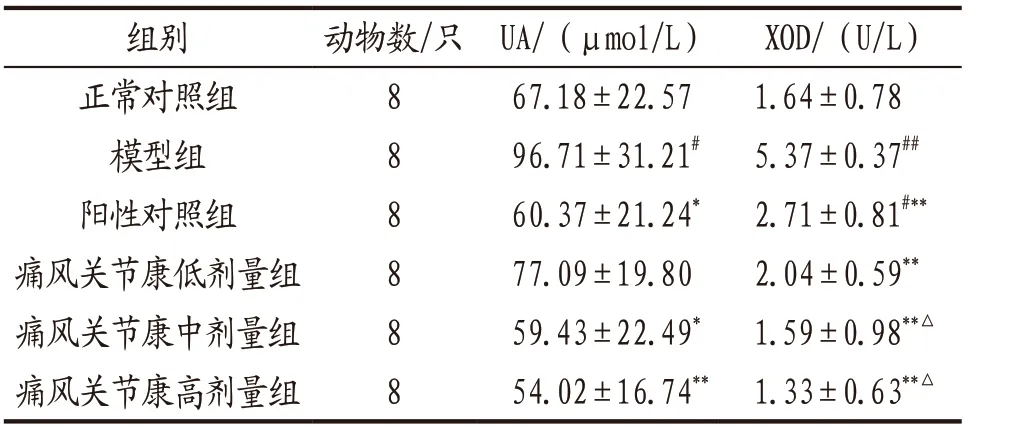
表1 各组大鼠血清UA和XOD水平比较(x-±s)
3.1.2 各组大鼠肾功能指标水平比较 与正常对照组比较,模型组大鼠血清Cr和BUN水平显著升高(P<0.01);各给药组大鼠Cr和BUN水平均明显低于模型组(P<0.05,P<0.01);痛风关节康高剂量组大鼠BUN水平明显低于阳性对照组(P<0.01)。上述指标痛风关节康各剂量组组间比较,差异无统计学意义(P>0.05)。见表2。
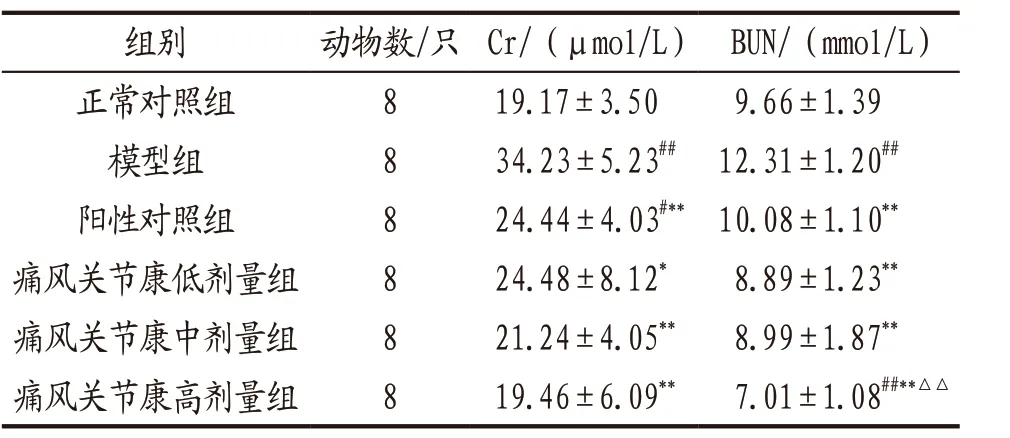
表2 各组大鼠血清Cr和BUN水平比较(x-±s)
3.1.3 各组大鼠血清LEP、OPG、IL-6、TNF-α和IL-1β水平比较 与正常对照组比较,模型组大鼠LEP、IL-6、TNF-α和IL-1β水平均显著升高,OPG水平显著下降,差异均具有统计学意义(P<0.01);各给药组大鼠血清LEP、IL-6、TNF-α、IL-1β水平均明显低于 模 型 组(P<0.05,P<0.01),OPG水平明显高于模型组(P<0.05,P<0.01);痛风 关节康中、高剂量组大鼠血清LEP和TNF-α水平明显低于阳性对照组(P<0.05,P<0.01);痛风关节康高剂量组大鼠血清TNF-α水平明显低于低、中剂量组(P<0.01)。见表3。
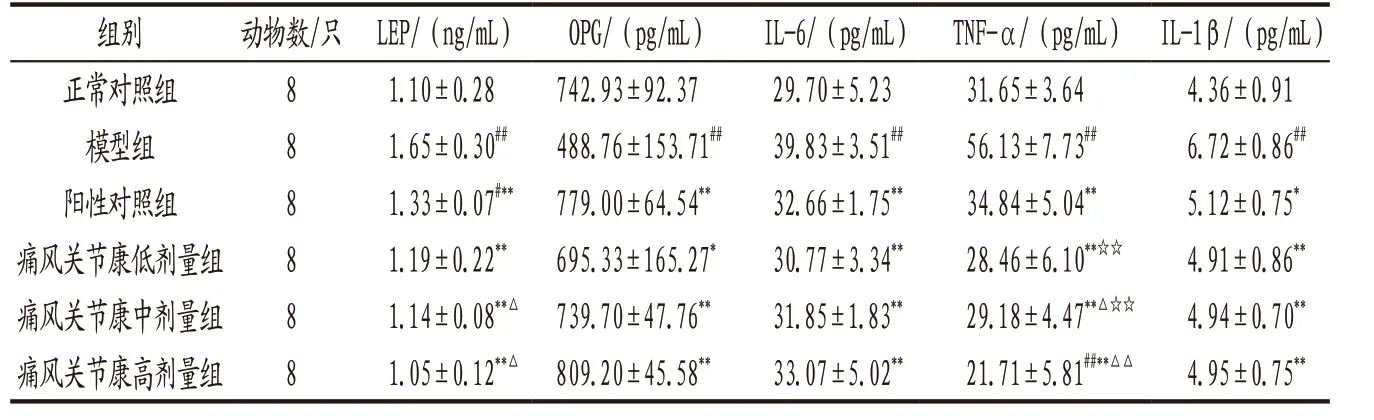
表3 各组大鼠血清LEP、OPG、IL-6、TNF-α和IL-1β水平比较(x-±s)
3.2 痛风关节康对高尿酸血症小鼠的影响
3.2.1 各组小鼠血清UA和XOD水平比较 与正常对照组比较,模型组小鼠血清UA和XOD水平均显著升高(P<0.01);各给药组小鼠血清UA和XOD水平均明显低于模 型 组(P<0.05,P<0.01);痛风关节康各剂量组小鼠上述指标均明显低于阳性对照组(P<0.01);上述指标痛风关节康各剂量组组间比较,差异无统计学意义(P>0.05)。见表4。
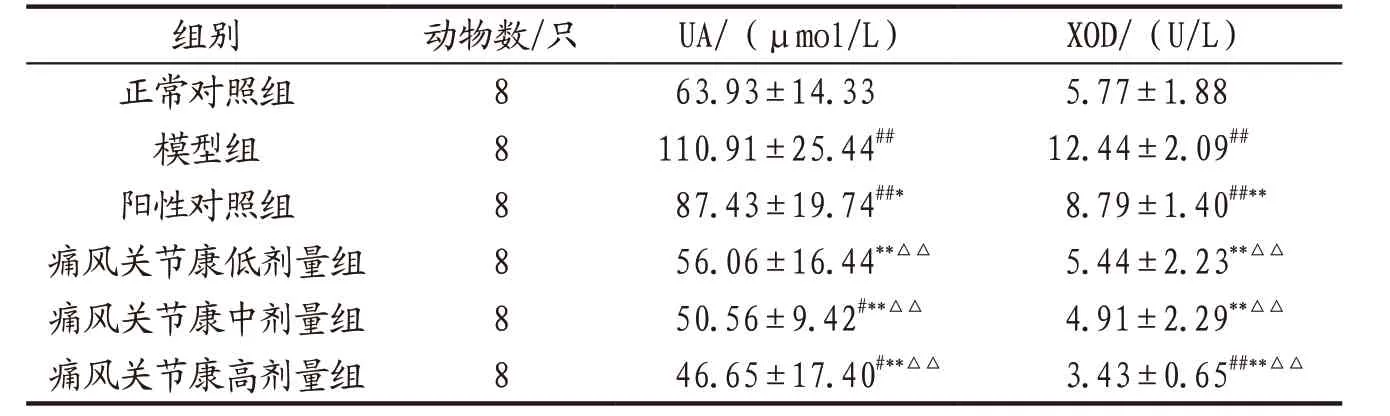
表4 各组小鼠血清UA和XOD水平比较(x-±s)
3.2.2 各组小鼠肾功能指标水平比较 与正常对照组比较,模型组小鼠血清Cr和BUN水平均显著升高(P<0.01);各给药组小鼠血清Cr、BUN水平均显著低于模 型 组(P<0.05,P<0.01);痛风关节康高剂量组小鼠血清BUN水平显著低于阳性对照组(P<0.01);痛风关节康高剂量组小鼠Cr和BUN水平显著低于低、中剂量组(P<0.05)。见表5。
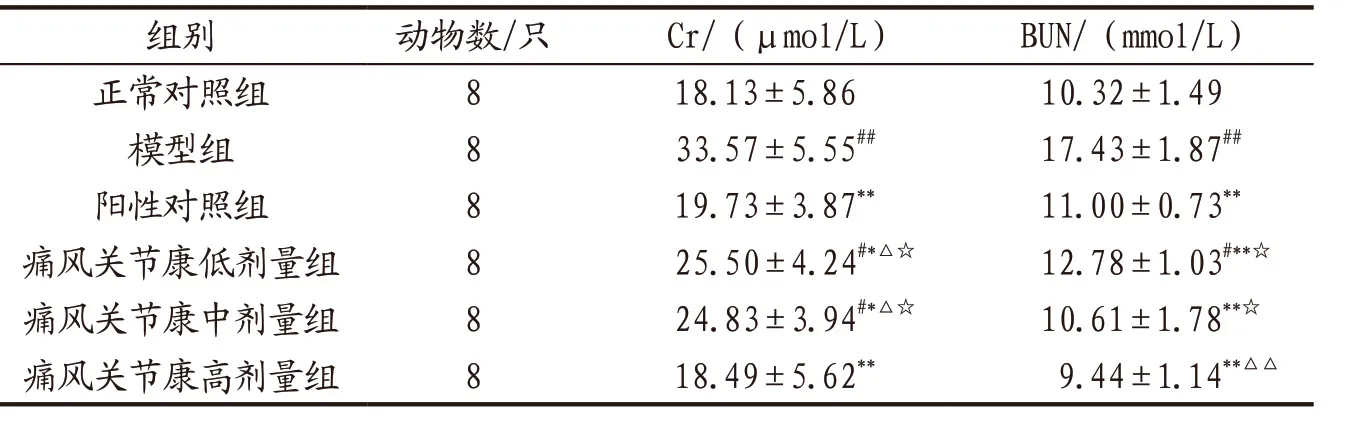
表5 各组小鼠血清Cr、BUN水平比较(x-±s)
3.2.3 各组小鼠血清LEP、OPG、IL-6、TNF-α和IL-1β水平比较 与正常对照组比较,模型组小鼠血清OPG含量显著降低(P<0.01),LEP、IL-6、TNF-α、IL-1β水平均显著升高(P<0.05,P<0.01);各给药组小鼠上述指标均较模型组显著改善(P<0.05,P<0.01);痛风关节康低、高剂量组小鼠血清IL-6水平,痛风关节康各剂量组小鼠血清IL-1β水平均明显低于阳性对照组(P<0.05,P<0.01);痛风关节康高剂量组小鼠血清IL-6水平显著低于低、中剂量组(P<0.05)。见表6。

表6 各组小鼠血清LEP、OPG、IL-6、TNF-α和IL-1β水平比较(x-±s)
4 讨论
高尿酸血症是痛风的重要临床特征,长期高尿酸血症可引发痛风性关节炎、指趾关节畸形或痛风性肾病等。降低UA在整个痛风治疗过程中,对防止痛风发作和防止恶化方面具有重要意义。本研究我们采用酵母灌胃复制了高尿酸血症小鼠模型,探讨痛风关节康对高尿酸血症的影响;采用在踝关节处注射尿酸钠晶体建立急性痛风性关节炎大鼠模型,研究痛风关节康对急性痛风性关节炎的作用。由于在实验过程中发现于小鼠右侧踝关节腔注射尿酸钠晶体存在注射失败率高、模型成功率低的问题,因此本研究中急性痛风性关节炎模型采用大鼠作为研究对象。研究结果表明,高尿酸血症模型小鼠血清UA和XOD水平显著高于正常对照组,表明高尿酸血症模型建立成功;急性痛风性关节炎模型大鼠踝关节出现显著红肿,且血清炎症因子水平明显高于正常对照组,说明模型建立成功。
高尿酸血症本身无症状,但其附带有严重的肾脏损伤[8]。血清BUN、Cr是衡量肾功能的主要指标,可直接反映肾小球的滤过功能和肾小管的重吸收功能。本研究结果显示,痛风关节康可呈剂量依赖地降低高尿酸血症和痛风性关节炎模型动物血清BUN和Cr水平,说明其具有一定程度的肾脏保护作用。UA水平还与XOD活性密切相关,XOD在UA生成过程中发挥着重要的作用,能够催化次黄嘌呤核苷酸发生连续氧化反应,使次黄嘌呤继续氧化为黄嘌呤,最终生成尿酸。本实验结果表明,痛风关节康的降尿酸作用与XOD活性调节有关。且在两个动物模型中,痛风关节康对XOD的抑制作用显著优于阳性对照药苯溴马隆或秋水仙碱。
在体内,过量的尿酸主要以钠盐的形式沉积在关节腔、软组织、软骨和肾脏等处,形成尿酸盐结晶,尿酸盐结晶通过激活吞噬细胞、炎性体、TOLL样受体等途径参与痛风性炎症反应,与急性痛风性关节炎的发生发展密切相关[9]。研究发现,尿酸盐结晶能够刺激血液和关节液中单核细胞释放大量IL-1β,IL-1β被认为是急性痛风性关节炎的重要炎性介质之一,在炎症的发生和消退中起着非常关键的作用,曾有研究者提出以IL-1β抑制为目的,开发专一的IL-1β抑制剂进行痛风治疗[10-11]。IL-1β大量释放后激活NF-κB信号通路,引起大量TNF-α、IL-6、IL-1等促炎因子的表达,产生级联放大效应[12]。其中IL-6是参与大多数骨关节炎炎症反应的前炎症因子,通过刺激B细胞参与炎症反应,研究表明IL-6的含量与痛风性关节炎的病情密切相关[13]。而TNF-α水平在痛风性关节炎发病早期会出现明显升高,刺激下丘脑的体温调节中枢,激发巨噬细胞释放IL-1β和IL-1,导致炎症范围进一步扩大[14]。本实验结果显示,痛风关节康在实现抗痛风作用的过程中,IL-1β、TNF-α和IL-6介导了其调节炎症反应的过程,这可能是痛风关节康的抗痛风关节炎作用机制之一。本实验中,痛风关节康对炎症因子的作用没有呈现出明显的剂量依赖,特别是对急性痛风性关节炎大鼠模型,这可能与中药复方多成分作用的结果有关。
高尿酸导致的长期微炎症环境可促进破骨细胞分化和成熟,导致骨形成和吸收失衡,引发骨质疏松。骨质疏松是导致痛风患者关节畸形和致残的主要因素之一[15]。研究表明,LEP可作用于成骨细胞而抑制骨形成,加重炎症,从而导致急性痛风性关节炎的发病或加重[16]。OPG是对抗骨质疏松的重要因子,可抑制破骨细胞活性,促进破骨细胞凋亡和病态骨吸收,增加骨密度。本研究结果显示,高尿酸血症模型和痛风性关节炎模型动物血清中LEP水平升高,OPG水平降低,痛风关节康能够调节两者水平,提示痛风关节康也通过干预骨代谢的过程而发挥抗痛风的作用。
综上,本研究通过建立高尿酸血症小鼠模型和痛风性关节炎大鼠模型,评价了痛风关节康的抗痛风作用。结果显示,痛风关节康可通过保护肾功能、调节XOD的活性而改善高尿酸血症,同时可以通过抑制IL-1β等炎症因子的生成、改善骨形成来发挥抗痛风的作用。研究结果表明,痛风关节康对两种动物模型的作用与阳性对照药苯溴马隆和秋水仙碱相比,具有类似或更强的效果。本实验在动物水平上研究了痛风关节康作为抗痛风性关节炎和降尿酸药物的可行性,并初步探讨了其作用机制,为痛风关节康在少数民族地区的使用提供一定的实验依据,同时也为新型抗痛风药物的开发提供思路。由于本研究只探讨了痛风关节康水提物对痛风的作用,而复方成分复杂,作用具有多成分多靶点的特点,对痛风关节康作用的有效组分和内在机制研究将是我们下一步的方向。

