羧甲基壳聚糖-丙硫菌唑水凝胶微球的制备及其在小麦植株中的时空分布研究
许春丽,曹立冬,李远播,黄启良
(中国农业科学院植物保护研究所,北京 100193)
水凝胶是具有三维网络结构的聚合物结构体系,由含有亲水基团的大分子通过共价键、氢键、范德华力等作用力形成。水凝胶具有保水性好、敏感释放、合成工艺简单等优点,被广泛用于农业领域来改善植物的水分可用性[1-3],以及通过负载农药活性成分以达到缓释、降低农药残留等效果[4]。水凝胶的基底材料具有多样性,其中具有生物相容性、生物可降解性等特点的多糖类天然高分子羧甲基壳聚糖(CMCS)受到了人们的广泛关注[5-7]。羧甲基壳聚糖具有良好的抑菌性能,与金属离子螯合后形成的复合体系也表现出良好的抑菌效果。研究报道O-羧甲基壳聚糖铜配合物对辣椒疫霉菌、玉米赤霉病和苹果炭疽病的抑菌效果好于壳聚糖的抑菌效果[8];木质素和铜复合物对番茄立枯病病原菌的抑菌效果好于商品化的氢氧化铜抑菌效果[9]。
丙硫菌唑是由拜耳公司研发生产的一种新型三唑硫酮类杀菌剂,主要用于由子囊菌、担子菌以及半知菌引起的病害。作用模式为通过抑制目标菌中甾醇14α-去甲基化酶来干扰麦角甾醇的合成[10]。丙硫菌唑于2019年在我国登记,但已经登记的剂型十分有限。目前对丙硫菌唑缓释制剂的研究较少[11-12],考虑到水凝胶农药缓释制剂的良好性能和应用前景,我们前期以CMCS为基底材料与Mn2+螯合形成水凝胶,采用挤出-外源凝胶法制备了丙硫菌唑水凝胶微球,并通过正交试验进行了制备条件的优化[13]。研究结果表明,所制备的丙硫菌唑水凝胶微球具有良好的pH敏感溶胀和释放性能,与丙硫菌唑原药相比,前者可以增强对小麦全蚀病的杀菌能力,且对小麦的生长具有营养功能[13]。然而,将CMCS-丙硫菌唑水凝胶微球施用于小麦种子后,有关丙硫菌唑及其代谢产物脱硫丙硫菌唑在土壤、小麦根部和地上部中不同生长周期内的剂量分布尚未见报道。因此,深入研究其剂量传输及分布行为有助于加深对提升丙硫菌唑水凝胶微球性能的理解并拓展其应用范围。
1 材料与方法
1.1 材料
供试作物:小麦‘农大211’。
供试药剂:丙硫菌唑原药(纯度99%),四川华英化工有限公司;羧甲基壳聚糖(羧化度86.2%,分子量≥10万g/mol),北京华威锐科化工有限公司;MnSO4·H2O、吐温80(Tween-80)和无水硫酸镁均为分析纯,国药集团化学试剂有限公司;甲醇(色谱纯),美国赛默飞世尔科技有限公司;乙腈(色谱纯),德国默克集团有限公司;试验用水为超纯水。
供试仪器:DF-101Z型恒温加热电磁搅拌器,上海司乐仪器有限公司;TG20-WS离心机,长沙湘智离心机仪器有限公司;Agilent 1200型高效液相色谱仪、超高效液相色谱-串联四极杆液质联用仪(UPLC-MS/MS),美国赛默飞世尔科技有限公司;火焰原子吸收分光光度计,德国耶拿分析仪器股份有限公司。
1.2 高效液相色谱分析
流动相为甲醇-0.1%甲酸水(80∶20,V/V),流速为1.0 mL/min;Agilent TC-C18不锈钢色谱柱(4.6 mm×250 mm,5μm);检测波长为260 nm;进样量为5μL;柱温为25℃;进样体积为5μL;流速为1 mL/min。
1.3 CMCS-丙硫菌唑水凝胶微球的制备
本试验采用乳化交联的方法制备CMCS-丙硫菌唑水凝胶微球。CMCS的官能团可以通过配位键螯合金属离子形成具有不同大小和形态的复合物。CMCS和金属离子之间的络合可用于制备一系列超分子水凝胶。CMCS具有亲水性,而丙硫菌唑是疏水性农药,故采用乳化法将丙硫菌唑分散在CMCS溶液中,然后将乳液用注射器逐滴注入金属离子水溶液。溶液中CMCS和Mn2+接触后立即发生离子交联反应,随后通过CMCS和金属离子间的配位和离子交换形成水凝胶。具体方法如下:先将丙硫菌唑溶于二氯甲烷中,加入乳化剂混合均匀作为油相,将一定质量浓度的CMCS水溶液作为水相;将二者混合,在设定的剪切速率(10 000 r/min)下高速剪切5 min,形成O/W乳液;将乳液置于带有6#针头(内径为0.6 mm)的注射器中,逐滴滴加到Mn2+溶液,反应4 h后固化成微球颗粒;用纱布过滤凝胶颗粒,同时用大量去离子水洗涤凝胶表面未参与反应的Mn2+,于60℃烘箱中干燥,过夜后收集载药凝胶微球颗粒。
1.4 CMCS-丙硫菌唑水凝胶微球载药率、包封率的测定
参照王召等[14]方法进行凝胶微球的处理:称取10 mg载药样品,加入5 mL解离液,待溶解完全后,加入至10 mL容量瓶中并用甲醇定容,过0.22μm有机滤膜,通过高效液相色谱检测丙硫菌唑的含量。按式(1)、(2)分别计算载药样品的载药率和包封率。

1.5 凝胶颗粒中Mn2+装载量测定
采用火焰原子吸收分光光度计对凝胶微球颗粒中的Mn2+含量进行研究,检测波长为279 nm。用干凝胶颗粒中Mn2+的质量分数表示其装载量,按式(3)计算。
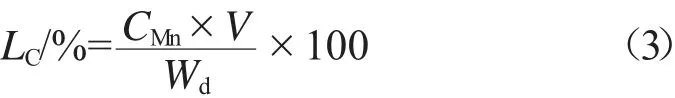
式中:CMn为样品中Mn2+的质量浓度,mg/L;V为样品的体积,L;Wd为凝胶颗粒的质量,mg。
1.6 单因素试验设计
单因素试验设计参数如表1所示。以乳液中CMCS质量分数为4%,乳化剂Tween-80质量分数为2%;油水比为1∶10(V/V);交联剂浓度为0.2 mol/L作为基础条件。试验均重复3次。
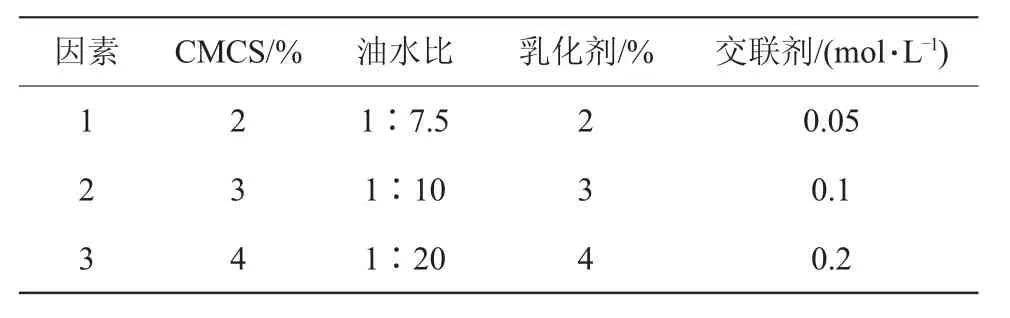
表1 单因素试验设计参数
1.7 CMCS-丙硫菌唑水凝胶微粒在小麦植株中的剂量分布规律
1.7.1 样品制备
选择‘农大211’作为供试小麦,将筛选出的小麦种子用次氯酸钠溶液浸泡灭菌,将300 g营养土放入8 cm×8 cm(直径×高)的种植盆中,分别用丙硫菌唑原药和凝胶颗粒处理土壤,其中丙硫菌唑的有效成分为15 mg/盆。在距土壤表面3 cm深处播种15颗种子,然后用自来水浇灌,以保证整个生育期的湿度,将未处理土壤作为空白对照。所有植株在(25±2)℃的光照培养箱条件下生长,光周期为14 h,暗期为10 h,在施药后小麦完全发芽的当天开始采集样品,贴好标签,保存至-20℃冰箱备用。
1.7.2 样品提取与净化
参照石凯威等[15]的样品前处理方法并进行方法改进。准确称取5 g土壤样品于50 mL离心管中,加入3 mL超纯水和10 mL乙腈溶液提取,振荡10 min,静置30min,加入2g氯化钠和2g无水硫酸镁,振荡5min,于4 000 r/min离心5 min,待净化;准确称取2 g小麦根部和地上部粉碎样品于50 mL离心管中,加入1 mL超纯水和5 mL乙腈溶液提取,振荡10 min,静置30 min,随后加入1 g氯化钠和1 g无水硫酸镁,振荡5 min,于4 000 r/min离心5 min,待净化。
取上述小麦根部和土壤的上清液各1.5 mL分别放入装有150 mg无水硫酸镁+50 mg C18的2 mL离心管中,涡旋30 s,于5 000 r/min离心5 min,取上清液过0.22μm的有机系滤膜,待上机检测;取上述小麦地上部的上清液1.5 mL放入装有150 mg无水硫酸镁+50 mg C18+25 mg GCB的2 mL离心管中,涡旋30 s,于5 000 r/min离心5 min,取上清液过0.22μm的有机系滤膜,待上机检测。
1.7.3 UPLC-MS/MS分析
液相色谱条件:色谱柱为Hypersil Gold C18(50 mm×2.1 mm,1.9μm);柱温为40℃;流动相为乙腈-0.1%甲酸水(80∶20,V/V);流速为0.3 mL/min。
质谱条件:电喷雾离子源;多反应监测正离子扫描;毛细管电压为3 500 V;干燥气温度为300℃;干燥气流速为6 L/min;喷雾器压力172.38 kPa;鞘流气温度为250℃;鞘流气流速为5 L/min,采集参数见表2。由于丙硫菌唑在土壤和植株内极易转化,本试验仅研究脱硫丙硫菌唑在土壤和小麦植株中的分布情况。

表2 脱硫丙硫菌唑采集参数
1.8 数据处理
使用SPSS 26对数据进行ANOVA分析,所有数据均表示为平均值±标准差(mean±SD);通过Duncan新复极差法对试验获得的数据结果进行显著性差异分析。
2 结果与分析
前期研究以载药率和包封率为考核指标,采用L9(34)正交试验对水凝胶微球进行了参数的优化,筛选出适宜的条件[13]。本文将采用单因素试验考察各个因素对水凝胶成球性、载药率和包封率的影响,筛选出较优的条件,并与正交试验结果进行对比。
2.1 不同条件对CMCS-丙硫菌唑水凝胶微球成型的影响
2.1.1 不同种类乳化剂对丙硫菌唑/CMCSO/W乳液稳定性的影响
稳定的丙硫菌唑/CMCSO/W乳液是保证复合凝胶微球具有较高载药率和包封率的前提,若乳液体系不稳定则会发生分层析油,影响到凝胶微球中药物负载的均匀度及在应用中的使用效果[16]。本试验重点考察了质量分数为2%的聚乙烯醇(PVA)、十二烷基磺酸钠(SDS)、烷基酚聚氧乙烯醚(OP-10)和聚氧乙烯山梨糖醇单油酸酯(Tween-80)4种不同的乳化剂对混合乳液乳化稳定性的影响(表3)。由表3可知,在4种乳化剂中,Tween-80的乳化稳定效果相对较好,可作为制备凝胶颗粒的乳化剂;PVA具有较强的亲水性,主要是起到增加黏度的作用,不宜作为该体系的乳化剂;SDS的阴离子磺酸根参与Mn2+的配位,影响乳液的稳定性。可稳定O/W乳液的乳化剂亲水亲油平衡值(HLB)一般在8~18,OP-10和Tween-80均满足该要求,综合实际乳液稳定效果,本试验选择质量分数为2%的Tween-80作为制备凝胶微球的乳化剂。

表3 不同种类乳化剂对丙硫菌唑/CMCSO/W乳液稳定性的影响
2.1.2 CMCS用量对凝胶微球成型效果的影响
在其他试验条件固定不变的情况下,本文考察了不同质量分数的CMCS对凝胶微球成型效果的影响。结果表明,当CMCS质量分数为2%时,凝胶微球拖尾,不够均匀与光滑;当CMCS质量分数增加到3%时,凝胶微球部分拖尾,较为均匀;当质量分数为4%时,很容易成型,易于制备,且成型效果好,颗粒均匀(图1)。因此,本试验选择质量分数为4%的CMCS进行载药水凝胶微球的制备。
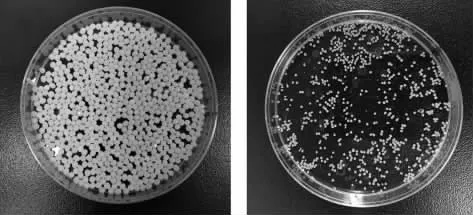
图1 CMCS-丙硫菌唑水凝胶微球干燥前(a)和干燥后(b)
2.1.3 交联剂浓度对凝胶微球成型效果的影响
在其他试验条件固定不变的情况下,本文考察了不同Mn2+浓度对微球成型效果的影响。结果表明,随着Mn2+浓度从0.05 mol/L增加到0.2 mol/L,凝胶微球越容易成型,表面越光滑。因此,本试验选择0.2 mol/L交联剂进行载药水凝胶微球的制备。
2.1.4 油水比对凝胶微球成型效果的影响
在其他条件固定不变的情况下,本文考察了不同油水体积比对微球成型效果的影响。研究发现,不同油水体积比对凝胶微球的成型并无明显的区别。
2.2 不同条件对CMCS-丙硫菌唑水凝胶微球载药率和包封率的影响
2.2.1 乳化剂Tween-80用量对凝胶微球载药率和包封率的影响
根据预试验,将质量分数为2%、3%和4%的乳化剂Tween-80分别制备成凝胶颗粒,测定其经过滤干燥后得到的产物的质量、载药率及包封率。由表4可知,随着Tween-80用量的增加,凝胶颗粒的载药率和包封率显著下降,包埋率也随之下降。Tween-80形成乳液后一部分附着在凝胶颗粒表面,另一部分分散溶于水相中。附着在颗粒表面的一部分乳化剂并不会随着洗涤、过滤、干燥的过程而失去,但是总投入的有效成分的质量不变,因此过滤干燥后总产物质量的增加导致载药率下降。此外,当增加表面活性剂Tween-80的用量时,部分Tween-80在水相中形成胶束,对丙硫菌唑产生增溶作用,导致原药溶于水中,从而造成包封率的下降。基于上述结论,最终确定乳化剂Tween-80的质量分数为2%。
2.2.2 CMCS用量对凝胶微球载药率和包封率的影响
CMCS具有很好的水溶性,但是当CMCS浓度到达一定程度时溶液黏度也随之增加,影响注射器的滴加,所以本研究以乳液中CMCS的质量分数4%作为上限。当CMCS的浓度过低时,制备的凝胶微球颗粒在磁力搅拌器的搅拌下很容易破碎,无法得到完整的凝胶颗粒,故本试验分别用质量分数为2%、3%和4%的CMCS制备凝胶颗粒,测定其载药率和包封率,结果见表4。结果表明,CMCS的质量分数对凝胶颗粒的载药率有显著影响,当其质量分数为2%时,载药率显著高于其他水平,这是由于CMCS的质量较少,最终形成凝胶颗粒时有效成分的比重相对增大,因此载药率显著高于3%和4%的水平;当其质量分数为2%和4%时,丙硫菌唑的包封率之间没有显著区别,但低质量浓度得到的水凝胶易碎裂,干燥后得到的颗粒黏连严重,因此最终选用质量分数为4%的CMCS作为最适宜水平。
2.2.3 油水比对凝胶微球载药率和包封率的影响
按照以上试验筛选获得的最佳条件,分别设定油水体积比为1∶7.5、1∶10和1∶15来制备凝胶微球,测定其载药率及包封率。结果表明,油水比例对凝胶微球的载药率影响不显著,但对包封率有显著影响(表4)。油相的增加或者减少都会造成最终形成的乳状液黏度变化,乳液滴加不匀使交联反应不能充分反应,从而导致包封率变化。本试验最终选用的油水体积比为1∶10,此时包封率最高。
2.2.4 交联剂浓度对凝胶微球载药率和包封率的影响
在预试验中,交联剂的浓度对凝胶微球的成型具有很大的影响。本试验选用0.05、0.1和0.2 mol/L的Mn2+作为交联剂,考察其对凝胶微球载药率和包封率的影响。结果表明,凝胶微球的载药率和包封率随着交联剂浓度的增加而增加(表4)。当溶液中存在大量交联剂时,乳液可以与金属离子迅速充分接触,形成结构致密的凝胶颗粒,将有效成分包封在蛋壳结构中,避免丙硫菌唑被CMCS以及Tween-80的增溶作用溶解和分散到水中,从而使载药率和包封率提升。根据试验结果,最终选用的交联剂浓度为0.2 mol/L。

表4 不同影响因素对CMCS-丙硫菌唑水凝胶微球载药率和包封率的影响
通过单因素试验研究了各个制备参数对凝胶微球成球性、载药率和包封率的影响,并筛选出较优的条件:乳化剂Tween-80质量分数为2%,CMCS质量分数为4%,联联剂浓度为0.2 mol/L,油水比为1∶10(V/V)。该试验结果与L9(34)正交试验筛选的结果一致。在优化条件下,所得凝胶微球的载药率和包封率分别为22.17%±0.83%和68.38%±2.56%。
2.3 剂量传输分布研究
2.3.1 方法的线性范围与定量限
配置系列脱硫丙硫菌唑的标准工作溶液,作基质标准曲线。脱硫丙硫菌唑在土壤、小麦根部以及小麦地上部基质中的线性方程、线性范围和相关系数,见表5。当土壤中添加浓度为0.025 mg/kg时,脱硫丙硫菌唑的平均回收率为88%;当小麦根部和小麦地上部中添加浓度为0.01 mg/kg时,脱硫丙硫菌唑的平均回收率分别为98%和102%,且信噪比大于10(S/N>10),因此土壤中方法定量限设定为0.025 mg/kg,小麦根部和地上部中的方法定量限设定为0.01 mg/kg。
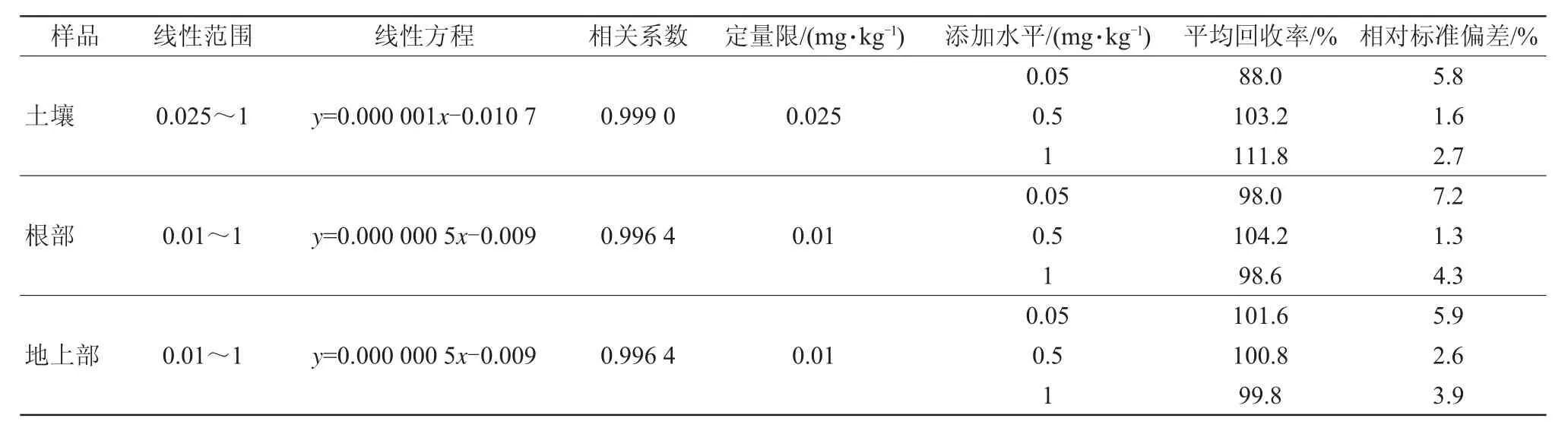
表5 样品中脱硫丙硫菌唑的线性范围、线性方程、添加回收率和精密度(n=5)
2.3.2 回收率和精密度
采用不含脱硫丙硫菌唑的土壤和小麦样品进行添加回收和精密度试验,样品添加3个浓度水平0.05、0.5、1 mg/kg,每个添加浓度平行测定5次,用UPLC-MS/MS进样测定。在土壤中,3个添加水平的平均回收率为88.0%~111.8%;在小麦根中,3个添加水平的平均回收率为98.0%~104.2%;在小麦地上部中,3个添加水平的平均回收率为99.8%~101.6%,相对标准偏差均小于7.2%,结果见表5。
2.3.3 样品中剂量测定分析
不同时间段的土壤、小麦不同部位中的脱硫丙硫菌唑的剂量分布情况如图2所示。在采样的第1 d(以小麦发芽的第1 d计),用丙硫菌唑原药处理的土壤、小麦根部和地上部中的脱硫丙硫菌唑含量高于凝胶颗粒处理的对应样品中的含量,说明凝胶颗粒具有缓释的效果,有助于降低丙硫菌唑在土壤、植株中的转化。对于原药和凝胶颗粒处理,不同部位的脱硫丙硫菌唑含量分布情况依次为土壤>根部>地上部,说明大部分丙硫菌唑存在于土壤中,内吸传导的剂量仅占投入剂量的小部分。在丙硫菌唑原药与凝胶颗粒处理后的土壤中,脱硫丙硫菌唑的剂量分布具有显著差异性,随着采样周期的延长,其含量逐渐增加,证明丙硫菌唑在土壤中脱硫转化较快,而凝胶化后可以降低丙硫菌唑的脱硫转化情况。
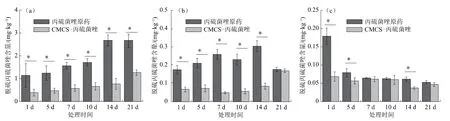
注:“*”表示在P<0.05水平上差异性显著。
在小麦根部中,凝胶颗粒处理的脱硫丙硫菌唑剂量与丙硫菌唑原药处理相比在前期差异显著,但21 d后差异不显著,说明脱硫产物在小麦的根部发生了转化。在小麦地上部分,凝胶颗粒处理的脱硫丙硫菌唑剂量与丙硫菌唑原药处理相比在前期差异显著,随后逐渐趋于平衡,说明凝胶化可以缓慢释放有效成分。因此,丙硫菌唑凝胶颗粒对于延长丙硫菌唑的持效期具有重要意义。
3 结 论
本文利用乳化交联法成功制备了负载丙硫菌唑的金属锰基羧甲基壳聚糖水凝胶,并通过单因素试验筛选出合适的制备参数:乳化剂Tween-80质量分数为2%;CMCS质量分数为4%;交联剂浓度为0.2 mol/L;油水比为1∶10(V/V)。在优化条件下,所得丙硫菌唑缓释复合水凝胶微球的载药率为22.17%±0.83%,包封率为68.38%±2.56%。盆栽试验结果表明,丙硫菌唑凝胶化有助于降低丙硫菌唑在土壤、小麦植株中的脱硫代谢转化,有望提升丙硫菌唑的应用性能。这种基于金属离子和天然多糖制备的多功能水凝胶在农业生产中显示出潜在的应用前景,可拓宽目前农药控制释放制剂的研究领域,有望在农药的可持续发展中发挥重要作用。

