红萍多糖结构特征、流变特性及抗氧化活性
姚月华 唐 宁 应熙锐 应朝阳 程永强
(1. 中国农业大学食品科学与营养工程学院植物源功能食品北京市重点实验室,北京 100083;2. 福建农林大学食品科学学院,福建 福州 350002;3. 福建省农业科学院农业生态研究所,福建 福州 350000)
红萍,又名满江红(Azolla),是一种与鱼腥藻共生的水生蕨类植物,叶片细小,漂浮于水面[1]。其繁殖迅速,产量极高,广泛分布在中国华南及西南地区的池塘、水田等地,作为一种传统绿肥,被广泛应用于畜禽养殖[2]、稻田增产[3]、生态保护[4]等领域。此外,红萍中含有丰富的生物活性物质,如多糖、氨基酸、酚类、蒽酮类、微量元素等,其提取物具有抗氧化[5]、抑菌[6]、护肝[7]等功能。
多糖是由单糖通过糖苷键连接而成的生物活性大分子,由同一种单糖组成的为均一多糖,由两个及以上单糖组成的为杂多糖[8]。Ramzani等[9]从小叶满江红中提取的阴离子多糖可以诱导巨噬细胞分泌促炎介质和细胞因子,发挥免疫调节作用。Zhao等[10]从鳞毛蕨中提取出一种水溶性多糖,该多糖能够清除DPPH自由基、羟自由基和超氧阴离子。此外,蕨类植物来源的多糖还具有理想的流变特性,如黑树蕨多糖提取物表现出剪切增稠及延伸黏度等特征,被应用于增稠剂、药物载体等加工领域[11]。
目前,有关红萍功能成分的研究主要集中在蛋白质、微量元素等方面,而有关红萍多糖的研究尚未见报道。文章拟以墨西哥满江红为原料,通过热水浸提,醇沉后得到红萍多糖,对其结构特征、流变特性进行研究,同时探究其体外抗氧化活性,以期为红萍多糖应用于功能性食品、生物医学和制药等行业提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
红萍:墨西哥满江红,福建省农业科学院农业生态研究所;
无水乙醇、丙酮、牛血清蛋白、考马斯亮蓝G-250、单糖标准品(葡萄糖、半乳糖醛酸、半乳糖、甘露糖、鼠李糖、木糖、葡萄糖醛酸、核糖、阿拉伯糖、岩藻糖):分析纯,国药集团化学试剂有限公司;
水溶性维生素E(Trolox)、3-甲基-1-苯基-2-吡唑啉-5-酮(PMP)、1,1-二苯基-2-三硝基苯肼(DPPH)、葡聚糖标准品、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS):分析纯,北京索莱宝生物技术有限公司。
1.1.2 主要仪器设备
真空干燥箱:DZF6020A型,北京科伟永兴仪器有限公司;
医用离心机:TGL-185M型,长沙平凡仪器仪表有限公司;
高效液相色谱仪:1260 infinity型,德国Agilent Technologies公司;
凝胶渗透色谱仪:HLC 8420型,日本Hitachi公司;
红外光谱仪:SPECTRUM 100型,美国PkinElmer公司;
紫外可见分光光度计:T6新世纪,北京普析通用仪器有限责任公司;
扫描电子显微镜:SU 8010型,日本 Hitachi 公司;
流变仪:SPECTRUM 100型,美国 PkinElmer 公司。
1.2 试验方法
1.2.1 红萍多糖的提取 参照江和栋等[12]的方法并修改:
红萍干粉→粉碎过40目筛→无水乙醇85 ℃回流除杂→热水浸提[料液比1∶30 (g/mL),时间2.5 h,温度92 ℃]→旋蒸浓缩→醇沉(4倍体积无水乙醇)→4 ℃冰箱静置24 h→离心取沉淀→丙酮除杂→烘干→红萍多糖
1.2.2 化学成分测定
(1)总糖含量:采用硫酸苯酚法[13]。
(2)蛋白质含量:采用考马斯亮蓝法[14]。
(3)糖醛酸含量:采用硫酸—咔唑法[15]。
(4)脂质含量:利用脂肪测定仪进行测定。
1.2.3 单糖组成 参照王丽波等[16]的方法并修改。称量15 mg样品,加入8 mL浓度为2 mol/L的三氟乙酸(TFA),以氮气封管,121 ℃水解 6 h。分别取单糖标准液和多糖水解液各100 μL,加入300 μL浓度为0.6 mol/L 的NaOH溶液,混匀,加入等体积 PMP-甲醇溶液,70 ℃水浴2 h。冷却,加入 0.3 mol/L HCl调pH至6~7。经0.22 μm水系微孔膜过滤,进样。色谱条件:色谱柱为 Agilent Hi-Plex 柱 (300 mm×7.7 mm,8 μm),示差检测器(IR),流动相为超纯水,流量0.6 mL/min,温度70 ℃,进样量25 μL。
1.2.4 分子量测定 参照郭南生等[17]的方法并略修改。配置3.0 mg/mL的样品溶液,离心,过0.22 μm滤膜,进样后记录保留时间,根据标准曲线即可得到样品的相对分子质量。
1.2.5 结构特征
(1)扫描电镜(SEM):取少量干燥后的红萍多糖,真空镀金,观察样品的表面形态。
(2)原子力显微镜(AFM):配置0.1 μg/mL的红萍多糖溶液,取少量滴在云母片上,晾干,观察。
(3)傅里叶红外光谱(FT-IR):称取2 mg红萍多糖,与200 mg干燥的KBr混合研磨,扫描波长400~4 000 cm-1。
(4)刚果红试验:将1 mg/mL样品溶液与等体积刚果红溶液(100 μmol/L)混合,缓慢加入1 mol/L氢氧化钠溶液。利用紫外全波长扫描仪对混合液的最大吸收波长进行测定。相同体积的蒸馏水作为空白对照。
1.2.6 流变特性测定 分别配置5,10,15,20,25,30 mg/mL 的红萍多糖溶液进行静态剪切测试。测定温度25 ℃;模具为锥形板(直径40 mm,间隙0.5 mm)。吸取1.0 mL多糖溶液,记录1~100 s-1范围内多糖溶液黏度随剪切速率的变化数值。吸取20 mg/mL红萍多糖溶液进行动态振荡试验。25 ℃下,记录1~100 rad/s范围内储能模量(G′)和损耗模量(G″)的变化。
1.2.7 抗氧化活性测定
(1)DPPH自由基清除力:吸取2 mL不同质量浓度的多糖溶液于试管,加入2 mL浓度为2 mmol/L的DPPH甲醇溶液,混匀,避光反应30 min。测定517 nm处吸光度,同时测定DPPH甲醇溶液吸光度,利用Trolox作阳性对照。按式(1)计算DPPH自由基清除率。
(1)
式中:
R1——自由基清除率,%;
A0——空白组吸光度;
Ai——样品反应液吸光度。
(2)ABTS自由基清除力:配置7 mmol/L ABTS原液,取5.0 mL与等体积2.45 mmol/L过硫酸钾溶液混合,遮光保存12 h,得ABTS溶液。反应前去离子水稀释,测定732 nm处吸光度值为0.70±0.02。向红萍溶液中加入2.0 mL ABTS+工作液,涡旋混匀,避光反应30 min,测定732 nm处吸光度。以等体积去离子水作为空白对照,Trolox为阳性对照。按式(1)计算ABTS自由基清除率。
(3)羟自由基清除力:将1.0 mL磷酸缓冲溶液与0.2 mL 番红(520 μg/mL)、1.0 mL乙二胺四乙酸钠铁(Ⅱ)溶液混合,加入1.0 mL红萍多糖溶液,混匀,加入0.8 mL 过氧化氢(6%)溶液,37 ℃水浴30 min,测定515 nm 处吸光度,以等体积去离子水替代样品为空白组,以等体积去离子水替代样品和过氧化氢为对照组。按式(2)计算羟自由基清除率。
(2)
式中:
R2——羟自由基清除率,%;
A0——空白组吸光度;
Ai——样品反应液吸光度;
A对照——对照组吸光度。
1.3 数据处理
每组试验重复3次,采用Excel 2013软件进行数据统计,SPSS 17.0软件进行方差分析,结果以平均值±标准差表示,并采用Origin 8.5软件作图。
2 结果与分析
2.1 红萍多糖化学组成
试验表明,采用热水浸提法所得红萍多糖提取率为11.12%,高于大多数水生藻类多糖(1.5%~7.0%)[18]。由表1可知,红萍粗多糖中总糖含量为67.80%,高于甘草粗多糖(37.10%)[19],低于果实类粗多糖(88.20%)[20],可能与植物叶子中含有较多的蛋白质、淀粉、木质素等杂质有关;糖醛酸含量为21.14%,表明样品为酸性糖。此外,红萍粗多糖中灰分含量为20.15%(K 10.40%,Ca 0.42%,Mg 0.46%),蛋白质含量为5.65%,脂肪含量为0.82%。

表1 红萍多糖的化学组成Table 1 Content of chemical components in polysaccharide from Azolla
2.2 单糖组成
由图1可知,红萍多糖为酸性杂多糖,由甘露糖、葡萄糖醛酸、半乳糖、木糖、葡萄糖、半乳糖醛酸、阿拉伯糖、岩藻糖、核糖、鼠李糖10种单糖组成,其相对摩尔质量占比分别为28.03%,24.30%,15.36%,13.65%,8.25%,3.16%,3.01%,1.51%,1.50%,1.24%。其中,甘露糖、葡萄糖醛酸、半乳糖、木糖为红萍多糖的主要单糖组成,与Ramzani等[9]的结论存在差异,说明样品品种及种植地区可能会对红萍多糖的理化组成产生影响。

图1 红萍多糖与标准样品的高效液相色谱图Figure 1 High performance liquid chromatography of Azolla polysaccharide and standard
2.3 分子量大小及分布
由图2可知,红萍多糖具有较宽的分子量,表明其分子量分布不均一,且以10.28,15.11 min出现的两个峰为主,其峰面积占比分别为78.0%,19.3%,重均分子量(Mw)分别为2 338.00,1.60 kDa,数均分子量(Mn)分别为1 090.00,1.15 kDa,表明红萍多糖分子量较大。

图2 红萍多糖分子量分布图Figure 2 Molecular weight distribution curves of Azolla polysaccharide and standard
2.4 结构表征


图3 红萍多糖红外光谱图Figure 3 FT-IR spectra of Azolla polysaccharide
2.4.2 扫描电镜 由图4可知,红萍多糖整体呈不规则的网状结构,结构大小不一,不规则粘连,其表面质地均一且较为粗糙,表明多糖链连接较为紧密,可能是样品分子量较大的原因之一。当提取方法不同时,多糖会呈不同的表面形貌,分别用热水提取法和超声提取法提取麦冬多糖,后者所得多糖的片状更小,出现颗粒状[24]。
2.4.3 原子力 由图5可知,红萍多糖分子主要以柔性链的形式存在,且链分布密度较大,表面存在较多的不规则颗粒,可能与样品中存在一定的小分子矿物质有关。红萍多糖表面为尖锐峰状结构,分布较为紧密,其分子高度为2.1 nm左右,高于单个多糖链的平均高度(0.1~1.0 nm)[25],表明红萍多糖分子链中存在分支结构且互相交织。
2.4.4 三股螺旋结构 由图6可知,当红萍多糖存在时,随着氢氧化钠浓度的增加(0.00~0.15 mol/L),刚果红的最大吸收波长(Lmax)发生移动,当NaOH浓度超过1.5 mol/L 时,络合物最大吸收波长急剧下降,直至平稳,表明红萍多糖可能具有三股螺旋构象,且该构象被高浓度NaOH溶液破坏。三螺旋结构的多糖通常比单螺旋和无规卷曲的多糖具有更强的生物活性[26]。
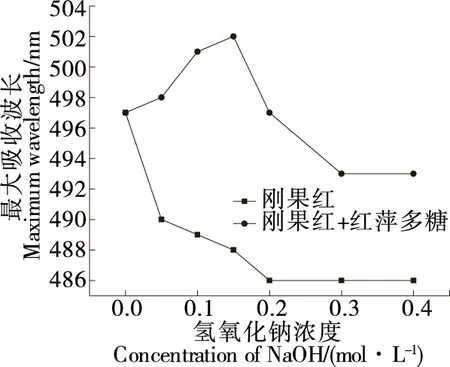
图6 红萍多糖刚果红反应变化曲线Figure 6 Congo red reaction curve of Azolla polysaccharide
2.5 流变学特性
由图7可知,红萍多糖的表观黏度呈现出对样品浓度和剪切速率的依赖性。表观黏度随样品浓度的升高而增加,可能是因为高浓度下多糖链之间交联区数量增加、多糖分子中羧基基团数量增加[27],分子间作用力以及缠结率增大,增加了流体流动阻力,限制了聚合物链的运动和拉伸,从而使表观黏度增大。此外,多糖溶液表观黏度随剪切速率的增加而降低,具有典型的剪切稀化行为,表明红萍多糖溶液为非牛顿流体中的假塑性流体,这一现象可以归因于剪切这一行为破坏了分子链的缠绕,减小了流动阻力[28]。
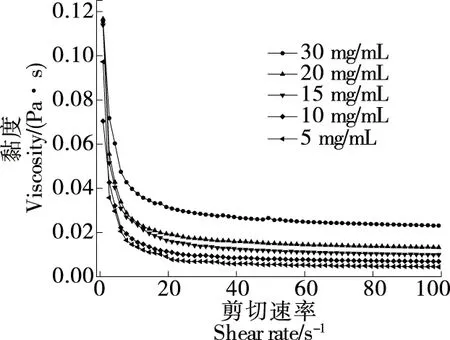
图7 红萍多糖的静态剪切变化曲线Figure 7 Static shear curves of Azolla polysaccharide solution with different concentration
由图8可知,当角频率为0.01~100.00 rad/s 时,随着频率的增加,G′和G″均上升,对频率有显著依赖性。当角频率较低时,G′

图8 2%红萍多糖溶液储能模量与损耗模量变化曲线Figure 8 Storage (G′)and loss (G″)modulus of 2% Azolla polysaccharide solution
2.6 抗氧化活性
2.6.1 DPPH自由基清除力 由图9(a)可知,当多糖质量浓度为0.1~1.0 mg/mL时,红萍多糖对DPPH 自由基的清除能力与多糖质量浓度呈正相关,且清除率在1 mg/mL 时达80.15%。红萍多糖、Trolox对DPPH自由基的半数抑制浓度(IC50值)分别为0.32,0.01 mg/mL。红萍多糖的DPPH自由基清除能力显著低于Trolox,但强于鳞毛蕨多糖(IC50值为2.04 mg/mL)[10]、蕨菜多糖(IC50值为0.82 mg/mL)[27]等蕨类多糖。
2.6.2 ABTS自由基清除力 由图9(b)可知,当多糖质量浓度为0.2~2.0 mg/mL时,红萍多糖对ABTS自由基的清除能力呈剂量依赖性提高,当样品质量浓度为2.0 mg/mL 时,清除率达91.28%,接近0.1 mg/mL Trolox的清除率。红萍多糖、Trolox对ABTS自由基半数抑制浓度(IC50值)分别为1.0,0.04 mg/mL,红萍多糖对ABTS自由基的清除力低于Trolox,高于槐叶萍多糖(IC50值为3.25 mg/mL)[28]。
2.6.3 羟自由基清除率 由图9(c)可知,当多糖质量浓度为0.2~2.0 mg/mL时,羟自由基清除率随多糖质量浓度的增加而提升,但增长速率逐渐趋于平缓,且清除率在2.0 mg/mL时达最大值62.18%。与其他水生植物多糖相比,2.0 mg/mL的红萍多糖对羟自由基的清除率低于同浓度下蓝藻多糖(82.33%)[15],但高于同浓度下裸藻多糖(50.14%)[29]。

图9 红萍多糖的抗氧化活性Figure 9 Antioxidant activity of Azolla polysaccharide
分子量、单糖组成、空间构象等因素均会影响多糖的抗氧化活性。王帅等[30]发现,多糖的抗氧化能力与其相对分子量呈正比,分子质量较大的多糖空间结构更复杂,易形成较多的分支和空腔,有助于自由基的去除。Yang等[31]研究表明,与中性糖相比,酸性多糖具有更强的氧化清除能力,且糖醛酸含量与抗氧化活性呈正相关。红萍多糖为分子量较大的酸性杂多糖,空间结构较为复杂,可能是其具有良好抗氧化活性的重要原因。此外,葡萄糖醛酸作为良好的供氢体,对增强样品的抗氧化能力具有关键作用。
3 结论
红萍多糖是一种酸性杂多糖,主要由甘露糖、葡萄糖醛酸、半乳糖、木糖、葡萄糖组成。扫描电子显微镜下,红萍多糖整体呈网状结构,分子呈链状分布且较为紧密。红萍多糖存在糖类特征基团,具有吡喃环与三股螺旋结构。样品溶液具有典型的剪切稀化行为,为非牛顿流体中的假塑性流体;且红萍多糖溶液存在弱凝胶特征,后续可应用至食品添加剂方面。红萍多糖对DPPH自由基、ABTS自由基和羟基自由基的半数抑制浓度(IC50值)分别为0.32,1.00,0.96 mg/mL,具有较好的抗氧化能力,可作为天然抗氧化剂。

