青楷槭树皮营养成分、活性物质含量及其抗氧化、抗菌活性
郭玉媛 金铁岩 张智勇
(延边大学农学院,吉林 延吉 133002)
病理状态下,当细胞没有足够能力清除活性氧或平衡其存在时就会引起氧化应激。机体在氧化应激状态下会产生并积累大量的自由基,过量的自由基会对细胞膜脂质、细胞蛋白质、DNA等生物大分子产生破坏作用,最终导致机体的氧化损伤并促进各类慢性疾病的病理学发生[1-2]。同时,由食品中存在或与食品相关的有害微生物的失衡而引起的食品腐败变质和安全问题也一直备受关注[3-4]。在食品工业中通常会选择加入抗氧化剂及防腐剂(抗菌剂)以达到保证食品品质的目的。但是化学合成的抗氧化剂及防腐剂的加入对机体始终存在安全隐患,因此,从天然原料中制备出安全、高效的天然抗氧化剂以及抗菌剂成为食品及相关领域的研究热点[5-7]。
青楷槭(AcertegmentosumMaxim,AT)是槭树科槭属落叶乔木,原产于中国东北、韩国以及俄罗斯等[8-9]。青楷槭在韩国民间传统医学上常被用于治疗眼病和肝脏类疾病;在中国常用其树皮泡水服用,具有护肝、醒酒以及消炎化毒等功效[10]。研究发现,青楷槭树皮中含有丰富的多酚以及黄酮类物质[11-12],具有清除自由基[13]、抗炎[14-15]和降解酒精[16]等活性。此外,韩国食品药品安全部(MFDS)已经批准青楷槭提取物可作为无急性毒性的食品原料[17]。但目前有关青楷槭的研究大多局限于树种的培育以及生态环境方面,关于其提取物抗氧化性的报道较少,而有关其抗菌性(食源性菌)的研究尚未见报道。
研究拟以青楷槭树皮为原料,制备70%乙醇提取物(ATEE)和100 ℃热水提取物(ATWE),测定青楷槭树皮的营养成分和两种提取物的活性成分(总酚、总黄酮、红景天苷和酪醇)含量,并评估其体外抗氧化活性和抗菌活性,以期为拓宽青楷槭功能性食品领域及其进一步的开发利用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
青楷槭(AT):吉林省珲春市密江镇;
变形链球菌、金黄色葡萄球菌和大肠杆菌:延边大学药学院微生物实验室;
没食子酸、芦丁、红景天苷、酪醇、1,1-二苯基-2-三硝基苯肼(DPPH)标准品:色谱纯,上海源叶生物科技有限公司;
2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)标准品:超纯,上海源叶生物科技有限公司;
丁基羟基茴香醚(BHA):BR级,上海源叶生物科技有限公司;
抗坏血酸(VC):分析纯,国药集团化学试剂有限公司;
甲醇、乙腈:色谱纯,上海阿拉丁生化科技股份有限公司。
1.1.2 主要仪器设备
分析天平:FA1104型,上海精密科学仪器有限公司;
电热鼓风干燥箱:101型,泰斯特仪器有限公司;
旋转蒸发仪:N-1001型,上海爱朗仪器有限公司;
液相色谱仪:Primaide型,日本日立高科技公司;
紫外分光光度计:U-3900型,日本日立高科技公司;
离心机:TDZ5-WS型,湖南湘仪实验室仪器开发有限公司;
酶标仪:SH-1000型,广州济恒生物科技有限公司;
超声波清洗器:SB-5200DT型,宁波新芝生物科技股份有限公司;
恒温培养箱:BPX-272型,上海博迅实验仪器有限公司。
1.2 方法
1.2.1 预处理 取青楷槭树皮,自然晾干,粉碎,过80目筛,收集备用。
1.2.2 提取物制备 称取适量的青楷槭树皮粉末,以料液比1∶10 (g/mL)加入体积分数为70%的乙醇溶液,室温下浸提24 h,过滤,重复3次,收集提取液。另取适量的青楷槭树皮粉末,以料液比1∶10 (g/mL),100 ℃下煮沸1 h,冷却至室温后过滤,重复3次,收集提取液。将提取液进行旋转浓缩,冷冻干燥,得到ATEE和ATWE。-20 ℃贮藏以备使用。
1.2.3 青楷槭树皮的基本成分测定
(1)水分含量:参照GB 5009.3—2016。
(2)粗灰分含量:参照GB 5009.4—2016。
(3)粗蛋白质含量:参照GB 5009.5—2016。
(4)粗脂肪含量:参照GB 5009.6—2016。
(5)总膳食纤维含量:参照GB 5009.88—2014。
(6)碳水化合物含量:扣除水分、粗灰分、粗蛋白和粗脂肪后的含量。
1.2.4 青楷槭树皮的矿物质含量测定
(1)钾、钠含量:参照GB 5009.91—2017。
(2)钙含量:参照GB 5009.92—2016。
(3)镁含量:参照GB 5009.241—2017。
(4)铁、铜、铝等微量元素含量:参照GB 5009.268—2016。
1.2.5 提取物总酚含量测定 根据文献[18]。
1.2.6 提取物总黄酮含量测定 根据文献[19]修改如下:将制备的ATEE与ATWE配置成适当浓度的溶液,吸取4 mL至试管,分别加入0.5 mL 5%亚硝酸钠溶液和10%硝酸铝溶液,充分混合后静置5 min。加入4 mL 4%氢氧化钠溶液,定容至10 mL,充分混匀静置5 min,测定510 nm处吸光度,用蒸馏水代替样品作对照。
1.2.7 提取物红景天苷和酪醇含量测定 采用HPLC法。选用安捷伦C18(250 mm×4.6 mm,5 μm)色谱柱,流动相为乙腈—水(V乙腈∶V水为2∶8),流速1.0 mL/min,柱温25 ℃,检测波长275 nm,进样量10 μL。
1.2.8 DPPH自由基清除能力 根据文献[20],按式(1)计算DPPH自由基清除率。
(1)
式中:
D——自由基清除率,%;
A1——试验组的吸光值;
A2——样品对照组的吸光值;
A0——空白对照组的吸光值。
1.2.9 ABTS阳离子自由基清除能力 根据文献[21]修改如下:分别吸取1 mL不同浓度(2.5~1 000.0 μg/mL)的ATEE和ATWE溶液,加入4 mL ABTS工作液,充分混合后静置6 min,测定734 nm处吸光度。使用1 mL无水乙醇代替样品作为空白组。按式(2)计算ABTS阳离子自由基清除率。
(2)
式中:
A——ABTS阳离子自由基清除率,%;
A0——空白组吸光值;
A1——试验组吸光值。
1.2.10 羟自由基清除能力 根据文献[18]。按式(1)计算羟自由基清除率。
1.2.11 铁还原能力测定 根据文献[22]。
1.2.12 抗菌性测定 根据文献[23]修改如下:将ATEE使用蒸馏水溶解,分别使用石油醚、乙酸乙酯对ATEE萃取3次,剩余的作为水相,旋转蒸发,得到ATEE的石油醚相、乙酸乙酯相以及水相浸膏。将3种浸膏、ATEE和ATWE使用相应体积的DMSO溶解,在无菌96孔板中加入100 μL细菌培养液,初始加入4 μL样品溶液,采用双倍连续稀释法,并建立空白对照组。使用酶标仪于650 nm 处测定加菌后的96孔板吸光度。将96孔板置于37 ℃恒温培养箱中孵育20 h,测定吸光度。使用氯霉素作阳性对照。按式(3)计算抑菌率,抑菌率达到90%[24]的浓度确定为MIC(μg/mL)。
(3)
式中:
Y——抑菌率,%;

A1——试验组培养前的吸光值;

A0——空白组培养前的吸光值。
1.2.13 数据统计与分析 试验重复3次,使用SPSS 17.0、Excel 2010进行数据统计分析,结果以平均数±标准差表示。多组间数据比较使用单因素方差分析(Duncan检验),P<0.05表示差异显著。使用Origin软件作图。
2 结果与分析
2.1 青楷槭树皮基本成分含量
由表1可知,青楷槭树皮中水分、粗脂肪、粗灰分、粗蛋白及碳水化合物含量分别为7.12%,4.67%,5.83%,3.96%,78.42%,碳水化合物含量较丰富,其中总膳食纤维含量为66.08%。与青楷槭叶基本成分相比,除粗蛋白含量相对较低外,青楷槭树皮水分、粗脂肪、粗灰分、碳水化合物以及膳食纤维含量均高于青楷槭叶中的[25]。

表1 青楷槭树皮基本成分含量Table 1 Content of proximate compositions in bark of AT %
2.2 青楷槭树皮矿物质含量
由表2可知,青楷槭树皮中4种常量元素含量为Ca>K>Mg>Na,其中Ca、K、Mg含量较高,分别为13 028.15,3 600.68,937.59 mg/kg。6种微量元素含量顺序为Mn>Fe>Zn>Al>Cu>Cr,其中Mn与Fe含量丰富,分别为943.49,601.88 mg/kg。与青楷槭叶[25]中的矿物质含量相比,尽管二者各元素含量存在差异,但含量变化趋势基本一致。综上,青楷槭可作为Ca、K、Mg、Fe等矿物质的良好补充来源。

表2 青楷槭树皮矿物质含量Table 2 Content of minerals in bark of AT mg/kg
2.3 提取物酚类物质含量
由表3可知,ATEE的总酚、总黄酮含量分别为315.66,79.26 mg/g,ATWE的总酚、总黄酮含量分别为188.34,34.89 mg/g。ATEE和ATWE的总酚含量均高于总黄酮。ATEE的总酚、总黄酮含量均高于ATWE的,与Lee等[13]的结果一致,但与Choi等[16]的结果相反,且差异显著(P<0.05),说明不同的产地、处理方式以及提取方法等会影响提取物中酚类物质含量。同时,ATEE中红景天苷与酪醇含量均高于ATWE的,与Hwang等[26]的结论一致,证明红景天苷是青楷槭的主要成分。红景天苷是名贵药材红景天中主要的有效成分,其能在清除自由基、抗衰老、抗肥胖和保肝等方面发挥重要作用,具有广阔的市场前景与经济价值[15,26-28]。但是人工培育出高含量红景天苷的红景天至今仍存在困难,难以满足市场需求[29],因此,青楷槭是否可以作为新的红景天苷提取来源值得后续研究。

表3 ATEE与ATWE的酚类化合物含量Table 3 Phenolic compounds contents of ATEE and ATWE
2.4 DPPH自由基清除能力
由图1可知,试验浓度范围(2.5~1 000.0 μg/mL)内,维生素C、BHA、ATEE和ATWE的DPPH自由基清除率随样品质量浓度的增大而增大,当质量浓度为1 000 μg/mL 时,其清除率分别为96.59%,90.14%,95.11%,93.80%,IC50分别为8.34,9.22,6.64,14.33 μg/mL。相同质量浓度下,ATEE的DPPH自由基清除率始终高于ATWE,且差异显著(P<0.05)。低质量浓度(2.5~25.0 μg/mL)下,ATEE的DPPH自由基清除率均高于维生素C和BHA的,较高质量浓度(50~1 000 μg/mL)下,ATEE的DPPH自由清除率高于BHA的,虽低于维生素C的但相差不大。总体上,DPPH自由基清除能力为ATEE>维生素C>BHA>ATWE。
2.5 ABTS阳离子自由基清除能力
由图2可知,试验浓度范围(2.5~1 000.0 μg/mL)内,维生素C、BHA、ATEE和ATWE的ABTS阳离子自由基清除率随样品质量浓度的增大而增大,当质量浓度为1 000 μg/mL时,其清除率分别为93.79%,94.01%,94.23%,94.24%。较低质量浓度(2.5~50.0 μg/mL)下,两种样品之间以及与阳性对照之间存在显著差异(P<0.05),其中ATEE的ABTS阳离子自由基清除率始终高于ATWE和维生素C的,但低于BHA的,ATWE在低质量浓度(2.5,5.0 μg/mL)下的清除率高于维生素C的。较高质量浓度(50~1 000 μg/mL)下,除ATWE的ABTS阳离子自由基清除率在100 μg/mL时较低于ATEE和对照组外,两种样品和对照组之间无显著差异,维生素C、BHA、ATEE和ATWE的IC50分别为19.64,5.74,10.58,23.44 μg/mL。总体上,ABTS阳离子自由基清除能力为BHA>ATEE>维生素C>ATWE。

小写字母不同表示差异显著(P<0.05)图1 ATEE与ATWE的DPPH自由基清除能力Figure 1 DPPH radical scavenging activity of ATEE and ATWE
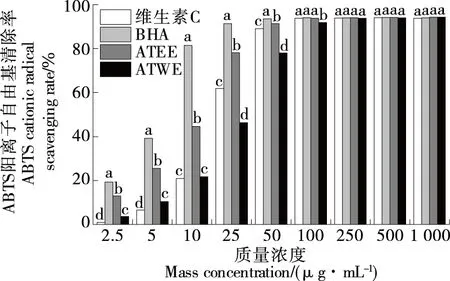
小写字母不同表示差异显著(P<0.05)图2 ATEE与ATWE的ABTS阳离子自由基清除能力Figure 2 ABTS radical scavenging activity of ATEE and ATWE
2.6 羟自由基清除能力
由图3可知,试验浓度范围(2.5~1 000.0 μg/mL)内,维生素C、ATEE和ATWE的羟自由基清除率随样品质量浓度的增大而增大,而BHA的羟自由基清除率增加缓慢且清除率均很低,当质量浓度为1 000 μg/mL时,其清除率仅为5.99%,说明BHA清除羟自由基的能力较弱。两种样品之间,ATEE的羟自由基清除率在相同质量浓度下均高于ATWE的,且差异显著(P<0.05),较低质量浓度(2.5~50.0 μg/mL)下,ATEE表现出更好的清除能力,且高于维生素C和BHA的,但清除率均<10%。

小写字母不同表示差异显著(P<0.05)图3 ATEE与ATWE的羟自由基清除能力Figure 3 Hydroxyl radical scavenging activity of ATEE and ATWE
较高质量浓度(100~1 000 μg/mL)下,维生素C、ATEE和ATWE的羟自由基清除率增长速率增加,并当质量浓度为1 000 μg/mL时,维生素C、ATEE及ATWE对羟自由基的清除率分别为81.64%,55.51%,30.93%。综合比较,羟自由基清除能力为维生素C>ATEE>ATWE>BHA。
2.7 铁还原能力
由图4可知,试验浓度范围(2.5~1 000.0 μg/mL)内,维生素C、BHA、ATEE和ATWE的铁还原能力随样品质量浓度的增大而增大,当样品质量浓度为1 000 μg/mL时,其吸光度值分别为2.109,1.172,1.876,1.427。相同质量浓度下,维生素C的铁还原能力最强,BHA的最弱,ATEE和ATWE的铁还原能力在低质量浓度(2.5~100.0 μg/mL)内,除25 μg/mL的外均无显著差异,在较高质量浓度(500,1 000 μg/mL)下,ATEE的铁还原能力均高于ATWE,且差异显著(P<0.05)。ATWE与BHA的铁还原能力在较低质量浓度(2.5~25.0 μg/mL)时无显著差异,但随着质量浓度的增加,在较高质量浓度(50~1 000 μg/mL)时,ATWE的铁还原能力均高于BHA的。综合比较,铁还原能力为维生素C>ATEE>ATWE>BHA。

小写字母不同表示差异显著(P<0.05)图4 ATEE与ATWE的铁还原能力Figure 4 Ferric reducing power of ATEE and ATWE
2.8 抗菌性
由表4可知,ATEE、ATWE以及ATEE的石油醚相、乙酸乙酯相和水相对变形链球菌均无抗菌活性,但对大肠杆菌均表现出良好的抑菌活性,其MIC值分别为32,32,128,16,16 μg/mL。对于金黄色葡萄球菌,ATEE及其石油醚相、乙酸乙酯相均表现出了抗菌活性,MIC值分别为256,256,128 μg/mL。综上,青楷槭提取物能够对大肠杆菌表现出更好的抗菌活性,整体上的抗菌活性为乙酸乙酯相>ATEE>石油醚相>石油醚相>水相>ATWE,其中ATEE及其各级分展示出了比ATWE更好的抗菌活性,乙酸乙酯相相对其他提取物的抗菌活性更好,可能是因为酚类物质更集中在乙酸乙酯相中。侯妍[30]在青楷槭乙醇提取物的乙酸乙酯萃取层中分离得到19个化合物,其中几种成分(酪醇[31]、没食子酸甲酯[32]、没食子酸、儿茶素[33]、表儿茶素没食子酸酯[34]和槲皮素[35]等)具有一定的抑菌能力。

表4 ATEE与ATWE的MIC†Table 4 MIC of ATEE and ATWE μg/mL
3 结论
测定了青楷槭的营养成分、活性成分,并对其抗氧化和抗菌活性进行评估。结果表明:70%乙醇提取物和100 ℃ 热水提取物中含有丰富的酚类物质,此外,红景天苷为青楷槭提取物中的主要成分,含量丰富。70%乙醇提取物(ATEE)和100 ℃热水提取物(ATWE)均具有良好的自由基清除能力和还原力。其中,70%乙醇提取物表现出更好的抗氧化能力。70%乙醇提取物及其所有级分均表现出了比100 ℃热水提取物更好的抗菌能力,其中70%乙醇提取物乙酸乙酯相在总体上表现出最优的抗菌活性。综上,青楷槭树皮提取物具有作为天然抗氧化剂以及天然抗菌剂的良好发展潜力。后续可对青楷槭树皮中活性物质进行定性定量分析,并优化其提取工艺。

