不同负ORP值碱性电解水理化、抗氧化及缓解胃酸性能研究
夏 瑞 钟 耕 李 恬 杨万富 高羽歌
(西南大学食品科学学院,重庆 400000)
自由基过多会导致机体氧化应激损伤[1-2]。近年来,清除自由基,提高机体抗氧化能力成为预防和治疗疾病的着眼点。随着抗氧化剂的应用,发现一些化学合成抗氧化剂存在副作用[3]。因此,寻求天然抗氧化剂,通过饮食调节清除自由基成为研究热点[4]。
碱性电解水(alkaline electrolyzed water,AEW)是饮用水或电解质水经电解后在阴极生成的高负氧化还原电位碱性水[5-6]。氧化还原电位(oxidation-reduction potential,ORP)作为水溶液获得或失去电子的趋势,反映出体系的氧化—还原性(电位为正,为氧化性;电位为负,为还原性)[7]。Shirahata等[8]发现,还原电位越低(负ORP值越大),其给电子能力越强,与过氧自由基结合能力越强。研究[9-10]表明,AEW可以抑制脂质过氧化,缓解氧化应激损伤。因此具有开发成为天然抗氧化功能饮料的潜力[11]。目前关于电解水的研究主要集中于应用方面[12-13],迄今未见对不同负ORP值AEW抗氧化活性比较研究报道。
胃酸过多通常是吸烟饮酒、饮食不当等不良生活习惯导致,会造成机体产生胸胃灼痛、呕吐等不良反应,严重者还会引起其他肠胃疾病[14]。用于治疗胃酸过多的药物包括能减少胃酸分泌的抑酸药,如奥美拉唑;中和胃酸的抗酸药,如碳酸氢钠。这些药物疗效虽好但有较严重的副反应,不能长期服用[15]。碱性电解水pH呈弱碱性,符合饮用水标准,可作为天然抗酸剂[16-17]。目前,关于AEW缓解胃酸过多症的研究还未见报道。
试验拟以生活饮用水为对照,开展不同负ORP值AEW抗氧化以及中和胃酸过多能力的研究,探究AEW负ORP值与pH值对应关系以及负ORP值和pH值与AEW抗氧化和中和胃酸能力的关系,旨在为新型饮品的开发和功能探索提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
雄性昆明小鼠:SPF级,许可证号为SCXK(湘)2019-0004,湖南斯莱克景达实验动物有限公司;
抗坏血酸、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS):北京索莱宝科技有限公司;
胃蛋白酶:活性3 200~4 500 U/mg,北京索莱宝科技有限公司;
其他试剂均为国产分析纯;
试验用水均为超纯水。
1.1.2 主要仪器设备
紫外可见分光光度计:759型,上海菁华科技仪器有限公司;
电解水机:XK-A7型,广东新康科技有限公司;
pH/ORP计:pHS-3C型,上海仪电科学仪器股份有限公司;
电感耦合等离子体质谱仪(ICP-MS):Agilent7700X型,美国安捷伦科技有限公司;
高速分散器:XHF-DY型,宁波新芝生物科技股份有限公司;
离心机:Eppendorf Centrifuge 5804 R型,德国艾本德科学公司。
1.2 试验方法
1.2.1 碱性电解水制备 使用电解水机电解生活饮用水制得不同负ORP值电解水(水样1、水样2、水样3)。
1.2.2 水质理化指标测定 参照GB/T 5750—2006《生活饮用水标准检验方法》,检测水样水质指标。检测指标包括:pH值、TDS值、ORP值(采用pH/ORP计测定),电解水中的矿物质元素采用ICP-MS法检测。各组试验平行测定3次。
1.2.3 抗氧化能力测定 以生活饮用水作比较,测定不同负ORP值AEW水样1、2、3体外抗氧化活性。
(1)超氧阴离子自由基清除率:参考Saad等[18]的方法,稍作调整。取pH 8.2 Tris-HCl缓冲溶液5 mL于具塞试管中,(25.0±0.5)℃水浴预热20 min,依次加入样品溶液2 mL 和0.5 mL浓度5.00×10-3mol/L邻苯三酚溶液(1.0×10-2mol/L HCl溶液配制),摇匀,25 ℃水浴4 min,320 nm处测定其吸光度A1;超纯水2 mL代替上述样品溶液,测定吸光度A0;以1.0×10-2mol/L HCl参比溶液0.5 mL代替邻苯三酚溶液,测定吸光度A2。按式(1)计算超氧阴离子自由基清除率。
(1)
式中:
S——自由基清除率,%;
A0——空白组吸光度值;
A1——试验组吸光度值;
A2——对照组吸光度值。
以维生素C为标品,得到维生素C质量浓度x(μg/mL)与超氧阴离子自由基清除率y(%)标准曲线方程为y=0.007 1x+0.028 8,R2=0.999 2,样品的超氧阴离子清除率结果以维生素C当量表示(μg维生素C/mL)。
(2)羟自由基清除率:参考Hui等[19]的方法并稍作修改。取2.0 mL样品液,依次加入9 mmol/L FeSO4溶液、9 mmol/L水杨酸乙醇溶液和8.8 mmol/L H2O2溶液各2.0 mL,37 ℃水浴30 min。用同体积超纯水代替样品液作空白组,用同体积超纯水代H2O2溶液作对照,510 nm 处测量吸光度值。按式(1)计算羟自由基清除率。
以维生素C为标品,得到维生素C质量浓度x(μg/mL)与羟自由基清除率y(%)标准曲线方程为y=0.098 8x+0.319 2,R2=0.999 2,样品的羟自由基清除率结果以维生素C当量表示(μg维生素C/mL)。
(3)ABTS自由基清除率:参考Ayseli等[20]的方法,略作调整。4 mL样品液与4 mL 0.1 mmol/L ABTS+溶液混合,剧烈震摇,避光放置10 min,734 nm处测定其吸光度,用超纯水溶液代替样品作对照。按式(2)计算ABTS自由基清除率。
(2)
式中:
S——ABTS自由基清除率,%;
A0——对照组吸光度;
A1——试验组吸光度。
以维生素C为标品,得到维生素C质量浓度x(μg/mL)与ABTS自由基清除率y(%)标准曲线方程为y=0.067 9x+0.017 1,R2=0.999 5。样品ABTS自由基清除率结果以维生素C当量表示(μg维生素C/mL)。
(4)抑制Fe2+-H2O2诱导小鼠肝匀浆脂质过氧化能力(丙二醛抑制率):参考陈思南等[21]的方法,略加修改。小鼠适应性喂养1周,颈椎脱臼法处死,取新鲜肝脏用预冷生理盐水冲洗后加入超纯水,高速分散器3 000 r/min匀浆5 min,制成质量分数5%肝匀浆待用。4 ℃、3 000 r/min 离心15 min,取1.0 mL肝匀浆上清液于样品管,加入0.5 mL样品液,混匀,37 ℃水浴10 min,加入0.5 mL 6 mmol/L FeSO4溶液和40 μL 60 mmol/L H2O2溶液作诱导剂,模型管不加样品溶液,空白管不加诱导剂,将模型管、空白管和样品管置于37 ℃水浴1 h。再冰浴10 min终止反应。向各管加入体积分数15%三氯乙酸1.0 mL和0.67%硫代巴比妥酸1 mL,混匀,置于100 ℃ 水浴15 min,自来水冷却,6 000 r/min离心10 min,取上清液于532 nm处测吸光度。按式(3)计算丙二醛抑制率。
(3)
式中:
R——抑制率,%;
A模型、A空白、A样品——模型管、空白管、样品管吸光度。
1.2.4 体外模拟缓解胃酸过多能力测定 参考文献[22-23]稍作修改。
(1)人工胃液的配置:将氯化钠(2 g)和胃蛋白酶(3.2 mg)溶解于500 mL超纯水,加入盐酸(7 mL)用超纯水定容成1 000 mL,定容后调节pH至1.2。
(2)不同负ORP值AEW对人工胃液H+的消耗:取上述人工胃液200 mL,加热保持溶液温度在(37.0±0.5)℃,加入饮用水、水样1、水样2、水样3以及0.2 g/100 mL 碳酸氢钠溶液90 mL作对照,100 r/min摇床反应5,10,30 min时依次取出,吸取溶液5 mL用0.45 μm 微孔滤膜过滤,取滤液用于下述测定。
(3)胃酸消耗量测定:将上述滤液置于锥形瓶,以1 g/L 酚红作指示剂,用0.01 mol/L氢氧化钠滴定,测定H+浓度,表征胃酸消耗量,按式(4)计算胃酸消耗量。
(4)
式中:
I——胃酸消耗量,mmol/L;
V人工胃液——人工胃液体积,200 mL;

VNaOH——消耗氢氧化钠体积,mL。
1.3 数据处理
采用Excel 2016进行统计分析,结果以“平均值±标准差”表示,SPSSS 26.0软件进行统计学分析,通过Spearman法进行相关性分析,Duncan法进行多组间显著性分析,采用Origin 2019制图。
2 结果与分析
2.1 碱性电解水水质
2.1.1 pH、ORP和TDS值 由表1可以看出,电解生活饮用水产生水样1、2的pH值符合相关企业标准,如Q/TZYP 0001S—2019《苏打水饮料》和Q/LBJX 0002S—2019《苏打水饮料》。国产的不论是人工调配还是天然苏打水,各类标准中,其pH值均要求不得超过9。水样3 pH过高不符合标准,后续试验将其作为对照研究不同负ORP值AEW抗氧化和缓解胃酸能力。AEW的负ORP值则随水样的pH值增大而逐渐增大,通过对表1 AEW负ORP值与pH值相关性分析,表明其呈极显著正相关(P<0.01)。有研究[24]报道饮用ORP值低(即负ORP值大)的水,可以降低机体内氧化性物质的含量及其活性,提高抗氧化酶的活性,有益于人体健康。尹军等[25]提出ORP<200 mV可作为健康饮用水标准之一。由表1可知,AEW水样1、2、3的ORP值为负值,显著低于200 mV(P<0.05),饮用水的ORP为正值(353 mV),且显著高于200 mV(P<0.05),说明AEW符合健康饮用水标准。浓度为0.01 mol/L的NaOH溶液,其pH值为11.85,为强碱性溶液,但其ORP值为正值(286 mV);质量分数为0.2%的NaHCO3溶液,其pH为8.96,为碱性溶液,ORP值为正值(273 mV),均显著高于200 mV(P<0.05),说明人工调制的碱性水不具有抗氧化性能,负ORP值为AEW的特点。

表1 不同水样水质指标†Table 1 Indexes of different water quality
2.1.2 碱性电解水主要矿物质元素 由表2可知,AEW水样1、2、3主要矿物质元素含量符合饮用水标准GB 5749—2006《生活饮用水卫生标准》且3种水样无显著性差异,表明电解原料相同不同负ORP值对AEW矿物质含量无显著影响,与蔡怀彧[6]对AEW制备条件与矿物质含量关系影响研究结果一致。3种水样中矿物质含量以钙含量最高,其次是钠和镁,可能与饮用水中矿物质含量高低有关。
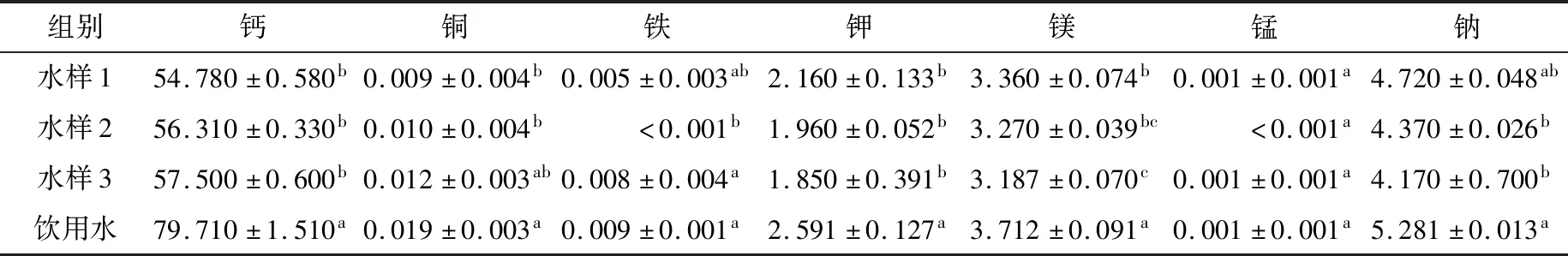
表2 不同水样主要矿物质元素含量†Table 2 Content of main mineral elements in different water mg/L
2.2 碱性电解水体外抗氧化能力
2.2.1 超氧阴离子自由基清除率 由图1可知,不同负ORP值AEW对超氧阴离子自由基清除能力由大到小为水样3>水样2>水样1,且显著高于未电解饮用水(P<0.01)。其中水样3对超氧阴离子自由基清除作用最强,其维生素C当量为(53.25±0.76)μg维生素C/mL。饮用水对超氧阴离子自由基具有微弱的清除能力,与陈荣河等[26]的研究结果一致,推测可能与饮用水中的无机成分含量有关。对比表2可知,不同负ORP值AEW主要矿物质含量除钙、钾、镁显著低于饮用水外,其他与饮用水相比无显著性差异。但不同负ORP值AEW对超氧阴离子自由基清除能力大小显著高于饮用水(P<0.01),说明AEW中的无机成分对其抗氧化作用无显著影响,AEW抗氧化作用的主要原因是其负ORP值所致。通过对AEW负ORP值与超氧阴离子自由基清除能力相关性分析表明AEW负ORP值与超氧阴离子自由基清除能力呈正相关。说明负ORP值AEW可以清除超氧阴离子等氧自由基,具有一定抗氧化性,且AEW抗氧化能力增强与ORP值大小相关。这与Shirahata等[8]发现AEW可以清除活性氧,保护DAN免受氧化损伤的研究结果一致。
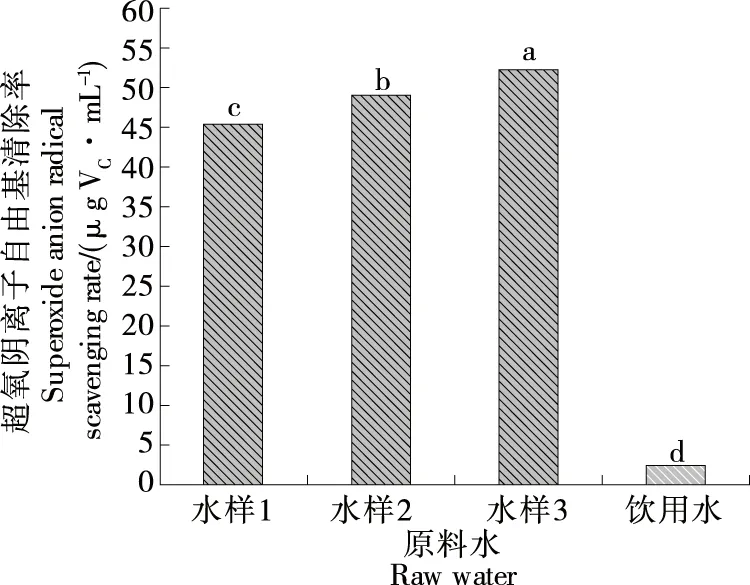
小写字母不同表示具有显著性差异(P<0.05)图1 不同水样的超氧阴离子自由基清除能力Figure 1 Superoxide anion radical scavenging ability of different water samples
2.2.2 羟自由基清除率 由图2可知,AEW水样3对羟自由基清除作用最强,水样2次之,水样1最低,饮用水对羟自由基无清除作用。对AEW负ORP值与羟自由基清除能力进行相关性分析,表明AEW负ORP值与羟自由基清除能力呈正相关。对比相关研究报道,Hu等[27]发现AEW能够缓解大鼠因活性氧(超氧阴离子自由基,OH自由基)引起的氧化应激损伤,表现出一定的抗氧化性,与试验结果相似。
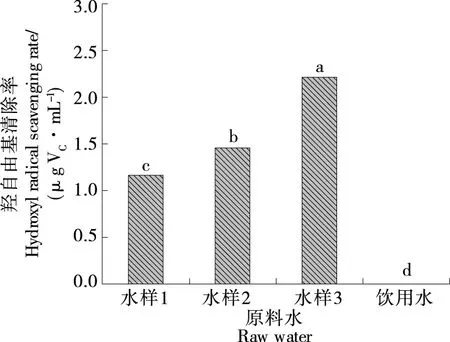
小写字母不同表示具有显著性差异(P<0.05)图2 不同水样的羟自由基清除能力Figure 2 Hydroxyl radical scavenging ability of different water samples
2.2.3 ABTS自由基清除率 由图3可知,不同负ORP值AEW对ABTS自由基清除率为水样3>水样2>水样1,各组间结果统计学差异显著(P<0.05),且均显著高于饮用水(P<0.05)。饮用水对ABTS自由基具有一定的清除作用,与卢婵[7]对3种饮用水抗氧化功能的研究结果一致。相关性分析表明AEW ABTS自由基清除率与其负ORP值呈正相关。负ORP值AEW具抗氧化活性。Kim等[28]研究发现AEW可以通过清除自由基缓解小鼠氧化应激损失,与试验结果相似。
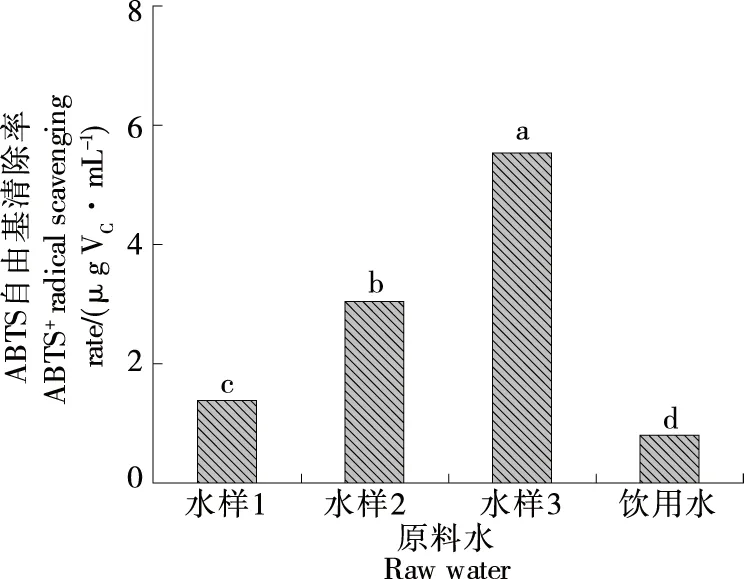
小写字母不同表示具有显著性差异(P<0.05)图3 不同水样的ABTS自由基清除能力Figure 3 ABTS free radical scavenging ability of different water samples
2.2.4 对Fe2+-H2O2诱导的肝匀浆脂质过氧化作用的影响 由图4可知,不同负ORP值AEW水样均能明显抑制肝匀浆体系MDA生成,而饮用水对MDA的生成无抑制作用。其中,水样3对肝匀浆过氧化作用抑制率显著高于水样2以及水样1(P<0.05),说明不同负ORP值AEW表现出一定的抗脂质过氧化性。相关性分析表明AEW对MDA生成的抑制率与其负ORP值呈极显著正相关(P<0.01)。刘秋芳等[10]发现AEW可使D-半乳糖所致的小鼠肝、肾、脑组织MDA的生成量下降,与试验结果相似,但其只使用了一种AEW,未对不同负ORP值AEW进行比较研究。
4种抗氧化指标结果表明,不同负ORP值AEW具有抗氧化性,且表现出较强的超氧阴离子自由基清除能力,自由基清除率大小与AEW负氧化还原电位大小相对应。研究[8]发现,还原电位越低(负ORP值越大),其供电子能力越强,与过氧自由基结合能力就越强,因此含较高负ORP的物质表现出较强抗氧化作用。不同负ORP值AEW对Fe2+-H2O2诱导肝匀浆体系MDA生成的抑制率随负ORP值增大而增强。综上,不同负ORP值AEW表现出抗氧化活性以及抗脂质过氧化作用。
2.3 碱性电解水负氧化还原电位与抗氧化指标相关性分析
AEW负ORP值与ABTS自由基清除率、超氧阴离子自由基清除率、羟自由基清除率以及MDA抑制率相关性分析见表3。结果表明,AEW负ORP值与4种抗氧化指标呈极显著正相关(P<0.01),负ORP值与ABTS自由基清除率、超氧阴离子自由基清除率、羟自由基清除率以及MDA抑制率相关系数分别为0.965(P<0.01),0.962(P<0.01),0.920(P<0.01),0.998(P<0.01)。说明AEW负ORP值与其抗氧化能力存在显著相关性,即负ORP值是AEW抗氧化能力的主要原因,负ORP值越大其抗氧化能力越强。
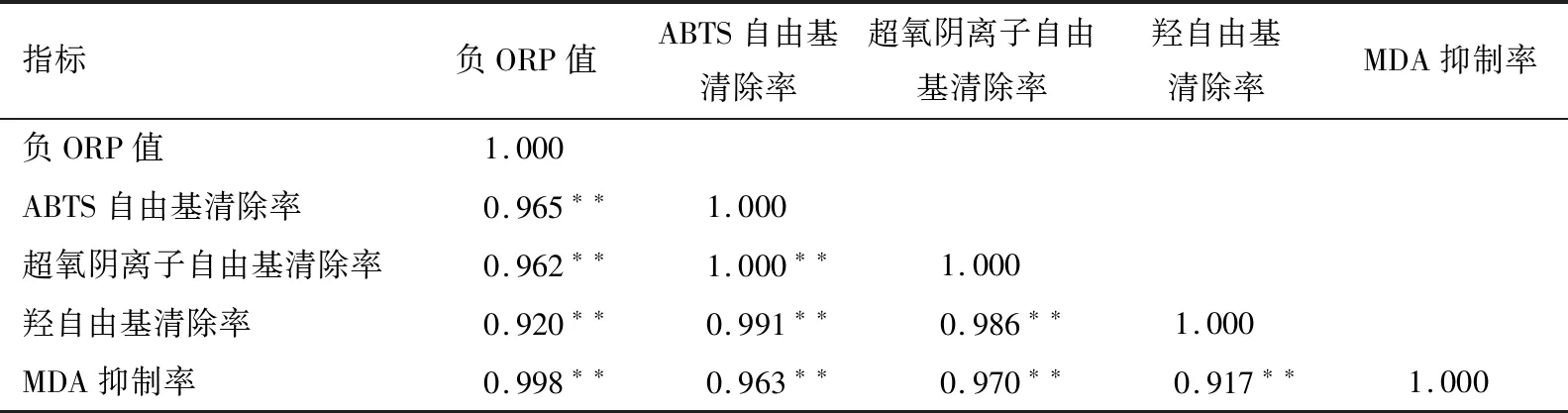
表3 不同负ORP值碱性电解水负ORP值与抗氧化活性的相关性分析†Table 3 Correlation analysis between ORP value and antioxidant activity of different alkaline electrolyzed water
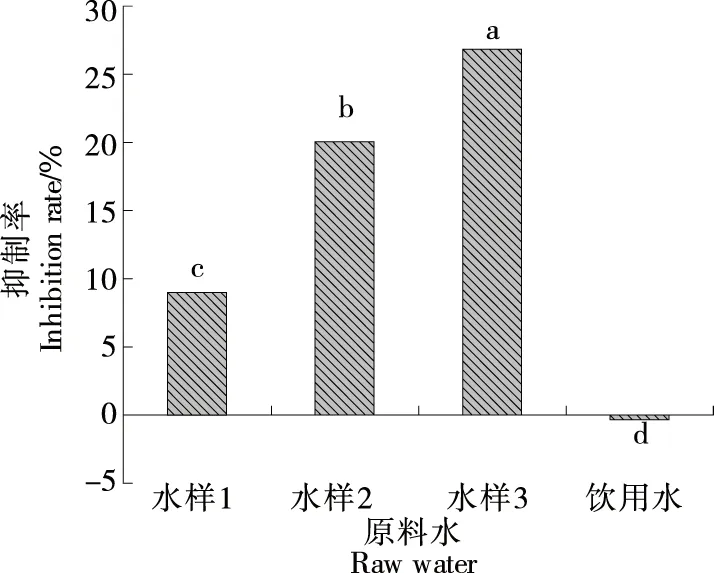
小写字母不同表示具有显著性差异(P<0.05)图4 不同水样对Fe2+-H2O2诱导肝匀浆脂质过氧化作用的影响Figure 4 Effect of different water samples on lipid peroxidation of liver homogenate induced by Fe2+-H2O2
2.4 对体外人工胃酸过多的缓解作用
由图5可知,不同负ORP值AEW在人工胃液中反应5 min,对体外人工胃酸中和能力均显著高于饮用水,水样3显著高于水样2与水样1。与0.2% NaHCO3相比,水样2与其对体外人工胃酸中和能力相当,水样1低于0.2% NaHCO3,水样3高于0.2% NaHCO3。反应时间延长至10,30 min,AEW对人工胃液中和作用未减弱,依然维持最初水平,水样2与0.2% NaHCO3效果相同。因此,不同负ORP值AEW与饮用水相比具有中和胃酸能力,而饮用水作为一种溶剂,对胃酸有一定稀释作用[22]。NaHCO3作为一种抗酸剂,常用于治疗胃酸过多症,但长期服用会导致胃肠胀气、腹泻和便秘,钠摄入过多易诱发高血压[22,29]。AEW水样2中和胃酸效果与0.2% NaHCO3相当,说明AEW可以作为一种天然抗酸剂,是安全缓解胃酸过多症的替代方法。通过对AEW pH值和胃酸消耗量的相关性分析表明AEW中和胃酸能力与pH值呈显著正相关(P<0.01)。Panda等[22]研究发现较高碱度的植物食品表现出较强的缓解胃酸过多能力,说明pH与缓解胃酸能力相关,与试验结果一致。

小写字母不同表示具有显著性差异(P<0.05)图5 不同水样对人工胃酸的体外中和能力Figure 5 The neutralization ability of different water samples to artificial gastric acid in vitro
3 结论
试验表明不同负氧化还原电位值碱性电解水1、2基本理化指标符合国内苏打水相关饮用标准,碱性电解水具有抗氧化以及缓解胃酸过多的能力,负氧化还原电位值是碱性电解水具有抗氧化能力机理所在。比较得出水样2具有较强抗氧化能力,其超氧阴离子自由基、羟自由基、ABTS自由基清除能力分别为(49.06±0.16),(1.46±0.03),(3.04±0.08)μg维生素C/mL,MDA抑制率为(20.40±1.56)%,缓解胃酸能力与0.2% NaHCO3相当。可开发为具有抗氧化和缓解胃酸作用的功能性饮用水,为消费者在饮用水健康需求方面提供新选择。后续可进一步对碱性电解水其他功能性质及负氧化还原电位值不同对其他功能性质的影响进行研究。

