咪喹莫特诱导银屑病模型小鼠T细胞免疫功能改变与性别的关系
杨 梅,唐彩红,桂雨晴,陈镜宇,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,安徽抗炎免疫药物协同创新中心,安徽 合肥 230032)
银屑病是一种慢性自身免疫病,在其病理机制的研究和药物的药效学评价中,免疫系统的功能变化是重要的研究内容和评价依据。临床上银屑病的患病率在男女之间并无差异[1]。咪喹莫特(imiquimod,IMQ)诱导的小鼠银屑病样模型由于简便易行,已成为实验室研究中最常用的银屑病动物模型,且该模型在病变特点上与银屑病有诸多类似,因此,在银屑病病理机制研究和药物的药效学评价中被广泛应用。尽管课题组前期研究表明,IMQ诱导的银屑病样雌性小鼠模型和雄性小鼠模型中皮肤组织增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)与内披蛋白的表达没有差异,但这个结论仅仅局限于动物模型中角质细胞增殖、分化的角度[2],然而此模型不同性别的小鼠的免疫功能是否会受到性别的影响,仍不清楚。阐明性别对该模型的影响,是保证研究结果的严谨、客观的重要基础。本研究从T细胞免疫细胞功能和角质细胞损伤两个角度来探究IMQ诱导的银屑病模型小鼠的免疫功能变化与性别之间的关系。
1 材料与方法
1.1 实验动物80只7~8周龄的BALB/c小鼠(雌雄各半),售于北京斯贝福生物科技有限公司[生产许可证号:SCXK(京)2019-0010],实验中所使用的动物均饲养在安徽医科大学临床药理研究所SPF动物实验室。本实验内容均通过安徽医科大学临床药理研究所动物实验伦理委员会批准。且本实验所涉及的实验方法均符合动物实验的相关指南和规定。
1.2 药物与试剂角蛋白1(keratin 1,K1)一抗(批号:00045116)、角蛋白10(keratin 10,K10)一抗(批号:14t1484)购自于Proteintech;Involucrin一抗(批号:52k4942)、IL-17一抗(批号:10k3643)、IFN-γ一抗(批号:11p5029)、IL-4一抗(批号:80w1874)、Ki67一抗(批号:40f5981)、PCNA一抗(批号:87a7182)、GAPDH一抗(批号:62u0922)购自于Affinity公司;EDTA抗原修复液Ph9.0(批号:19042401)、免疫组化通用型试剂盒(批号:2010D1217)购自于中杉金桥;ECL化学发光试剂购自于美国赛默飞(批号:TG269475);IMQ乳膏购自于四川明欣制药(批号:19070240);凡士林乳膏购自于天津市博迪化工有限公司(批号:11021);脱毛膏购自于冰王(批号:20041203)。
1.3 仪器Olympus倒置显微镜(日本奥林巴斯);Leica正置荧光显微镜(美国Leica);低温高速离心机(美国Sigma);化学发光成像系统(美国GE公司);十色流式细胞仪(美国Beckman Coulter有限公司);1 mL玻璃匀浆器(广州优博实验器材有限公司)。
1.4 动物分组与银屑病模型的建立BALB/c小鼠共80只(雌雄各半),随机分为雌性正常组(N1),雄性正常组(N2),雌性模型组(M1)和雄性模型组(M2),各组小鼠数量均为20只。建模前4 d对小鼠进行背部脱毛(范围2 cm×3 cm),为了防止脱毛处毛发再生,在第一次脱毛后设置2 d观察期,后进行二次脱毛。正式造模当天,M1和M2组小鼠脱毛处均匀涂抹62.5 mg的IMQ乳膏,N1、N2组小鼠脱毛处则均匀涂抹相同剂量的凡士林乳膏作为对照,连续涂抹9 d。
1.5 小鼠背部造模处皮肤观察为了记录造模期间小鼠造模处皮肤的变化情况,从d 1开始每隔1 d进行拍照观察,PASI评分对小鼠皮损皮肤的鳞屑、红斑及增厚情况进行评分,三项评分之和为总评分。PASI评分标准设以下几个等级:0~4分,依次评定为无症状,轻度,中度,重度,极重度,总分计算方式为3项指标得分之和(0~12分)。将每组的评分结果取平均值作评分变化曲线。
1.6 小鼠皮肤组织病理学观察造模d 9,将小鼠眼球取血后处死。取皮损皮肤以及脾脏,1/4皮损皮肤用4%组织固定液常温保存,其余组织-80 ℃保存备用。从固定液中取出皮肤,将取出的皮肤组织按照以下步骤处理:脱水、浸蜡与包埋、切片、苏木精﹣伊红染色,封片后置于通风橱中通风干燥,后于显微镜下观察,再随机选择3个视野进行拍照,之后用Image J识图软件测量角质层到基底层的垂直距离,以得到表皮厚度。
1.7 Western blot检测增殖、分化蛋白的表达取冻存的皮肤组织,加入现配蛋白裂解液(蛋白裂解液 ∶PMSF ∶磷酸酶抑制=98 ∶1 ∶1)研磨,14 000 r·min-1离心10 min,吸取上层澄清液体,加入上样缓冲液(5×),蛋白变性,随后进行SDS凝胶电泳;转膜;转膜结束后将PVDF膜浸泡于TPBS(含有0.04%吐温)配制的5%的脱脂牛奶中,于37 ℃摇床上封闭2 h;之后孵育一抗,4 ℃结合12 h以上;将相应来源的二抗加入TPBS配制的5%的脱脂牛奶中(二抗与TPBS按照1 ∶40 000比例配制),PBS洗PVDF膜,重复3遍;利用化学发光法显影。
1.8 免疫组化检测小鼠皮肤以及脾脏中CD4、IL-17、IL-4、IFN-γ的表达将石蜡切片脱蜡水化,通透(0.5%Triton),抗原修复液(pH 9.0)冷修复,过氧化物酶阻断,3%BSA封闭30 min后,PBS洗3遍,将一抗滴在组织上,放于4 ℃冰箱孵育。12~24 h后回收一抗,室温复温30 min后,滴加反应增强液室温反应10 min,PBS洗3遍,后滴加二抗,室温放置20 min,使之充分反应,PBS洗3遍,DAB显色剂染色1~2 min,苏木精染核60 s,脱水,封片。待风干后,于显微镜下观察CD4、IL-17、IL-4、IFN-γ的表达情况。
1.9 流式细胞术检测小鼠脾脏中Th1、Th17细胞亚群小鼠眼球取血后处死,取2/3脾脏(其余1/3用作石蜡包埋,待用),包裹在开过高压的200目纱网中,置于含有5 mL小鼠淋巴细胞分离液的无菌皿里,将脾脏浸于其中,利用无菌注射器的尾部进行按压,至研磨充分。随后隔着尼龙网用无菌巴氏吸管吸取淋巴细胞分离液转移至15 mL离心管中,沿着试管壁缓慢加入预冷的RPMI 1640培基,直至总体积达7 mL,于4 ℃,850 g转速条件下离心30 min。吸取淋巴细胞层,按照预先设计好的指标进行分组,除Th17需培养刺激外,其余分组细胞均可进行破膜、固定以及抗体的孵育,随后即可上机检测。
1.10 免疫荧光法检测小鼠皮肤中K10以及Ki67的表达将预先准备好的石蜡切片脱蜡水化,随后用0.5%Triton通透,抗原修复液(pH 9.0)冷修复,PBS洗涤,重复3遍,用3%的BSA封闭1 h后,PBS洗涤,重复3遍,将一抗滴于组织上放于4 ℃冰箱。12~24 h后回收一抗,滴加荧光二抗后放置于37 ℃摇床上,避光结合反应2 h。PBS洗3遍,滴加核酸染料(DAPI)室温条件下孵育5 min,PBS洗3遍。在封片之前加入抗荧光淬灭剂。

2 结果
2.1 性别对IMQ诱导的小鼠银屑病模型建立的影响
2.1.1小鼠皮肤皮损情况 N1、N2组小鼠在皮肤形态观察期间皮肤均呈现细腻光滑的状态,而M1、M2组小鼠分别与N1、N2组相比,使用IMQ的d 1就出现了少量银屑与增厚,M1、M2组小鼠皮肤的明显增厚和鳞屑均开始于d 3,并且红斑所覆面积均有所扩大;d 5~7,鳞屑、增厚与红斑进一步加重,在d 6增厚与红斑达到高峰,M1与M2组小鼠分别在d 8和d 6达到鳞屑高峰期;d 9的皮肤鳞屑覆盖面积,红斑的颜色以及加厚程度均有所减轻,见Fig 1。

Fig 1 Skin morphological changes of mice induced
2.1.2小鼠皮肤PASI评分 根据PASI评分标准,IMQ诱导的M1、M2组小鼠皮损皮肤上的鳞屑,红斑和增厚评分均在d 1~6升高(P<0.01),d 7开始下降(Fig 2A-C)。总分计算公式为:总分=鳞屑评分+增厚评分+红斑评分(Fig 2D),IMQ诱导的M1、M2组小鼠PASI评分总分分别与N1、N2组小鼠总分相比,在d 1~6均升高(P<0.01),而M1和M2组小鼠之间PASI评分总分结果之间的差异无统计学意义,见Fig 2D。

A:scales; B:erythema; C: thickness; D: total scores. N1:female normal group; N2:male normal group; M1:female model group; M2:male model group. **P<0.01 vs female normal group; ##P<0.01 vs male normal group.
2.1.3小鼠皮肤组织病理学改变 利用HE染色法观察小鼠皮损皮肤病理改变,与N1、N2组相比,M1、M2组小鼠颗粒层及棘层增厚明显,且棘突出现明显的不规则延长,同时,角质层还出现了明显的分化不全和过度角化现象(分别用箭头和星号标记),并且真皮层还出现了严重的炎性细胞浸润。M1、M2组小鼠皮损处表皮厚度测量结果分别与N1、N2组小鼠表皮厚度测量结果相比,厚度差异有统计学意义(P<0.01)。而M1、M2组小鼠之间表皮厚度的测量结果差异不存在统计学意义,见Fig 3。
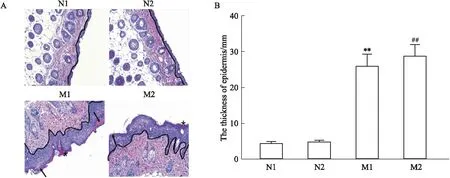
Fig 3 Histopathological changes of mice skin
2.1.4皮损组织中角质细胞增殖蛋白的表达 M1、M2组小鼠皮损皮肤中PCNA蛋白表达水平相对于N1、N2组来说明显增加,且表达水平差异存在统计学意义(P<0.05,P<0.01);而M1、M2组之间的PCNA蛋白水平差异不存在统计学意义,见Fig 4A-B。M1、M2组小鼠皮肤中细胞增殖标记蛋白Ki67表达水平较N1、N2组来说增加,且荧光分布范围更广,表达相对集中于棘层、基底层及以下,见Fig 5A。计算Ki67/DAPI数量后,结果显示,M1、M2组皮肤中Ki67细胞的相对表达数量明显高于N1、N2组,差异存在统计学意义(P<0.01),且此指标在M1、M2组之间的差异不存在统计学意义,见Fig 5C。这些结果提示,M1、M2组小鼠皮损处的角质形成细胞均表现为过度增殖,且M1、M2组之间皮损处的角质形成细胞增殖水平差异不存在统计学意义。
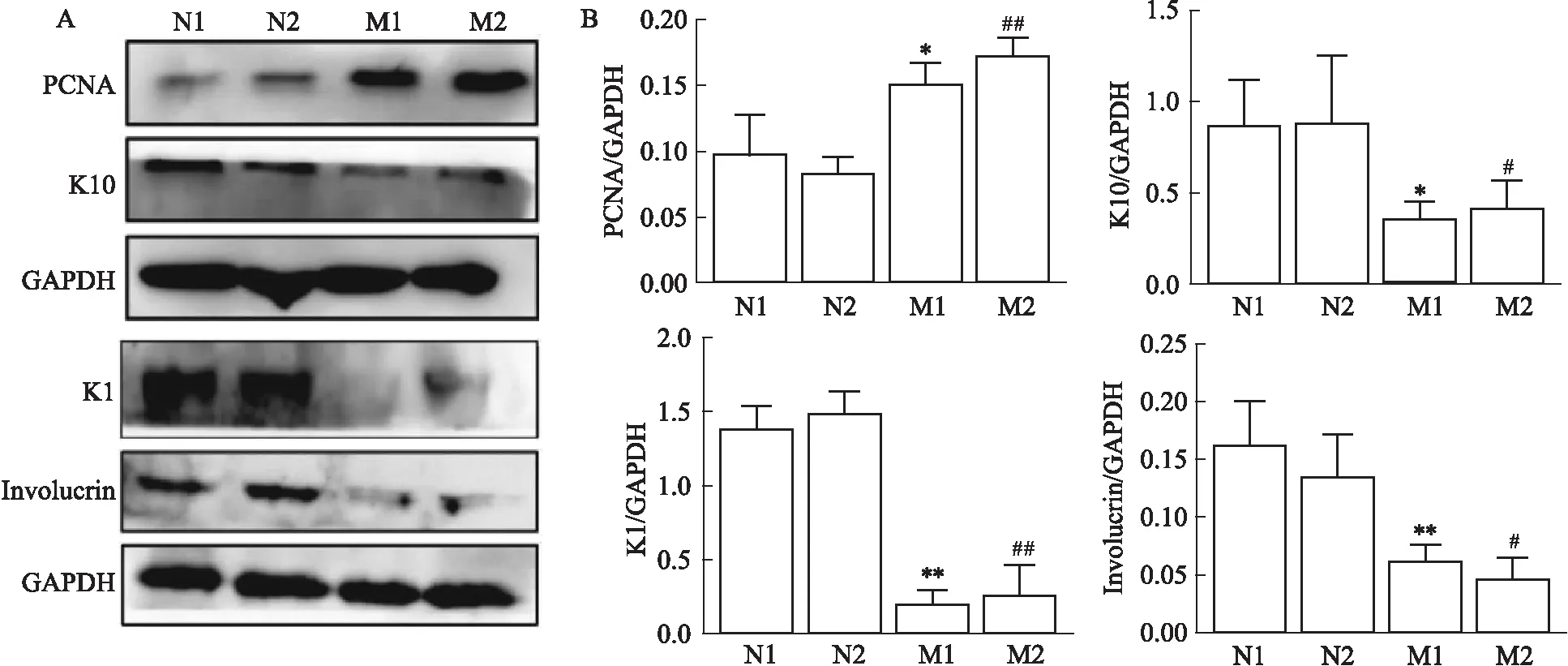
Fig 4 The protein levels of PCNA, K10, K1, and involucrin in skin n=3)
2.1.5皮损组织中角质细胞分化蛋白的表达 相对于N1、N2组来说,K10、K1以及involucrin在M1、M2组小鼠皮肤中的表达均减少(P<0.05,P<0.01),而M1、M2组之间这3个分化蛋白表达水平的差异无统计学意义(P>0.05),见Fig 4A-B。N1、N2组小鼠K10荧光强度均明显高于M1、M2组(P<0.05),且荧光集中在颗粒层及以上部位, 见Fig 5B。这些结果提示,M1、M2组皮损处角质细胞均出现异常分化,且M1、M2之间的差异无统计学意义。

Fig 5 Expression of K10 and Ki67 in skin tissues detected by immunofluorescence assay(×200) n=5)
2.2 性别对IMQ诱导的小鼠银屑病样模型T细胞免疫功能的影响
2.2.1小鼠脾脏指数 分别与N1、N2组小鼠相比,M1、M2组小鼠脾脏体积明显增大,有明显的充血,脾脏指数明显增大,且差异具有统计学意义(P<0.01),并且M1、M2组之间的脾脏指数差异并无统计学意义,见Fig 6。
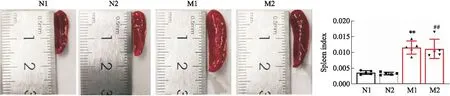
2.2.2皮损组织中CD4、IFN-γ、IL-4、IL-17的表达 M1、M2组分别与N1、N2组相比,模型组小鼠皮肤中CD4、IFN-γ以及IL-17表达水平均明显增加(P<0.05,P<0.01),IL-4明显减少(P<0.01),而M1、M2组之间的差异无统计学意义(P>0.05),见Fig 7。

Fig 7 Expression of CD4, IFN-γ, IL-4, and IL-17 in skin tissues detected by immunohistochemical n=5)
2.2.3脾脏组织中CD4、IFN-γ、IL-4、IL-17的表达M1、M2组分别与N1、N2组相比,M1、M2组小鼠脾脏组织中CD4、IFN-γ以及IL-17均明显增多(P<0.01),IL-4明显减少(P<0.01),而M1、M2组之间差异无统计学意义,见Fig 8。
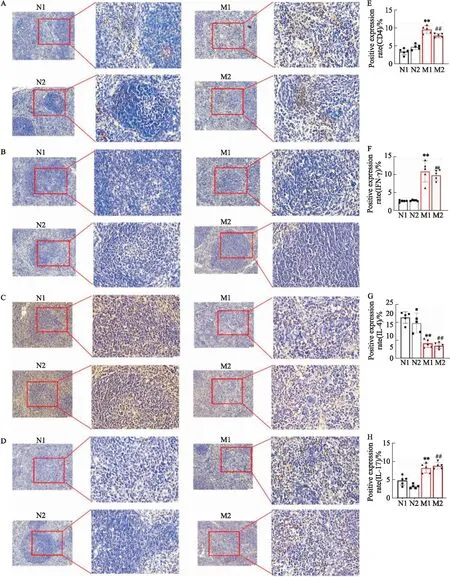
Fig 8 Expression of CD4, IFN-γ, IL-4 and IL-17 in spleen detected by immunohistochemical n=5)
2.2.4脾脏中Th17、Th1细胞亚群比例 M1、M2组小鼠脾脏中Th1和Th17细胞比例明显高于N1、N2组小鼠(P<0.05,P<0.01),M1、M2组小鼠之间差异均无统计学意义,见Fig 9。

Fig 9 Proportion of Th17 and Th1 cells in n=10)
3 讨论
很多自身免疫病如硬皮病、狼疮以及类风湿关节炎等在女性人群中更加具有易感性[3-4]。银屑病作为一种受多种因素相互作用引起的慢性鳞屑性自身免疫病,可以影响各个年龄段的男性和女性[5-6]。
激活的T细胞在选择性凋亡后,会出现银屑病斑块消退的现象,表明T细胞在银屑病进程中可能起着决定性作用[7]。研究表明,将从银屑病患者身上获得的CD4+而非CD8+T细胞注射到人非皮损皮肤中后,将该皮肤移植到免疫缺陷小鼠模型上,会诱发银屑病[8]。T细胞活化与IFN-γ、IL-17A和TNF-α等的分泌有关,这些因子会影响Th1/Th2稳态、Th17/Treg平衡和IL-23/Th17轴来影响银屑病的发生、发展[9]。银屑病皮肤中IL-17的激活和表达增加会致使表皮角质形成细胞过度活化增殖,还会促使炎性细胞及因子被招募到皮肤中,使银屑病加快或持续严重化,干扰T细胞的募集或阻断IL-17A或IL-17受体,可以有效缓解银屑病症状[10-13]。本研究发现,IMQ诱导的银屑病雄性和雌性小鼠脾脏中Th1和Th17细胞比例增加;皮损处有大量CD4+T浸润,且IFN-γ以及IL-17增多;而雌、雄模型组小鼠之间差异均无统计学意义。这些结果提示,IMQ诱导的银屑病小鼠出现皮肤局部以及全身T细胞异常活化;性别对IMQ诱导的银屑病小鼠的皮肤局部以及全身T细胞免疫功能的活化均没有影响。
Ki67为一种核蛋白,活动期(G1、S、G2、M期)表达较多,静止期(G0期)一般不表达或表达较低,PCNA是一种与DNA复制、修复和细胞周期进程有关的代谢蛋白,在细胞复制过程中发挥关键作用[14-16]。K1和K10被认为是终末分化的最早标记物,是分化的角质形成细胞最先表达的蛋白之一。同时,involucrin是交联膜的可溶性蛋白前体,作为一种分化标志物位于棘状细胞的最后一层和颗粒层中[17]。我们的研究进行了PASI评分、病理组织分析以及角质细胞增殖和分化的标志性分子研究,发现就模型的建立来说,IMQ诱导的不同性别的银屑病样小鼠模型中角质细胞的增殖和分化的变化是没有差异的。
综上所述,本研究发现性别对IMQ诱导的银屑病小鼠模型的建立,以及皮肤局部和全身T细胞免疫功能的活化均没有影响,在实验研究中可以单用一个性别的小鼠,也可以雌、雄小鼠兼用。

