氮化硅陶瓷在牙科种植体方向的应用前景
氮化硅是一种非氧化物生物陶瓷修复材料,具有高耐磨性
、断裂韧性、弯曲强度和较稳定的机械性能,同时,氮化硅种植体具有长期稳定的生物安全性。氮化硅自1989 年以来就作为骨科关节植入物开始应用,氮化硅对小鼠成纤维细胞(L929)的生长影响,与医用的钛合金(TiAl
V
)、氧化铝无统计学差异
。对患者应用氮化硅椎间融合体术后30 年的临床评估也证实了这一点
。此外,氮化硅还可抑制革兰阳性菌和革兰阴性菌的黏附和增殖以及体内诱导成骨再生
,降低了细菌的黏附和增殖进而降低了种植体周围炎和种植体脱落失败的机率。具有优秀机械性能和抗细菌粘附能力的氮化硅,具有极为广阔的应用前景。本文旨在综述氮化硅生物陶瓷的抗菌性和成骨性,通过回顾氮化硅作为骨科植入物的相关文献,进一步分析氮化硅是否符合牙科种植体的基本要求,探讨其作为牙科种植体的应用潜力。
1 氮化硅独特的表面特性
影响种植体生物活性的表面特性包括表面形貌、化学成分和生物物理特性(亲水性)。
氮化硅的表面通常显示出由突出的棒状β-氮化硅晶粒(直径1~2 μm)组成的微粗糙表面,其具有六边形横截面,并相互交织形成独特的微米/纳米级形貌。抛光后,氮化硅表面棒状晶粒基本消除,表面光滑,具有微米级/纳米级的气孔。具有微粗糙表面形貌的植入物可以与细胞和组织相互作用,从而对骨整合产生积极的影响
。
应用物理方法计算热力输送系数。Monin-Obukhov基于相似性理论和量纲分析建立了一个含有大气下垫面粗糙度的方程(Monin and Obukhov,1954):
2017年11月,在滴滴成为ofo大股东后被派驻到ofo担任高管的付强等人,全部被戴威“请”走了。一个被媒体反复描述的场景是,戴威冲着电话那头的付强怒吼:“滴滴的人都给我离开ofo!”
在小鼠颅骨缺损内植入氮化硅,周围69%的区域有新骨生成,而作为对照组的聚醚醚酮和钛周围分别仅有24%和36%的区域有新骨生成,说明氮化硅陶瓷种植体相比于传统钛等种植材料具有更好的促进新骨形成能力
。使用山羊模型比较聚醚醚酮与氮化硅生物材料作为椎间融合体的植入结果,发现氮化硅组(52.6%)比聚醚醚酮组(27.9%)在关节融合方面表现更好,说明了氮化硅在成骨性方面的优势
。一项对于氮化硅作为腰椎融合体的大规模临床评估,也充分证实氮化硅优秀的成骨性能
。
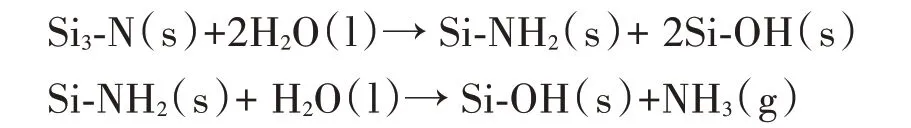
氮化硅表面的微米/纳米级形貌有效减少细菌定植是其主要的抗菌机制之一
。氮化硅表面的Si-O、Si-NH
和Si-NH
等主要官能团为其创造一个亲水表面。而这种亲水的氮化硅表面通过蛋白质吸附和细胞粘附阻碍了细菌生物膜的形成
。在生理pH 的水溶液条件下,氮化硅能将氢原子从Si-OH 基团中解离出来,使其表面带负电荷
。通过静电作用阻碍细菌附着。同时氮化硅表面-NH
基团的反应自发释放的氨增加了介质的pH
,导致建立了不利于细菌粘附的弱碱性环境(pH 值约为8.5)
,也影响了细菌的代谢
。另一方面,释放出的氨(NH
)会形成过氧亚硝酸盐(ONOO-),这会影响细菌的正常新陈代谢,导致它们死亡
。为了阐明氮化硅的抗菌活性的确切机制,还需要进一步的研究。
2 氮化硅具有良好成骨性
由于氮化硅在氧化或含水环境中热力学不稳定,其表面通常覆盖一层厚度约为3~5 nm 的氧化层,由氮氧化硅组成,存在硅氮、硅氮氧和硅氧键
。由于这种氧化,氮化硅的组成从原本的纯硅氮键到氧化层内部区域的硅氧氮,再到表面的硅氧,若是氧化层足够厚,其组成相当于二氧化硅。当暴露于水介质时,Si-N键会反应形成Si-OH和NH
。
3)果园悬挂糖醋液,诱杀苹小食心虫,可减轻其危害。糖醋液配制比例:糖0.5 kg、醋1 kg、水10 kg。
氮化硅材料的优秀成骨性能依赖于以下诸多机制。首先是氮化硅的微粗糙表面以及亲水性,可以增加成骨细胞黏附,这是后期成骨分化、基质矿化和骨再生的基础
。其次,氮化硅表面特有的生化反应提供了硅酸根离子(SiO
)
、氨以及一氧化氮,氮化硅表面硅酸和含氮化合物的释放增强了细胞的代谢、增殖、以及成骨向分化活性。硅酸和含氮化合物可以通过上调骨保护素和骨形态发生蛋白2 的表达来影响成骨细胞的形态发生活性,在强烈刺激成骨细胞分化的同时,它们也抑制破骨细胞的形成
。并且,Si 和N 元素可以刺激骨髓间充质干细胞的成骨向分化,加速骨生长
。同时,(SiO
)
和N 离子在骨磷灰石形成中为成骨细胞的活动提供了有利的化学环境,例如表面电荷对蛋白质折叠
、细胞迁移运动和增殖的促进作用
,以及对相关生物学信号的调控
。还有,硅酸根的析出可营造出弱碱性环境
。弱碱性微环境可对成骨细胞增殖和随后的成骨细胞分化产生积极影响
。在体内这些因素和周围组织和细胞的综合作用有助于氮化硅种植体与周围骨组织的结合。
与氧化锆、聚醚醚酮、钛和钛合金相比,氮化硅可以有效抑制表皮葡萄球菌和大肠杆菌的生长
。与钛和氧化锆相比,氮化硅对牙龈卟啉单胞菌、金黄色葡萄球菌和大肠杆菌的菌落形成均有抑制作用。且氮化硅在活菌/死菌染色中表现出强的红色荧光,说明氮化硅导致了大量的牙龈卟啉单胞菌死亡
,这也验证了之前的研究
。说明氮化硅不仅抑制细菌的黏附,还有一定的抗菌性能。
3 氮化硅具有抗菌活性
然后,KF利用对当前时刻系统状态的观测值来更新在上一阶段的预测值,从而获得一个平均误差更小的估计值,测量更新过程如下:
由此可见,在恒定pH 值(7.4)的水介质中,氮化硅表面的主要官能团为Si-O、Si-NH
和Si-NH
。这些亲水性基团使氮化硅表面表现出良好的润湿性
,有利于成骨细胞的黏附,促进早期成骨
。
4 氮化硅具有阻射性
氮化硅具有部分阻射性
。通过影像学检查清楚地看到种植体与周围骨组织的结合情况
,而且不会像钛种植体一样在牙科锥体束CT 扫描中出现放射伪影的问题。并且,氮化硅陶瓷种植体的射线密度与牙釉质相当。因此,可以准确评价氮化硅种植体与周围组织,特别是骨组织接触的密合性。
5 小 结
目前,氮化硅材料应用于牙科种植体还存在以下问题:①氮化硅材料的传统加工方法成本高,由于氮化硅具有很高的硬度,传统的氮化硅植入物通常需要制造后经金刚石加工和抛光才能生产出所需的形状、尺寸和结构,所需成本可能较高;②关于氮化硅生物活性的临床研究尚不充分,氮化硅的抗菌性能,虽然已在动物实验中得到证明,但还缺乏进一步的临床研究来评估;③关于氮化硅材料口腔致病菌抗菌性研究不足,已有研究表明氮化硅对于牙龈卟啉单胞菌等细菌具有抗菌性,但当其作为牙科种植体时,它还可能会面对伴放线放线杆菌、中间普氏菌等口腔细菌的侵袭,目前相关研究尚存空白,难以针对临床问题形成较好的指导意见;④氮化硅目前的动物实验研究主要集中在长骨、颅骨等,对于颌骨植入氮化硅后的成骨活性和抗菌性能方面研究还不充分。
针对以上问题,在今后的研究中需要:①引进新的成型工艺,降低生产成本;3D 陶瓷打印技术
在生产具有所需的解剖形状、精确的尺寸和良好控制的微结构的氮化硅方面具有更高的成本效益,可以实现个性化高、性能高效、低成本的定制牙科种植体;②加强对氮化硅生物活性的临床研究,加深对不同烧结助剂、烧结工艺制备的氮化硅生物陶瓷成骨性、抗菌性等性能进行的评价性研究,推进氮化硅动物实验和临床实验,研究氮化硅材料与生物组织之间的相互作用;③明确氮化硅抗菌机制,继续研究氮化硅对不同口内优势致病菌的抑制作用;④开展专项课题,集中研究氮化硅材料植入颌骨后的成骨活性和抗菌性能。
【Author contributions】 Zou RF collected the references and wrote the article. Lai X revised the article. Deng B guided the writing of the article. All authors read and approved the final manuscript as submitted.
[1]Das M,Bhimani K,Balla VK.
tribological and biocompatibility evaluation of sintered silicon nitride[J]. Mater Lett, 2018,212:130-133.doi:10.1016/j.matlet.2017.10.061.
[2]Neumann A, Reske T, Held M, et al. Comparative investigation of the biocompatibility of various silicon nitride ceramic qualities
[J]. J Mater Sci Mater Med, 2004, 15(10): 1135-1140. doi:10.1023/B:JMSM.0000046396.14073.92.
[3]Mobbs RJ, Rao PJ, Phan K, et al. Anterior lumbar interbody fusion using reaction bonded silicon nitride implants:long-term case series of the first synthetic anterior lumbar interbody fusion spacer implanted in humans[J]. World Neurosurg, 2018, 120: 256-264.doi:10.1016/j.wneu.2018.08.237.
[4]Dai Y, Guo H, Chu L, et al. Promoting osteoblasts responses
and improving osteointegration
through bioactive coating of nanosilicon nitride on polyetheretherketone[J]. J Orthop Translat,2020,24:198-208.doi:10.1016/j.jot.2019.10.011.
[5]Boschetto F, Adachi T, Horiguchi S, et al. In situ molecular vibration insights into the antibacterial behavior of silicon nitride bioceramic
gram-negative
[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2019, 223: 117299. doi: 10.1016/j.saa.2019.117299.
[6]Hu X, Mei S, Wang F, et al. A microporous surface containing Si(3)N(4)/Ta microparticles of PEKK exhibits both antibacterial and osteogenic activity for inducing cellular response and improving osseointegration[J]. Bioact Mater, 2021, 6(10): 3136-3149. doi:10.1016/j.bioactmat.2021.02.027.
[7]Pezzotti G. Silicon nitride: a bioceramic with a gift[J]. ACS Appl Mater Interfaces, 2019, 11(30): 26619-26636. doi: 10.1021/acsami.9b07997.
[8]Bock RM,Jones EN,Ray DA,et al.Bacteriostatic behavior of surface modulated silicon nitride in comparison to polyetheretherketone and titanium[J]. J Biomed Mater Res A, 2017, 105(5): 1521-1534.doi:10.1002/jbm.a.35987.
[9]Ge J, Wang F, Xu Z, et al. Influences of niobium pentoxide on roughness, hydrophilicity, surface energy and protein absorption,and cellular responses to PEEK based composites for orthopedic applications[J]. J Mater Chem B, 2020, 8(13): 2618-2626. doi:10.1039/c9tb02456e.
[10] Webster TJ,Patel A,Rahaman MN,et al.Anti-infective and osteointegration properties of silicon nitride, poly(ether ether ketone),and titanium implants[J]. Acta Biomater, 2012, 8(12): 4447-4454.doi:10.1016/j.actbio.2012.07.038.
[11] Kersten R, Wu G, Pouran B, et al. Comparison of polyetheretherketone
silicon nitride intervertebral spinal spacers in a caprine model[J]. J Biomed Mater Res B Appl Biomater, 2019, 107(3):688-699.
[12] Calvert GC, Vanburen H 3rd, Rambo WJ, et al. Clinical outcomes for lumbar fusion using silicon nitride
other biomaterials[J].J Spine Surg,2020,6(1):33-48.doi:10.21037/jss.2019.12.11.
[13] Beck GR Jr, Ha SW, Camalier CE, et al. Bioactive silica-based nanoparticles stimulate bone-forming osteoblasts, suppress boneresorbing osteoclasts, and enhance bone mineral density
[J].Nanomedicine, 2012, 8(6): 793-803. doi: 10.1016/j.nano, 2011, 8(6):793-803.
[14] Pezzotti G, Marin E, Adachi T, et al. Incorporating Si3N4 into PEEK to produce antibacterial, osteocondutive, and radiolucent spinal implants[J]. Macromol Biosci, 2018, 18(6): 201800033. doi:10.1002/mabi.201800033.
[15] Sainz M,Serena S,Belmonte M,et al.Protein adsorption and i
behavior of additively manufactured 3D-silicon nitride scaffolds intended for bone tissue engineering[J].Mater Sci Eng C Mater Biol Appl, 2020, 115: 110734. doi: 10.1016/j.msec.2020.110734.
[16] Rautray TR, Narayanan R, Kim KH. Ion implantation of titanium based biomaterials[J]. Prog Mater Sci, 2011, 56(8): 1137-1177.doi:10.1016/j.pmatsci,2011,56(8):1137-1177.
[17] Boyan BD,Lossdörfer S,Wang L,et al.Osteoblasts generate an osteogenic microenvironment when grown on surfaces with rough microtopographies[J].Eur Cell Mater,2003,6:22-27.doi:10.22203/ecm.v006a03.
[18] Xu Z, Wu H, Wang F, et al. A hierarchical nanostructural coating of amorphous silicon nitride on polyetheretherketone with antibacterial activity and promoting responses of rBMSCs for orthopedic applications[J]. J Mater Chem B, 2019, 7(39): 6035-6047. doi:10.1039/c9tb01565e.
[19] Pezzotti G, Adachi T, Boschetto F, et al. Off-stoichiometric reactions at the cell-substrate biomolecular interface of biomaterials:in situ and ex situ monitoring of cell proliferation, differentiation,and bone tissue formation[J]. Int J Mol Sci, 2019, 20(17): 4080.doi:10.3390/ijms20174080.
[20] Pezzotti G, Bock RM, Mcentire BJ, et al. Silicon nitride bioceramics induce chemically driven lysis in porphyromonas gingivalis[J].Langmuir, 2016, 32(12): 3024 - 3035. doi: 10.1021/acs.langmuir.6b00393.
[21] Zanocco M, Boschetto F, Zhu W, et al. 3D-additive deposition of an antibacterial and osteogenic silicon nitride coating on orthopaedic titanium substrate[J]. J Mech Behav Biomed Mater, 2020, 103:103557.doi:10.1016/j.jmbbm.2019.103557.
[22] Ishikawa M,De MK,Mcentire BJ,et al.Surface topography of silicon nitride affects antimicrobial and osseointegrative properties of tibial implants in a murine model[J].J Biomed Mater Res A,2017,105(12):3413-3421.doi:10.1002/jbm.a.36189.
[23] Wu J, Liu YJ, Zhang H, et al. silicon nitride as a potential candidate for dental implants: osteogenic activities and antibacterial properties[J]. J Mater Res, 2021, 36(9): 1866-1882. doi: 10.1557/s43578-021-00249-8.
[24] Rahaman M, Xiao W. Silicon nitride bioceramics in healthcare[J].Int J Appl Ceram Technol, 2017, 15(3): 766-774. doi: 10.1111/ijac.12835.
[25] Liu HW, Wei DX, Deng JZ, et al. Combined antibacterial and osteogenic in situ effects of a bifunctional titanium alloy with nanoscale hydroxyapatite coating[J]. Artif Cells Nanomed Biotechnol, 2018, 46(sup3): S460-S470. doi: 10.1080/21691401.2018.1499662.
[26] Pakharukova N, Tuittila M, Paavilainen S, et al. Structural basis for acinetobacter baumannii biofilm formation[J]. Proc Natl Acad Sci U S A, 2018, 115(21): 5558 - 5563. doi: 10.1073/pnas.1800961115.
[27] Boschetto F, Toyama N, Horiguchi S, et al.
antibacterial activity of oxide and non-oxide bioceramics for arthroplastic devices: II. fourier transform infrared spectroscopy[J]. Analyst, 2018,143(9):2128-2140.doi:10.1039/c8an00234g.

