光活化消毒技术清除小鼠舌部白色念珠菌的实验研究
光活化消毒技术(photoactivated disinfection,PAD)是在有氧的条件下,使用具有特定波长的光激活光敏剂实现杀灭微生物的一项技术。目前有学者开展了光动力疗法(photodynamic therapy,PDT)治疗口腔白色念珠菌病的相关研究,但使用的设备不同、光源不同、光敏剂种类及浓度不同、光照参数也不尽相同,而且大多数研究的孵育时间和光照时间均较长
,很难应用于体内。另外有研究
显示,白色念珠菌与其他细菌(如金黄色葡萄球菌等)相比,其细胞体积大,故更难杀灭。加之体内白色念珠菌感染主要表现为以生物膜形式为主的念珠菌病,生物膜结构复杂,较菌液状态相对更难杀灭。因此,保证较好清除率的同时能够缩短操作时间是PAD 应用于临床治疗急性假膜型念珠菌性口炎的基础。
(2)北海银滩灯塔。正在建设中的银滩灯塔,设计理念采用合浦西汉汉墓群出土的“铜凤灯”为造型,内含海洋文化、历史文化与人文精神、旅游文化元素,独具特色,将打造成北海市地标建筑。
本研究采用PAD
Plus 仪对急性假膜型念珠菌性口炎小鼠模型进行处理,探究PAD 技术清除小鼠舌部白色念珠菌的效果,为该技术应用于临床提供实验依据。
1 材料和方法
1.1 主要仪器和试剂
标准菌株:白色念珠菌SC5314(石家庄和亚生物技术有限公司)。ICR 雄性小鼠,6 周龄,40 只(购自北京华阜康生物有限公司,动物质量合格证号:110322200101896964,统一高压灭菌垫料,统一饲料,自由饮食。实验动物室温度:22 ℃~25 ℃,相对湿度:55%~70%)。本研究已通过河北医科大学口腔医院伦理委员会审批,批准号:[2020]016。
PAD
Plus 仪(DX9001,DENFOTEX,英国)、1 mg/mL 甲苯胺蓝溶液(DENFOTEX,英国)、小型动物麻醉机(R583S,瑞沃德生命科技有限公司,中国)、异氟烷(瑞沃德生命科技有限公司,中国)、念珠菌显色培养基(上海科玛嘉微生物科技有限公司,中国)。
第三,质量安全水平对婴幼儿配方乳粉的进口量有显著影响,且进口产品的抽检合格率对婴幼儿配方乳粉的进口量有正向影响,国产产品的抽检合格率对进口量有负向影响。从变量系数来看,与进口产品抽检合格率的正向拉动作用相比,国产产品检合格率对婴幼儿配方乳粉进口贸易的负向推动作用更强。
1.2 急性假膜型念珠菌性口炎小鼠模型建立
1.2.1 菌液制备 接种前3 天,将白色念珠菌标准菌株SC5314 接种到科玛嘉念珠菌显色培养基中,在35 ℃恒温培养箱内培养24 h,此为F1,转种,35 ℃继续培养24 h 得到F2,将其制备成浓度为1 × 10
CFU/mL 的白色念珠菌菌悬液备用。接种前1 天,40 只小鼠肌肉注射醋酸泼尼松龙,注射剂量为100 mg/kg,促使小鼠产生免疫抑制。给予小鼠含0.83 mg/mL 盐酸四环素的饮水,直至实验结束。实验期间小鼠自由进食和饮水。
课程教学改革主要涉及教学目标、教学内容、教学组织和教学评价4大板块,结合PBL教学法基本原理,以制药工程专业文献检索课程为例,笔者做出如下方案(表1)。
接种后第3 天,采用随机数字表法从模型小鼠中挑选30 只小鼠并随机分为2 组,对照组和PAD 处理组(以下称光活化组),各15 只。肌肉注射醋酸泼尼松龙,注射剂量为100 mg/kg。采用异氟烷吸入麻醉对30 只实验小鼠实施麻醉并维持麻醉状态。
1.2.3 模型评估 通过观察小鼠临床表现,舌背黏膜有无红斑或白色伪膜样损害,舌背真菌载量测定,肝、肾组织及结肠粪便载量测定、组织病理学检查对模型进行评估。
1.3 分组处理
1.2.2 接种 接种当天,使用0.6%的戊巴比妥钠(剂量:0.01 mL/g)对小鼠实施麻醉。麻醉后牵出小鼠舌体,用已在1 × 10
CFU/mL 的白色念珠菌菌液中浸泡1 min 的棉签反复涂擦小鼠舌背部30 s,保持小鼠舌体于口腔外,静置60~75 min。接种后第3 天观察小鼠状态并评估模型。
处理后48 h,分别观察对照组、光活化组小鼠状态,行临床检查、真菌载量测定及舌背组织病理学检查。
1.4 观察及处死动物
对照组:不给予任何处理,行舌背真菌载量测定;光活化组:在小鼠舌背部涂抹1 mg/mL 的甲苯胺蓝溶液,参考产品说明书中该技术运用于根管消毒和牙周袋消毒的参数,孵育1 min,750 mW LED 红光照射1 min。光照后即刻行舌背真菌载量测定。
10位在专业技术岗位上工作的毕业生,对就业感受有高度的一致性,可以代表性地反映就业质量和人才培养方面的问题。
1.5 PAD 技术清除急性假膜型念珠菌性口炎小鼠舌部白色念珠菌效果评价
1.5.1 临床表现 观察小鼠的皮毛、行为及黏膜情况及小鼠舌背白色假膜情况。
采用SPSS 21.0 软件进行数据分析,计量资料(小鼠舌背真菌载量转化为Log
CFU/mL 后的值)进行正态性检验,服从正态分布,采用均数±标准差进行描述,用
检验进行比较;不服从正态分布,采用中位数和四分位数进行统计描述,用秩和检验进行分析,设定
<0.05 有统计学意义。
1.5.3 组织病理学检查 切取两组小鼠的舌体组织,4%多聚甲醛固定后石蜡包埋,标准化纵向切片。经HE 染色及PAS 染色后显微镜下放大200 倍和400 倍观察拍照。
1.6 统计学分析
1.5.2 舌背真菌载量测定 无菌棉签涂擦小鼠舌背1 min,棉签棉絮部分即刻置于盛有1 mL 生理盐水的离心管中,旋涡振荡器振荡1 min,然后生理盐水连续10 倍比稀释,分别得到10~10
倍的稀释液,每个稀释液取10 μL 涂科玛嘉念珠菌显色培养皿,每个浓度分三个平行板,35 ℃培养48 h,计数培养基上生长的菌落CFU,单位为CFU/mL。
目前,在国内建筑市场中,基本形成了以监理制为监督管理体系来控制工程质量,以工程承包企业的自身技术力量,按照质量保证体系来自控工程质量,但事实却不尽如人意,工程质量问题和工程事故仍频频出现,针对这种状况,建设单位为了自己切身利益,就不能任其状况持续发展,而应积极主动地参与到建筑工程的质量管理上来,力促监理和施工企业严把工程质量关,尽量减少和消除工程建设过程中出现的质量问题。下面就此归纳几个质量管理方法,以供探讨。
2 结 果
2.1 临床表现
与正常小鼠相比,本实验模型小鼠一般状态尚可,但出现毛松、行动迟缓、蜷缩及眼睑闭合等情况,舌背出现不同程度红斑或白色伪膜,舌背[(4.77 ± 0.35)Log
CFU/mL]及结肠粪便中(7.17 ×10
CFU/mL)均检测出大量白色念珠菌,但肝肾组织中未检测出白色念珠菌,舌背组织切片可见大量白色念珠菌菌丝,急性假膜型念珠菌性口炎小鼠模型建立成功。
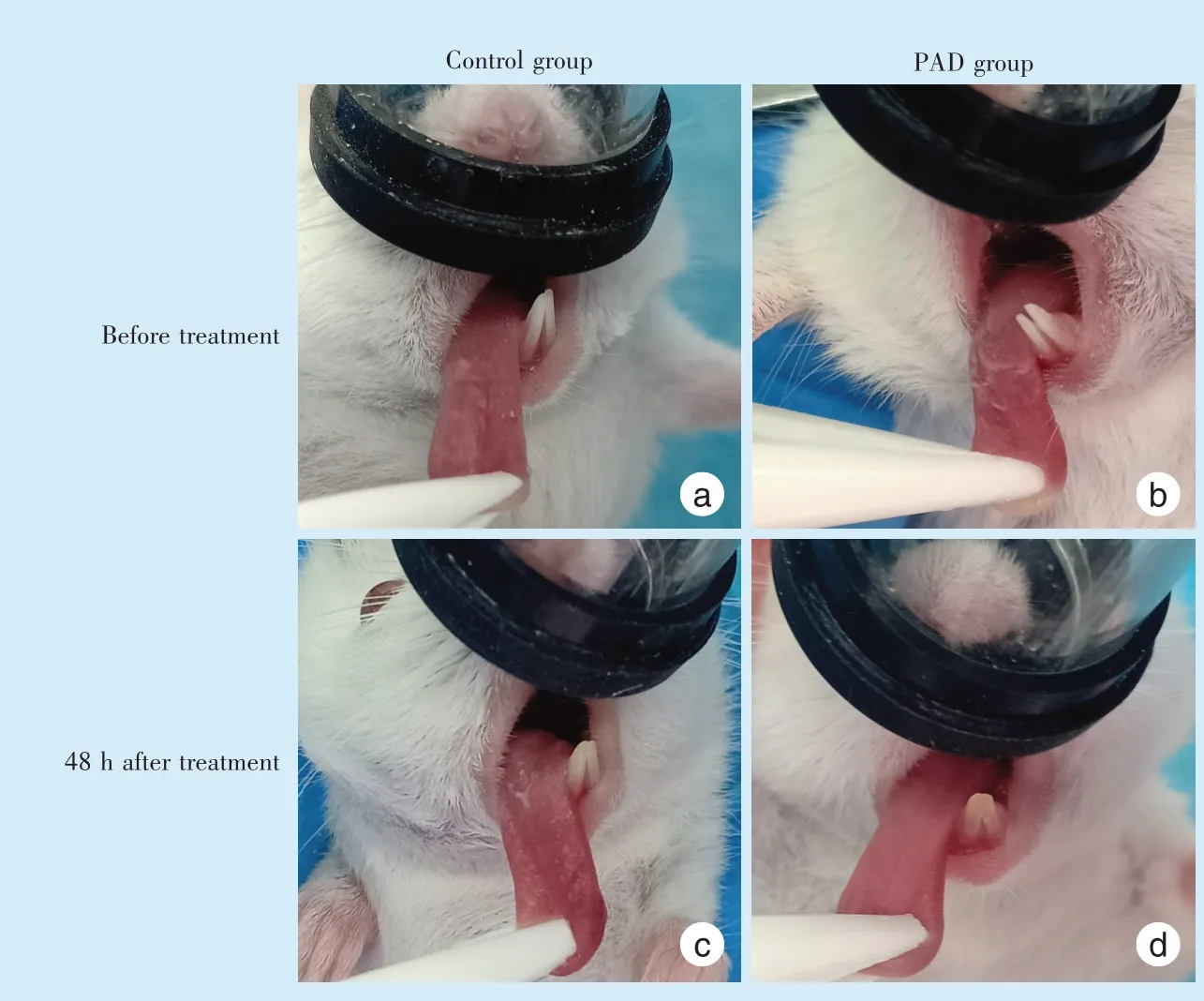
处理后48 h,对照组小鼠仍然保持松毛、行动迟缓、蜷缩及眼睑闭合等情况,小鼠舌背假膜明显,光活化组小鼠较对照组小鼠毛顺滑、有光泽,行动较敏捷,无蜷缩及眼睑闭合等情况,舌背白色假膜明显减少(图1)。
2.2 舌背真菌载量
处理后即刻,光活化组小鼠舌背真菌载量明显低于对照组,差异具有统计学意义(
<0.001)。处理后48 h,光活化组小鼠舌背真菌载量仍然显著低于对照组(
<0.001)(表1)。
对照组小鼠处理后48 h 与处理后即刻的舌背真菌载量差异无统计学意义(
>0.05),光活化组小鼠处理后48 h 舌背真菌载量高于处理后即刻舌背载量,差异具有统计学意义(
<0.05)(表1)。
由此可见,隐喻翻译主要是依靠经验和思维进行对等认知映射,但同时又有许多制约条件。在进行隐喻翻译的过程中,译者身兼两种文化的连接桥梁,既要考虑到源语作者的体验和思维,还要考虑译语读者的思维和体验,译者对隐喻的成功翻译就是让源语作者和译语读者的认知相协调,找到一个平衡点。这时,源语作者与译语读者之间是否有相同经历体验和思维认知模式就成为十分关键的因素。下面从两个方面来论述。

2.3 舌背组织病理学观察
处理后48 h 镜下观察小鼠舌体组织纵向切片。经HE 染色,对照组可见上皮组织不同程度增厚且上皮钉突不规则,上皮浅层可见中性粒细胞浸润,个别位置微小脓肿形成。光活化组较对照组上皮结构规则,未见明显微小脓肿。经PAS 染色,对照组可见大量菌丝,长杆形或串珠状菌丝侵入上皮浅表,光活化组菌丝数量明显少于对照组,偶见菌丝侵入角化层,但未深入上皮层(图2)。
(六)适时补料 母猪的泌乳量于分娩后逐渐增加,至21 d左右达到泌乳高峰,后逐渐下降,哺乳仔猪生长迅速,对营养物质的需求与日俱增,母猪的奶水已不能满足需要,对哺乳仔猪必须进行补料,提前补料具有促生长的作用。仔猪由于牙床发痒而啃咬硬物或拱掘地面,常引起下痢,提前补料有益于保健。仔猪开食早,哺乳期间日采食饲料量高,增重亦快,据报道,7日龄训练仔猪吃料,30日龄日采食量为0.24 kg,14日龄训练吃料,30日龄日采食量为0.18 kg;7日龄训练吃料,60日龄个体重15.0 kg,20日龄训练吃料,60日龄个体重13.5 kg,30日龄训练吃料,60日龄个体重10.0 kg。

3 讨 论
念珠菌(
)是一种常见共生菌,口腔微生物中占比高达75%,其中白色念珠菌(
)是最常见、毒力最强的念珠菌
。念珠菌常寄生于人体皮肤、口腔和阴道等处,具有条件致病性。健康人可带有念珠菌但不发病,当机体免疫功能低下或微生态环境失调时,非致病性念珠菌可转化为致病性念珠菌,并引起局部组织念珠菌病、系统感染,更有甚者危及生命
。
口腔念珠菌病是一种以白色念珠菌为主导致的口腔黏膜浅层感染性疾病,可发生于任何年龄,常见于长期使用激素
、HIV 感染者和免疫缺陷患者等。近年来,由于广谱抗生素及免疫抑制剂应用增多、糖尿病
及免疫功能缺陷症患者增加等原因,导致口腔白色念珠菌病的发病率逐年增高
。国内外已有研究对口腔念珠菌病,尤其是急性假膜型念珠菌性口炎模型进行探索,虽然方法略有差异,但都成功建立了小鼠模型,许多研究者借鉴此种模型评价抗真菌药物或抗真菌光动力疗法的疗效
。本研究基于以往的研究方法,成功建立了舌部急性假膜型念珠菌性口炎模型,小鼠未发生系统感染。
目前,临床治疗口腔念珠菌病多采用局部或全身使用抗真菌药物(如唑类药物、制霉菌素等),但是随着抗真菌药物应用日益增加,念珠菌的耐药性也逐渐显现,并且限制了对该疾病的治疗效果
。这无疑给口腔念珠菌病的治疗带来了新的挑战。探索一种有效且不会产生耐药性,即使对耐药的白色念珠菌引起的反复感染也具有疗效的临床治疗方法显得尤为迫切。
PAD 技术是在有氧条件下,向组织或活细胞外加入光敏剂,使光敏剂与靶细胞的细胞膜或细胞壁选择性结合,光敏剂通过特定波长的光激发产生高活性氧簇(reactive oxygen species,ROS)来攻击靶细胞,灭活这些组织细胞或微生物,从而达到治疗目的的方法
。自1984 年Bertoloni 等发现可用PAD 杀灭细菌以来,PAD 的优势逐渐显现。目前,PAD 在抗微生物方面的应用成为国内外的研究热点,尤其是在局部抗感染方面日益显示出其优势,同时在口腔临床辅助诊疗中PAD 也获得肯定的疗效。
由于该技术不易使微生物产生耐药性,越来越多的学者开始关注PAD 在口腔黏膜病治疗尤其是口腔念珠菌病治疗方面的效果。但既往的PDT治疗口腔念珠菌病研究中,光敏剂孵育时间和光照时间较长。如:血卟啉衍生物需要孵育30 min光照20 min
,二氢卟吩e6 需要孵育20 min 光照14 min
,这对该技术应用于口腔临床诊疗造成一定难度。
体外研究发现甲苯胺蓝O(toluidine blue O,TBO)介导的抗菌光动力化疗可以达到抑制白色念珠菌生物膜形成、降低生物膜活性的效果,提高光敏剂浓度会增强对白色念珠菌的抑制作用
,也有学者提出高浓度TBO 介导的PAD 无需保持长时间的孵育即可对病灶产生杀灭效果
。体内研究证明甲苯胺蓝仅分布于感染的炎症组织,不能穿透正常组织,延长渗透时间仍无明显变化,正常组织不受PAD 的杀伤。甲苯胺蓝介导的光动力治疗不仅能有效杀灭致病菌,且对正常组织毒副作用小,针对口腔相关感染的治疗安全、有效
。
本研究采用的仪器为PAD
Plus 仪,该仪器输出功率有500 mW 和750 mW 两档,为LED 光源,能发出635 nm 波长红光,光敏剂是成品的甲苯胺蓝溶液,浓度固定为1 mg/mL,无需自配,操作简便。635 nm 的红光与甲苯胺蓝高度匹配。相较PAD 治疗口腔念珠菌病的以往研究,本研究采用的甲苯胺蓝浓度更高,光照功率更大,理论上孵育时间和光照时间更短。鉴于该PAD 技术在龋病窝洞消毒时孵育60 s,500 mW 光照60 s;在根管消毒时孵育60 s,750 mW 光照120 s;在牙周袋消毒时孵育60 s,750 mW 光照60 s,因此本研究初步尝试采用孵育1 min,750 mW 光照1 min 的参数。本研究结果显示,PAD 处理后即刻,光活化组的舌背真菌载量明显低于对照组。PAD 处理后48 h,光活化组的舌背真菌载量仍低于对照组。PAD 处理后48 h 与即刻相比,光活化组小鼠舌背真菌载量虽然有所升高但仍低于对照组;而且舌部组织病理学显示处理48 h 后光活化组较对照组上皮钉突排列整齐,中性粒细胞较少,未见到明显的微小脓肿,菌丝明显减少,偶见菌丝侵入角化层,但未深入上皮层。说明白色念珠菌虽然载量有所回升但真菌可能主要处于定植而非感染状态,真菌可能多为孢子相,有待进一步证实。相较于既往研究,本方法处理时间短,在临床操作中会有更高的便捷性和实用性。
虽然本研究采用的方法对小鼠舌背白色念珠菌清除效果较明显,但并未完全清除,这可能与白色念珠菌生物膜较菌液状态更难杀灭有关
。白色念珠菌具有强大的应激反应系统,能提高其生存能力及毒力水平,帮助其适应各种环境变化,从而逃避宿主的免疫压力
。也有可能与真核物种(白色念珠菌)与原核细菌(金黄色葡萄球菌、表皮葡萄球菌、化脓性链球菌等)对光动力抗菌的敏感性不同有关,真核生物的敏感性相对较低
。结合靶点理论分析,白色念珠菌体积大,约是一般细菌体积的25~50 倍
,每个细胞可能含有更多的靶标。光动力杀伤细菌是一种单次攻击过程,而杀灭白色念珠菌可能需要多次攻击效果会更好,因此在进一步的研究中可以尝试设定多次处理模式,同时通过改善机体的低免疫状态从而降低复发风险。当然,本研究也存在一些局限性,鉴于基于PAD
Plus 的PAD 技术尚无应用于体内抗白色念珠菌的相关研究,本实验暂只设置了阴性对照组,初步探索该技术在体内清除白色念珠菌的有效性,后续研究将进一步开展与相关药物疗效对比研究。
铬是人体的微量营养元素,但铬的缺乏或过量都将对人体和动物产生严重危害。土壤为铬污染物的主要富集体,当铬含量超过一定的限度及土壤的容量,就会影响土壤微生物的活动和土壤酶活性,对动物产生危害[19]。
【Author contributions】 Gu Y,Liu N performed the experiments and wrote the article. Wang JN,Zhang LF directed the data collection and analysis. Liu Q designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
[1]De Oliveira MG, Cláudia PA, Nordi DL, et al. Susceptibility of
to photodynamic therapy in a murine model of oral candidosis[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2010,109(3):392-401.doi:10.1016/j.tripleo.2009.10.006.
[2]Carmello JC,Dovigo LN,Mima EG,et al.
evaluation of photodynamic inactivation using Photodithazine
against
[J]. Photochem Photobiol Sci, 2015, 14(7): 1319-1328. doi:10.1039/c4pp00368c.
[3]Carmello JC, Alves F, Basso FG, et al. Treatment of oral candidiasis using photodithazine
- mediated photodynamic therapy
[J]. PLoS One, 2016, 11(6): e0156947. doi: 10.1371/journal.pone.0156947.
[4]Lin CH,Chien HF,Lin MH,et al.Chitosan inhibits the rehabilitation of damaged microbes induced by photodynamic inactivation[J].Int J Mol Sci,2018,19(9):2598.doi:10.3390/ijms19092598.
[5]时洋洋, 周学东, 程磊, 等. 白色念珠菌感染与口腔癌的关系[J]. 口腔疾病防治, 2021, 29(2): 119-123. doi: 10.12016/j.issn.2096-1456.2021.02.009.Shi YY,Zhou XD,Cheng L,et al.The relationship between
infection and oral cancer[J].J Prev Treat Stomatol Dis,2021, 29(2): 119-123. doi: 10.12016/j.issn.2096-1456.2021.02.009.
[6]Sadeghi G, Mousavi SF, Ebrahimi-Rad M, et al.
and
pathogenesis and virulence factors of
Strains isolated from Cutaneous
[J]. Iran Biomed J, 2020, 24(5):324-332.doi:10.29252/ibj.24.5.319.
[7]Kawashita Y, Funahara M, Yoshimatsu M, et al. A retrospective study of factors associated with the development of oral candidiasis in patients receiving radiotherapy for head and neck cancer: is topical steroid therapy a risk factor for oral candidiasis?[J]. Medicine(Baltimore),2018,97(44):e13073.doi:10.1097/MD.0000000 000013073.
[8]Jhugroo C, Divakar DD, Jhugroo P, et al. Characterization of oral mucosa lesions and prevalence of yeasts in diabetic patients: a comparative study[J]. Microb Pathog, 2019, 126: 363-367. doi:10.1016/j.micpath.2018.11.028.
[9]Talapko J, Juzbašic M, Matijevic T, et al.
--the virulence factors and clinical manifestations of infection[J]. J Fungi(Basel),2021,7(2):79.doi:10.3390/jof7020079.
[10] Jiang L, Zheng L, Sun K, et al.
and
evaluation of the antifungal activity of fluoxetine combined with antifungals against
biofilms and oral candidiasis[J]. Biofouling,2020,36(5):537-548.doi:10.1080/08927014.2020.1777401.
[11] Carmello JC,Alves F,Basso FG,et al.Antimicrobial photodynamic therapy reduces adhesion capacity and biofilm formation of
from induced oral candidiasis in mice[J]. Photodiagnosis Photodyn Ther, 2019, 27: 402-407. doi: 10.1016/j.pdpdt.2019.06.010.
[12] Morio F, Jensen RH, Le Pape P, et al. Molecular basis of antifungal drug resistance in yeasts[J]. Int J Antimicrob Agents, 2017, 50(5):599-606.doi:10.1016/j.ijantimicag.2017.05.012.
[13] Dubey AK,Singla RK.Current trends in
-
drug development[J]. Curr Top Med Chem, 2019, 19(28): 2525-2526. doi:10.2174/156802661928191206162925.
[14] Hu X, Huang YY, Wang Y, et al. Antimicrobial photodynamic therapy to control clinically relevant biofilm infections[J]. Front Microbiol,2018,9:1299.doi:10.3389/fmicb.2018.01299.
[15] Pinto AP,Rosseti IB,Carvalho ML,et al.Photodynamic antimicrobial chemotherapy (PACT),using toluidine blue O inhibits the viability of biofilm produced by
at different stages of development[J]. Photodiagnosis Photodyn Ther, 2018, 21: 182-189.doi:10.1016/j.pdpdt.2017.12.001.
[16] Lin J, Bi LJ, Zhang ZG, et al. Toluidine blue-mediated photodynamic therapy of oral wound infections in rats[J]. Lasers Med Sci,2010,25(2):233-238.doi:10.1007/s10103-009-0700-5.
[17] Wiench R, Skaba D, Matys J, et al. Efficacy of toluidine blue-mediated antimicrobial photodynamic therapy on candida spp. A systematic review[J]. Antibiotics (Basel), 2021, 10(4): 349. doi:10.3390/antibiotics10040349.
[18] Zeina B, Greenman J, Wm P, et al. Killing of cutaneous microbial species by photodynamic therapy[J]. Br J Dermatol, 2001, 144(2):274-278.doi:10.1046/j.1365-2133.2001.04013.x.

