长链非编码RNA DUXAP9 促进头颈鳞癌细胞增殖和转移
头颈鳞癌(head and neck squamous cell carcinoma,HNSCC)是世界第六大恶性肿瘤,2018 年,头颈鳞癌新增89 万病例,死亡造成45 万人死亡
。大多数头颈鳞癌病例发生在口腔、咽和喉的上皮黏膜,严重限制了患者的咀嚼能力、言语、美容甚至危及生命
。头颈鳞癌发病风险因素有很多,包括吸烟、饮酒、咀嚼槟榔、人乳头状瘤病毒(human papillomavirus,HPV)病毒、口腔卫生状况差等
。其他风险因素还包括遗传因素、环境污染、免疫抑制等
。早期头颈鳞癌主要是采取手术或放射治疗,而对于中晚期疾病,临床上建议多学科治疗,不仅是为了提高生存率,也是为了提高患者的生活质量
。尽管如此,肿瘤转移、肿瘤复发和肿瘤耐药仍然是导致头颈鳞癌5 年生存率差(低于60%)的主要原因
。筛选并验证肿瘤转移、复发和耐药相关的靶点,并基于此开发新的治疗策略,对延长晚期头颈鳞癌患者的生存时间有重要意义。
研究发现,非编码RNA(non-coding RNA)调控肿瘤的发生和进展,部分非编码RNA 与肿瘤的转移、局部复发和临床预后密切相关
。长链非编码RNA(long non-coding RNA,LncRNA)作为非编码RNA 的一种,参与细胞生理病理的过程
,在包括肿瘤在内的疾病发生、发展中起着重要作用
。因此,阐明LncRNA 生物学功能,有助于进一步揭示口腔鳞癌分子发病机制,为口腔鳞癌早期诊断、预后判断以及治疗提供有效靶点。DUXAP9 是一种新发现的假基因来源的lncRNA
,属于DUXA同源盒基因家族。同源盒基因编码DNA 结合蛋白,其中许多蛋白被认为与早期胚胎发育有关
。同源盒基因编码60~63 个氨基酸的DNA结合结构域,称为同源结构域
。早期研究表明,DUXAP9 在肝细胞癌中异常高表达,其表达水平与患者的预后不良密切相关
。此外,研究还发现DUXAP9 能促进肾癌细胞的生长和增殖
。目前DUXAP9 在头颈鳞癌中功能和作用机制尚不清楚。本研究旨在探讨DUXAP9 在头颈鳞癌组织和细胞中的表达,评估DUXAP9 对头颈鳞癌细胞增殖、迁移和裸鼠皮下成瘤能力的影响,进一步探讨DUXAP9 可能的分子作用机制。
1 材料和方法
1.1 组织标本、动物、细胞及试剂
30 例新鲜头颈鳞癌及癌旁正常组织样本,均取自上海交通大学医学院附属第九人民医院口腔颌面头颈肿瘤科住院患者。本研究获得上海交通大学医学院附属第九人民医院伦理委员会的批准(沪九院科伦审:[2016]144 号),所有参与者在入组前均签署知情同意书,并对应有完整的病理和临床资料。所使用的人源头颈鳞癌细胞系,包括WSU-HN4、WSU-HN6 和WSU-HN30(以下分别称为HN4、HN6 和HN30)均来自于美国国立卫生研究院,由美国马里兰大学牙学院友情馈赠;人源HNSCC 细胞系CAL27 购买于美国典型培养物保藏中心(American type culture collection,ATCC);人正常鳞状上皮(normal oral keratinocytes,NOK)细胞取自临床拔牙后患者的正常牙龈黏膜组织进行原代培养。SPF 级裸鼠(7 周)购自上海交通大学医学院实验动物科学部。
(7)土体孔压消散主要为水平向。由本次测试参数可知,老路基由于孔压消散较慢,则固结系数相对较大,渗透系数也较大,说明老路基固结程度较高。
OE Biotech Human WT lncRNA 芯片(Affymetrix公司,美国),Trizol(15596018,Invitrogen 公司,美国),Hiscript QRT supermix for qPCR(+gDNA WIPER)(R123-01,Vazyme 公司,中国),2× SYBR Green qPCR Master Mix 试剂盒(bimake 公司,美国),Lipofectamine 3000 试剂(Invitrogen 公司,美国),DUXAP9 Smart Silencer(SS-DUXAP9)、SS-NC(锐博生物有限公司,中国);GAPDH、DUXAP9、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、Snail、波形蛋白(Vimentin)的实时定量PCR 引物合成(上海生工生物工程有限公司,中国)。
1.2.2 TCGA 数据库中分析DUXAP9 在头颈鳞癌组织中的表达水平及其与临床预后的关系 首先进行泛癌分析,头颈鳞癌患者(502 例,工作流类型:HTseq-FPKM)的基因表达数据及相应的临床信息从TCGA 的头颈鳞癌项目(https://genomecancer.ucsc.edu/)下载。纳入诊断为头颈鳞癌且随访信息完整的患者。之后将level 3 HTseq-FPKM 数据转换为TPM(transcripts per million)格式并进行log2 转化,以进行进一步分析。不可用和未知的临床特征被认为是缺失值。本研究符合TCGA 规定的出版指南。
国家统计局数据显示,截至9月末,石油和化工行业规模以上企业27702家,累计增加值同比增长4.9%,增幅比1~8月加快0.1个百分点,低于同期全国规模工业增加值增幅1.5个百分点。其中,化学工业增加值增长4.0%,比1~8月加快0.2个百分点;石油天然气开采业增长4.1%,加快0.4个百分点;炼油业增幅6.9%,回落0.2个百分点。
兔抗人多克隆E-cadherin 抗体、N-cadherin 抗体、Vimentin 抗体、Snail 抗体(Abclonal,中国),羊抗免lgG 二抗(Abclonal,中国)。LumiQ 通用型ECL 发光液(Sharebio,中国),1 × 无蛋白快速封闭液(雅酶,中国)。含0.02% EDTA 的0.25%胰蛋白酶溶液(Gibco,美国),BCA 蛋白浓度测定试剂盒(碧云天,中国)。CCK-8 试剂(Dojindo,Kumamoto,日本),Transwell 小室(Corning,美国),4%多聚甲醛(Servicebio,中国),0.1%结晶紫染液(Solarbio,中国)。胎牛血清(Fetal bovine serum,FBS)(Gibco 公司,美国),青霉素和链霉素(Gibco 公司,美国)、DMEM 培养基(源培,中国)。CO
恒温培养箱(Thermo Fisher,美国)。微量移液器(Eppendorf,德国),UV/Vis微板分光光度计(Multiskan
Sky Spectrophotometer,Thermo Scientific,美国),酶标仪(Multiskan
Sky High,ThermoFisher,美国),高速离心机(CT15RE,Hitachi,日本),倒置相差显微镜(GFM-600,上海光密仪器有限公司,中国),高速台式离心机(Multifuge X1 X1R,ThermoFisher,美国),罗氏480 荧光定量PCR 仪(Roche,美国),化学发光成像仪(ImageQuant LAS 4000 mini,General Electric Company,美国)。
1.2 方法
1.2.1 头颈鳞癌组织差异表达的lncRNA 的筛选 使用OE Biotech Human WT lncRNA 芯片筛选5 对头颈鳞癌组织及其配对的癌旁正常组织中差异表达的lncRNA。筛选标准为Log2 Fold Change >1.5,且
<0.05,筛选Kaplan Meier 预后分析存在显著直接相关性(HR 大于1.4,且
<0.001)的lncRNA。
本工程建筑平面长宽约为333m×105m,为超长结构,为解决大体积混凝土浇筑易产生的温差、混凝土收缩以及塔楼与裙房的不均匀沉降等问题,将地上各单体进行分缝处理,地下室部分联成一体设置后浇带处理。根据地质报告提供的土质状况,东、西翼塔楼基础采用桩筏,桩基采用直径800mm的泥浆护壁钻孔灌注桩基础;裙房部分采用整体筏板,柱下加下柱墩解决筏板冲切问题。通过上述基础设置,可有效防止整体建筑的不均匀沉降,并控制柱间的沉降差,使之满足相关规范的要求。
统计分析采用R(3.6.3)进行统计分析。采用Kaplan-Meier 方法分析DUXAP9 表达与总生存期(overall survival,OS)相关的临床病理特征。用Wilcoxon 秩和检验比较DUXAP9 在肿瘤组织和正常组织中的表达。将样本分为高表达组和低表达组(中位数DUXAP9 表达水平作为截断值)。接下来,使用SurvivalROC R 软件包绘制ROC 曲线,测试DUXAP9 作为诊断标志物的性能。使用ggplot2 R包用于DUXAP9 和Snail 的表达相关性分析和可视化。
由于滑坡深部位移监测难度较大、精度较低及地表GPS监测技术的成熟,且考虑到地表监测点和滑带岩土体位移时序具有基本相同的规律特征,研究人员主要基于地表GPS位移监测信息进行滑坡位移预测及灾害预报[1-3]。目前,已有众多的滑坡位移预测模型被提出,极大了推动了滑坡位移预测及灾害预测预警研究。这些位移预测方法主要可分为4类:
护理后,观察组焦虑、抑郁情绪改善较对照组明显,评分均较对照组低,两组差异有统计学意义(P<0.05),见表1:

“是这样。昨天我和静秋,都喝得有点多。饭后本想打个车送静秋回家,可是等了很久,也没有出租车。陪她走了一会儿,雨又下起来,越下越大。那时我们正好走到山水大酒店,就进去避了一会儿雨。雨总是不停,静秋喝得太多,吐了一地,又睡着了,我和服务生都喊不醒她。没办法只好开了个房间,让她在那里休息一会儿。把她安顿好,我马不停蹄……”
1.2.5 qRT-PCR 检测转染SS-DUXAP9 的CAL27 和HN6 细胞中DUXAP9 相对表达量 对CAL27 细胞和HN6 细胞转染SS-NC(乱序siRNA 和ASO 对照)或SS-DUXAP9,24 h 后提取总RNA 后进行qRTPCR 实验检测DUXAP9 的表达,用GAPDH 基因作为对比的内参基因。
使用R(3.6.3)进行统计学分析。TCGA 数据库相关统计学分析见1.2.2。采用单因素方差分析或Student
检验分析各组间差异的显著性。
<0.05为差异有统计学意义。
1.2.3 qRT-PCR 检测头颈鳞癌组织样本和细胞系中DUXAP9 表达 根据Trizol 操作说明书对20 例组织样本的匀浆和HN4、HN6、HN30、CAL27、NOK细胞分别进行总RNA 抽提;根据Hiscript QRT supermix for qPCR(+gDNA WIPER)操作说明书进行RNA 逆转录获得cDNA。2 × SYBR Green qPCR Master Mix 试剂盒进行qRT-PCR 检测及数据分析。引物列表如表1 所示。
②Transwell 迁移实验 将转染SS-NC 或SSDUXAP9 24 h 后的CAL27 细胞和HN6 细胞,4 × 10
个细胞用200 μL 无血清培养基重悬接种于24 孔板的8 μm 孔隙率的Transwell 小室上室,下室加入600 μL 的DMEM+20%胎牛血清。24~36 h 后,穿过小室的细胞用4%多聚甲醛室温固定15 min,0.1%结晶紫染色30 min。显微镜拍摄Transwell 上室底部细胞,Image J 软件进行计数。
③CCK-8 实验 将转染SS-NC 或SS-DUXAP9 24 h 后的CAL27 细胞和HN6 细胞以1 000 个/孔的密度接种到96 孔板中,重复3 个副孔。将10 μL CCK-8 试剂添加到90 μL 培养基中。随后将细胞在37 ℃下培养2 h,并使用UV/Vis 微板分光光度计在450 nm 和600 nm 处测量吸光度。
1.2.8 裸鼠皮下成瘤实验 SPF 级裸鼠(7 周)购自上海交通大学医学院实验动物科学部。在实验前,这些动物被饲养在(22 ± 1)℃和(50 ± 5)%湿度的SPF 标准笼子中。
将转染SS-NC 或SS-DUXAP9 72 h 后的CAL27细胞和HN6 细胞进行蛋白抽提,制胶上样电泳,免疫印迹(湿转),封闭40 min,加入E-cadherin、Vimentin、N-cadherin、Snail 和GAPDH 抗体一抗,4 ℃过夜孵育。TBST 洗膜3 次,10 min/次。加入二抗孵育1 h。TBST 洗膜3 次,10 min/次。ECL 试剂盒显色,化学发光成像仪进行化学发光,保存图片分析。
1.2.4 细胞转染 沉默DUXAP9 的Smart Silencer(SS-DUXAP9)由锐博生物有限公司设计和合成。siRNA#1:GATAGAATAGTGACAATAA;siRNA#2:GACCCATCACAAAGTTTAA;siRNA#3:GAGATATGTAGTAAAGCAA;ASO#1:GCTGTACACAAATACTGAAC;ASO#2:TACAATCTAAGTGGTTGGAC;ASO#3:AAATATGCACTTCCCACAAC。按照制造商的说明,使用Lipofectamine 3000 试剂对CAL27 细胞和HN6 细胞转染相应的siRNA 和ASO。
1.2.7 qRT-PCR、Western blot 检测EMT 相关基因、蛋白表达 将转染SS-NC 或SS-DUXAP9 48 h 后的CAL27 细胞和HN6 细胞进行总RNA 的提取,进行qRT-PCR 实验,检测GAPDH、DUXAP9、E-cadherin、N-cadherin、Snail 和Vimentin 的RNA 表达水平,操作同1.2.5。
小鼠分对照组(注射转染SS-NC 的CAL27 细胞皮下成瘤组)和实验组(注射转染SS-DUXAP9 的CAL27 细胞皮下成瘤组),每组5 只小鼠。将1 ×10
个CAL27 细胞接种于5 只小鼠左右背侧皮下,注射100 μL 无血清DMEM 培养基含1 × 10
个预处理的CAL27 细胞。每4 d 用卡尺测量肿瘤大小。肿瘤体积的测量方法如下:肿瘤体积=长× 宽×宽/2。动物处死后,采集肿瘤标本,测量重量。所有的动物实验的操作和处理得到上海交通大学医学院附属第九人民医院伦理审查委员会的批准(伦理审批号:SH9H-2019-A56-1)。
1.3 统计学分析
1.2.6 细胞划痕、Transwell 迁移、CCK-8 实验①细胞划痕实验 比较转染SS-NC(对照组)或SSDUXAP9(实验组)的CAL27细胞和HN6细胞在培养0 h和24 h细胞迁移能力的差异,以验证DUXAP9的沉默是否会对CAL27 和HN6 细胞的迁移能力有影响,标记并测量三个视野,实验重复3次。
建筑物体形系数是指建筑物接触室外大气的外表面积与其所包围的体积的比值[4]。建筑物体形宜规则,减少凹凸,可适当增加房屋的进深,减少其外表面积,通过这些措施可减少体形系数。体积小、体形复杂的建筑,以及平房和低层建筑物,体形系数较大,对节能不利;而体积大、体形简单的建筑物,以及多层和高层建筑,体形系数较小,对节能较为有利。在其他条件相同的条件下,进深大的建筑比进深小的好,外表整齐的建筑比凹凸变化多的好,长的比短的好,高的比矮的好,但建筑师在进行建筑创作时要结合功能综合考虑。一般来讲,体形系数不大于0.30,体形系数越小节能效果越好。
2 结 果
2.1 DUXAP9 在头颈鳞癌组织样本和细胞系中高表达
对5 对头颈鳞癌患者组织样本和配对的癌旁组织样本进行lncRNA 转录组测序分析后发现,与癌旁组织相比,DUXAP9 在头颈鳞癌中异常高表达(图1a、1b)。进一步为了评估DUXAP9 在多种癌症中的水平,首先通过TCGA 数据库进行泛癌分析(包括肿瘤组织和癌旁组织),发现DUXAP9 在大多数恶性肿瘤类型中表达上调,包括头颈鳞癌,DUXAP9 在TCGA 正常标本与TCGA 肿瘤标本中的表达有统计学差异(图1c)。接下来,生存曲线分析发现,与DUXAP9 低表达患者相比,DUXAP9 高表达的患者生存率差(图1d)。此外,利用TCGA数据库头颈鳞癌数据进行ROC 分析显示,以DUXAP9 的表达量可作为标准区分肿瘤及正常组织,其AUC 值可达0.884,DUXAP9 可以作为头颈鳞癌患者早期诊断的生物标志物(图1e)。进一步为评估DUXAP9 在头颈鳞癌中的表达水平,在头颈鳞癌组织样本(图1f)和细胞系(图1g)中检测DUXAP9 的表达水平,qRT-PCR 实验表明DUXAP9 在头颈鳞癌组织标本和细胞系中异常高表达。

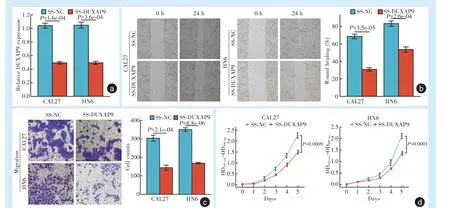
2.2 沉默DUXAP9 能显著抑制头颈鳞癌细胞的增殖和迁移能力
SS-DUXAP9 能有效地抑制DUXAP9 在CAL27和HN6 细胞中的表达水平(图2a),细胞划痕实验显示,与对照组相比,沉默DUXAP9 能显著抑制CAL27 细胞和HN6 细胞的迁移能力(图2b),Transwell 迁移实验也进一步证实沉默DUXAP9 能显著抑制CAL27 和HN6 细胞的迁移能力(图2c)。同时,CCK-8 实验结果表明沉默DUXAP9 可以显著抑制CAL27 和HN6 细胞的增殖能力(图2d)。
2.3 沉默DUXAP9 能显著抑制EMT 相关基因的表达
经qRT-PCR 实验证实,在CAL27 和HN6 细胞中,沉默DUXAP9 基因能显著增加E-cadherin 的mRNA 表达水平,降低N-cadherin、Vimentin 和Snail的mRNA 表达水平(图3a、3b);Western blot 实验进一步证实,在CAL27 和HN6 细胞中,沉默DUXAP9基因也能显著增加E-cadherin 的蛋白表达水平,降低N-cadherin、Vimentin 和Snail 蛋白表达水平(图3c)。此外,TCGA 数据库数据进一步提示,在头颈鳞癌组织样本中,DUXAP9 与Snail mRNA 的表达水平呈正相关性(
=0.28)(图3d)。

2.4 沉默DUXAP9 可明显抑制裸鼠皮下成瘤能力
裸鼠皮下成瘤实验表明,沉默DUXAP9 可显著抑制CAL27 移植瘤的生长;与对照组相比,沉默组的肿瘤体积和重量显著减少(图4)。

3 讨 论
越来越多的证据表明,lncRNAs 在人类疾病进展以及各种癌症的发生和发展中起着重要作用
。研究发现,异常表达的lncRNAs 参与了头颈鳞癌细胞的一些生物学过程,如增殖、分化、侵袭和转移
。有报道,lncRNA DUXAP9 可以直接与Cbl-b(Cbl proto-oncogene B)结合,增强表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路,促进非小细胞肺癌进展
。在肾癌细胞中,DUXAP9 可以发生N6 -腺苷甲基化修饰,并与胰岛素样生长因子2 mRNA 结合蛋白2(insulin like growth factor 2 mRNA binding protein 2,IGF2BP2)结合增加其稳定性,通过PI3K/AKT 通路促进肾癌细胞的增殖和迁移能力
。在肝细胞癌中,DUXAP9直接与Y 染色体性别决定区(sex-determing region of Y chromosome,SRY)-盒转录因子9(SRY-box transcription factor 9,SOX9)的3′非翻译区(UTR)结合,增强了SOX9 mRNA 的稳定性,增加了SOX9 的表达,从而促进肝细胞癌的进展
。本课题组通过lncRNA 转录组学比较5 对头颈鳞癌组织标本和配对癌旁组织标本的差异表达lncRNAs,发现DUXAP9 在头颈鳞癌组织中表达显著上调,通过TCGA 数据库分析,DUXAP9 上调表达与头颈鳞癌患者预后差密切相关;裸鼠皮下成瘤实验表明,沉默DUXAP9 可显著抑制CAL27 移植瘤的生长。
肿瘤的转移是癌症死亡的主要原因,在癌症中,EMT(epithelial-mesenchymal transition)通过增强癌细胞的迁移能力、侵袭能力和对凋亡刺激的抵抗能力,赋予癌细胞转移特性
,EMT 是由一系列复杂的生物和生化变化组成
,这些变化导致细胞失去分化的上皮细胞样形态,而获得更多的间叶细胞样的表型
。Snail 可通过EMT 在头颈鳞癌中诱导和维持肿瘤干细胞样特性的作用
。研究证明,NBS1 可通过上调Snail 来诱导EMT 的表型和促进头颈鳞癌的迁移侵袭能力
。本研究通过对TCGA 数据库数据分析的结果显示,在头颈鳞癌组织样本中,DUXAP9 与Snail mRNA 的表达水平呈正相关性,提示DUXAP9 可能通过上调Snail 的表达来促进EMT 进程。
研究表明,高表达的N-cadherin 和低表达的Ecadherin 与鳞状细胞癌的组织学分化、侵袭模式和淋巴结转移密切相关
。而上皮-间充质转化的特点是EMT 的标志蛋白如N-cadherin、Vimentin 等上调和E-cadherin 等下调,这一过程受到复杂的信号通路和转录因子网络的严格调控
,研究显示,Snail 可在头颈鳞癌细胞和口腔上皮细胞中驱动EMT,下调上皮粘附物如E-cadherin 和β-catenin,和诱导间充质标记物如N-cadherin 的上调,进而影响肿瘤的增殖转移能力
。AKT 诱导的lncRNA VAL通过减少trim16 依赖的Vimentin 降解,促进肿瘤的EMT 进展
。LncRNA HOTAIR 可通过招募EZH2和H3K27me3 到局部染色质中,从而抑制E-cadherin 的表达来促进OSCC 的恶化
。本研究结果提示,沉默DUXAP9 能显著增加E-cadherin 的mRNA 和蛋白表达水平,降低N-cadherin、Vimentin和Snail 的mRNA 和蛋白表达水平,提示DUXAP9可能通过调控EMT 介导的头颈鳞癌细胞的迁移。
(3)群雄斗虎。领舞者持钓鱼鞭向空中一举,四名斗虎英雄持刀引领四虎转至场北面,由东到西面朝南按①-④虎一字排开,领舞者一招“拨云见日”,四虎向前扑三扑,四名斗虎英雄在虎前做“三仆刀”,行至场南面。
综上所述,DUXAP9 可以促进头颈鳞癌的增殖、迁移和裸鼠皮下成瘤能力。
【Author contributions】 Cao W,Ji T conceived and designed the study. Zhou WK,Wang JX conducted the
experiments. Wang YF,Chen M conducted the
experiments. Zhou WK,Liu ZQ wrote the manuscript. Zhang X,Tao XR analyzed the data. All authors have read and approved the final manuscript.
[1]Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018,68(6):394-424.doi:10.3322/caac.21492.
[2]Johnson DE,Burtness B,Leemans CR,et al.Head and neck squamous cell carcinoma[J]. Nat Rev Dis Primers, 2020, 6(1): 92. doi:10.1038/s41572-020-00224-3.
[3]Ma H, Chang H, Yang W, et al. A novel IFNα-induced long noncoding RNA negatively regulates immunosuppression by interrupting H3K27 acetylation in head and neck squamous cell carcinoma[J].Mol Cancer,2020,19(1):4.doi:10.1186/s12943-019-1123-y.
[4]Jacobs C. The internist in the management of head and neck cancer[J]. Ann Intern Med, 1990, 113(10): 771-778. doi: 10.7326/0003-4819-113-10-771.
[5]Hashim D, Genden E, Posner M, et al.Head and neck cancer prevention: from primary prevention to impact of clinicians on reducing burden[J]. Ann Oncol, 2019, 30(5): 744-756. doi: 10.1093/annonc/mdz084.
[6]Chi AC,Day TA,Neville BW.Oral cavity and oropharyngeal squamous cell carcinoma--an update[J]. CA Cancer J Clin, 2015, 65(5):401-421.doi:10.3322/caac.21293.
[7]Chow LM. Head and neck cancer[J]. N Engl J Med, 2020, 382(1):60-72.doi:10.1056/NEJMra1715715.
[8]Omura K. Current status of oral cancer treatment strategies: surgical treatments for oral squamous cell carcinoma[J]. Int J Clin Oncol,2014,19(3):423-430.doi:10.1007/s10147-014-0689-z.
[9]Alterio D, Marvaso G, Ferrari A, et al. Modern radiotherapy for head and neck cancer[J]. Semin Oncol, 2019, 46(3): 233-245. doi:10.1053/j.seminoncol.2019.07.002.
[10] Jansen L,Buttmann-Schweiger N,Listl S,et al.Differences in incidence and survival of oral cavity and pharyngeal cancers between Germany and the United States depend on the HPV-association of the cancer site[J]. Oral Oncol, 2018, 76: 8-15. doi: 10.1016/j.oraloncology.2017.11.015.
[11] Aires FT,Lin CS,Matos LL,et al.Risk factors for distant metastasis in patients with oral cavity squamous cell carcinoma undergoing surgical treatment[J]. ORL J Otorhinolaryngol Relat Spec,2017,79(6):347-355.doi:10.1159/000485627.
[12] Ali T, Grote P. Beyond the RNA-dependent function of LncRNA genes[J].Elife,2020,9:e60583.doi:10.7554/eLife.60583.
[13] Robinson EK,Covarrubias S,Carpenter S.The how and why of lncRNA function: an innate immune perspective[J]. Biochim Biophys Acta Gene Regul Mech, 2020, 1863(4): 194419. doi:10.1016/j.bbagrm.2019.194419.
[14] Guttman M, Rinn JL. Modular regulatory principles of large noncoding RNAs[J]. Nature, 2012, 482(7385): 339-346. doi: 10.1038/nature10887.
[15] Schmitt AM, Chang HY. Long noncoding RNAs in cancer pathways[J]. Cancer Cell, 2016, 29(4): 452 - 463. doi: 10.1016/j.ccell.2016.03.010.
[16] Zhu Q, Liu J, Tang J, et al. Overexpression of long non-coding RNAs DUXAP9 and DUXAP10 is associated with prognosis in patients with hepatocellular carcinoma after hepatectomy[J]. Int J Clin Exp Pathol,2018,11(3):1407-1414.
[17] Liu KY,Wang LT,Hsu SH,et al.Homeobox genes and hepatocellular carcinoma[J]. Cancers (Basel), 2019, 11(5): 621. doi:10.3390/cancers11050621.
[18] Cheetham SW, Gj F, Dinger M. Overcoming challenges and dogmas to understand the functions of pseudogenes[J]. Nat Rev Genet,2020,21(3):191-201.doi:10.1038/s41576-019-0196-1.
[19] Chen J, Lou W, Ding BS, et al. Overexpressed pseudogenes,DUXAP8 and DUXAP9, promote growth of renal cell carcinoma and serve as unfavorable prognostic biomarkers[J]. Aging, 2019,11(15):5666-5688.doi:10.18632/aging.102152.
[20] Bridges MC, Daulagala AC, Kourtidis A. LNCcation: lncRNA localization and function[J]. J Cell Biol, 2021, 220(2): e202009045.doi:10.1083/jcb.202009045.
[21] Tan YT, Lin JF, Li T, et al. LncRNA-mediated posttranslational modifications and reprogramming of energy metabolism in cancer[J]. Cancer Commun (Lond), 2021, 41(2): 109-120. doi: 10.1002/cac2.12108.
[22] Tian H, Lian R, Li Y, et al. AKT-induced lncRNA VAL promotes EMT-independent metastasis through diminishing Trim16-dependent Vimentin degradation[J]. Nat Commun, 2020, 11(1): 5127.doi:10.1038/s41467-020-18929-0.
[23] Wu K,Jiang Y,Zhou W,et al.Long noncoding RNA RC3H2 facilitates cell proliferation and invasion by targeting MicroRNA-101-3p/EZH2 axis in OSCC[J]. Mol Ther Nucleic Acids, 2020, 20: 97-110.doi:10.1016/j.omtn.2020.02.006.
[24] Zhu T, An S, Choy MT, et al. LncRNA DUXAP9-206 directly binds with Cbl-b to augment EGFR signaling and promotes nonsmall cell lung cancer progression[J].J Cell Mol Med,2019,23(3):1852-1864.doi:10.1111/jcmm.14085.
[25] Tan L, Tang Y, Li H, et al. N6-methyladenosine modification of LncRNA DUXAP9 promotes renal cancer cells proliferation and motility by activating the PI3K/AKT signaling pathway[J]. Front Oncol,2021,11:641833.doi:10.3389/fonc.2021.641833.
[26] Zeng R,Wang C,Wang W,et al.Long non-coding RNA DUXAP9 promotes hepatocellular carcinoma cell stemness
directly interacting with sox9[J]. Environ Toxicol, 2021, 36(9): 1793-1801. doi:10.1002/tox.23300.
[27] Mittal V. Epithelial mesenchymal transition in tumor metastasis[J]. Annu Rev Pathol, 2018, 13: 395-412. doi: 10.1146/annurevpathol-020117-043854.
[28] Han Q,Zhang W,Meng J,et al.LncRNA-LET inhibits cell viability,migration and EMT while induces apoptosis by up-regulation of TIMP2 in human granulosa-like tumor cell line KGN[J]. Biomed Pharmacother, 2018, 100: 250-256. doi: 10.1016/j.biopha.2018.01.162.
[29] Loh CY, Chai JY, Tang TF, et al. The E-cadherin and N-cadherin switch in epithelial-to-mesenchymal transition: signaling, therapeutic implications,and challenges[J]. Cells, 2019, 8(10): 1118.doi:10.3390/cells8101118.
[30] Ota I, Masui T, Kurihara M, et al. Snail-induced EMT promotes cancer stem cell-like properties in head and neck cancer cells[J].Oncol Rep,2016,35(1):261-266.doi:10.3892/or.2015.4348.
[31] Yang MH,Chang SY,Chiou SH,et al.Overexpression of NBS1 induces epithelial-mesenchymal transition and co-expression of NBS1 and Snail predicts metastasis of head and neck cancer[J].Oncogene,2007,26(10):1459-1467.doi:10.1038/sj.onc.1209929.
[32] Nguyen PT, Kudo Y, Yoshida M, et al. N-cadherin expression is involved in malignant behavior of head and neck cancer in relation to epithelial-mesenchymal transition[J]. Histol Histopathol,2011,26(2):147-156.doi:10.14670/HH-26.147.
[33] Scanlon CS, Van Tubergen EA, Inglehart RC, et al. Biomarkers of epithelial-mesenchymal transition in squamous cell carcinoma[J].J Dent Res, 2013, 92(2): 114-121. doi: 10.1177/0022034512 467352.
[34] Jiang Y,Cao W,Wu K,et al.LncRNA LINC00460 promotes EMT in head and neck squamous cell carcinoma by facilitating peroxiredoxin-1 into the nucleus[J]. J Exp Clin Cancer Res, 2019, 38(1):365.doi:10.1186/s13046-019-1364-z.

