局部进展期近端胃癌新辅助化疗后腹腔镜与开腹手术安全性与近期疗效研究
胡茂 夏天 李腾腾 王凯 付海啸 张轩 符炜
作者单位:徐州医科大学附属医院胃肠外科(江苏省徐州市221000)
胃癌是全球第三大常见的癌症死亡原因[1]。胃癌起病隐匿,大部分患者发现或诊断时,已发展为进展期胃癌,尽管手术治疗被认为是主要的治疗方法,但晚期患者的长期疗效仍不尽人意。根据MAGIC 和FLOT4 试验结果,晚期胃癌的新辅助化疗在西方国家已被广泛接受。目前,国内研究均提倡对于进展期胃癌,应在手术治疗前行新辅助化疗,以提高临床治疗效果和改善患者预后[2]。
通信作者:符炜 master-fuwei@163.com
自1994年Kitano 报道第1 例腹腔镜远端胃切除术(laparoscopic distal gastrectomy,LDG)以来,腹腔镜技术已成为早期胃癌广泛接受的标准手术选择。近年来,LDG 加D2 淋巴结清扫被广泛应用于晚期胃癌的治疗。多项回顾性研究和病例对照研究证实LDG 的疗效和安全性不逊于开放手术[3-4],但是,目前针对近端进展期胃癌新辅助化疗后,腹腔镜与开腹手术的优劣尚无定论。虽然目前部分回顾性研究表明,腹腔镜全胃切除+D2 淋巴结清扫在安全性与疗效上与开腹手术无显著性差异,甚至在快速康复方面优于传统开腹手术[5],但新辅助化疗对患者身体一般情况、肿瘤、淋巴结以及肿瘤周围组织的影响不容忽视,新辅助化疗对开腹手术和腹腔镜手术都存在着不同程度的影响。
有研究表明,新辅助化疗会导致胃及胃周组织水肿及纤维化,尤其是在肿瘤周围及转移淋巴结周围[6]。因此,当重要血管周围的淋巴结及其周围组织,因化疗发生纤维化改变,使得解剖间隙模糊,则可能导致手术难度增加,同时增加术中及术后并发症发生风险。术中精细解剖及操作和对淋巴管及血管的确切缝扎,对于减少术后并发症的发生尤为重要。此外,腹腔镜手术较传统开腹手术时间延长,麻醉时间延长,可能会增加术后并发症发生风险,尤其是肺部相关并发症发生风险增加。新辅助治疗导致肿瘤周围组织水肿,干扰到层次的解剖,同时新辅助治疗对患者凝血功能的破坏也造成患者出血明显,很难达到“微出血”或者“无血”。因而,在接受新辅助化疗后是否能够实施膜解剖的胃癌根治术,目前仍有争议。对于新辅助化疗后的病例,能否在获得腹腔镜微创外科术后快速康复优勢的同时,在术中及术后安全性上与传统开腹手术相当,甚至优于传统开腹手术,是一个值得深入研究的问题。
1 材料与方法
1.1 临床资料
回顾性选取2018年1月至2020年1月徐州医科大学附属医院收治的局部进展期近端胃癌患74 例,通过倾向性评分法进行1∶1 匹配将66 例患者纳入研究,患者于本院完善新辅助化疗后,其中34 例患者行腹腔镜全胃切除+D2 淋巴结清扫(腹腔镜组),32 例患者行开腹全胃切除+D2 淋巴结清扫(开腹组)。
纳入标准:1)经胃镜活检病理证实的胃癌;2)均经过新辅助化疗; 3)原发肿瘤经影像学或超声内镜评价为cT3-4N1-3M0;4)年龄20~80 岁; 5)术后病理分期遵照美国癌症联合会(AJCC)和国际抗癌联盟(UICC)第8 版;6)术前经美国麻醉师协会(ASA)评分≤3;7)均行标准的胃癌D2 根治术。
排除标准:1)原发肿瘤在影像学上无法评价;2)术前影像学证实远处转移或腹膜转移者; 3)ASA评分>3;4)同时合并其他恶性肿瘤;5)仅行姑息性手术者或术中联合转移灶切除者;6)腹腔镜手术中转开腹者;7)需急诊手术治疗的合并症(如穿孔、出血等);8)未在本院进行新辅助治疗者。
1.2 方法
1.2.1 手术方式 两组患者行常规术前准备后,采用全身麻醉,导尿操作,将患者摆好体位,即双手展开并固定,两腿分开并固定。
两组患者手术均遵循中国临床肿瘤协会(CSCO)胃癌诊疗指南(2019年版)与日本胃癌指南(第5 版),行标准的全胃切除术,并进行D2 淋巴结清扫术(包括1-7、8a、9、10、11 组)。术后将各组淋巴结做标识分别送检。
两组患者手术均由同一临床医师担任主刀。在围手术期,均通过标准化的临床途径进行管理,当患者耐受软质饮食>2 d 且未腹痛或发烧时,建议出院。
腹腔镜组手术过程:患者头部上抬 20°~30°,于患者脐上缘构建CO2气腹,置入观察孔,左侧腋前线肋缘下取12 mm Trocar 为主操作孔,左侧锁骨中线平脐的偏上2 cm 取5 mm Trocar 为辅助操作孔,右侧腋前线肋缘下取5 mm Trocar 及右侧锁骨中线平脐偏上2 cm 取10 mm Trocar 为助手操作孔。按逆时针方向依次探查。挑起肝叶,查看病变部位,确定无临近脏器侵犯。确定可以施行腹腔镜手术后,开始程序化手术操作。助手挑起肝脏,沿肝脏下缘挑起小网膜,打开肝胃韧带,清扫第1 和第3 组淋巴结。D2 根治淋巴结清扫顺序:按照胰脾淋巴结群,幽门下淋巴结群,幽门上淋巴结群,腹腔淋巴结群的顺序进行。向结肠脾曲游离胃结肠韧带,切开胰尾被膜,将脂肪及淋巴组织向上清扫,显露网膜左动静脉,清扫4sd 组淋巴结。于血管弓无血管区打开网膜,依次沿胃大弯清扫4d 组淋巴结,向结肠肝曲游离胃结肠韧带,行右侧网膜囊切除,以胰腺表面为标记,分离胃系膜与横结肠系膜,显露网膜右血管及结肠中血管,处理网膜右静脉,清扫6 组淋巴结,游离网膜右动脉并离断。以胃十二指肠动脉为线索向十二指肠右后侧分离,向前打通,同时游离十二指肠前右侧并打通,离断十二指肠,这样有利于清扫12a 及第5 组淋巴结沿胰腺上缘扩展层面,注意胰腺有多支小血管,防止出血。解剖肝十二指肠韧带前叶,清扫12a 组淋巴结,处理胃右血管,清扫5 组淋巴结,注意沿神经外侧进行,保护神经。显露门静脉及左侧缘,清扫12p 组淋巴结。处理胃左动静脉,清扫7、9 组淋巴结及胰腺上区淋巴结并沿脾血管清扫11p 组淋巴结,发现胃后血管分支,予以分离并结扎。至此第2 站淋巴结清扫完毕。取腹部正中切口5~8 cm,开放状态进行消化道重建。
开腹组手术过程:于患者上腹部正中取15~20 cm切口,淋巴结清扫范围与程序与腹腔镜组相同,两组均在开腹状态下进行消化道重建。
消化道重建均行标准的Roux-en-Y 吻合法。所有的重建都是用圆形缝合器与直线切割闭合器以开放方式进行的。两组手术中,均由主刀决定引流管的位置。
1.2.2 观察指标 收集并记录两组患者一般资料及术中、术后观察指标的资料,一般资料包括年龄、性别、BMI、疾病史、ASA 分级、化疗方案及化疗周期等,术中及术后资料包括手术时间、术中出血量、淋巴结清扫总数、阳性淋巴结数量、肿瘤远近端距离、术后带胃管时间、术后住院天数、术后肠功能恢复时间、腹腔引流管拔除时间和围手术期并发症,随访术后18个月患者的生存率及转移率。
1.3 统计学分析
采用SPSS 26.0 软件进行统计学分析。计量资料正态分布以±s表示,采用两独立样本t检验,若数据非正态分布采用秩和检验;计量资料以n(% )表示,采用x2检验;等级资料采用秩和检验。Kaplan-Meier 法计算生存率,Log-rank 检验进行生存分析。失访及死于非癌疾病的数据视为截尾数据。P<0.05 为差异具有统计学意义。
2 结果
2.1 倾向性匹配结果
本研究那总共纳入74 例患者,均行术前新辅助化疗,其中36 例行SOX(奥沙利铂+卡培他滨)方案3个周期后行手术治疗,38 例患者行FLOT(奥沙利铂+氟尿嘧啶+多西他赛+亚叶酸钙)方案4 个周期后行手术治疗,采用SPSS 26.0 软件对患者通过倾向性评分法进行1∶1 匹配,匹配变量包括患者性别、年龄、ASA 评分、病理T 分期、病理N 分期及肿瘤分化程度。最终行新辅助化疗后腹腔镜组患者34 例,开腹组患者32 例。
2.2 一般资料与肿瘤相关资料比较结果
经匹配后的两组患者在性别、年龄、BMI、疾病史、ASA 分级、化疗方案选择、化疗周期及化疗后RECIST 标准的肿瘤退缩情况上无显著性差异(表1)。肿瘤大小、肿瘤位置、病理分型、临床病理分期、术后病理分期、术后TRG 退缩分级及术后化疗周期上均无显著性差异(表2)。
表1 两组患者基本资料比较
表2 两组患者肿瘤相关资料比较
2.3 手术相关资料比较结果
两组患者手术根治性的比较上,腹腔镜组和开腹组R0 切除率分别为94.3%和91.2%,开腹组淋巴结清扫数量更多,差异有统计学意义(P<0.05),两组远切端、近切端及阳性淋巴结数量上无显著性差异(表3)。术中及术后的观察指标,开腹组手术切口更长、手术出血更多、手术时间更长、术后住院时间更久、首次肛门排气时间及流质饮食时间更长,差异有统计学意义(P<0.05),而两组在引流管拔除时间上无显著性差异(P>0.05)。两组患者术后并发症比较总体无显著性差异,腹腔镜组出现手术相关并发症8 例,并发症发生率23.5%,其中肺部感染4 例,腹腔感染1 例,予以抗生素治疗后好转;切口感染1 例,予以定期换药后好转;淋巴漏1 例,予以通畅引流及低脂饮食后好转;吻合口瘘1 例,予以双套管冲洗及肠外营养支持后好转。开腹组出现手术相关并发症7 例,并发症发生率21.8%,开腹组肺部感染2 例,腹腔感染1 例,予以抗生素治疗后好转;切口感染1 例,予以行二次手术清创后好转;术后出血1 例,行介入手术栓塞出血血管后好转;吻合口瘘1 例,予以双套管冲洗及肠外营养支持后好转(表4)。随访:腹腔镜组失访1 例,不配合随访1 例,开腹组失访2 例,开腹组术后18 个月总体生存(overall survival,OS )率和18 个月无病生存(disease-free survival,DFS)率分别为88.2% 和85.3%,腹腔镜组分别为87.5% 和84.3%,差异均无统计学意义(图1)。与既往研究结果类似,表明开腹组与腹腔镜组治疗新辅助化疗后局部进展期近端胃癌,具有相似的近中期疗效。
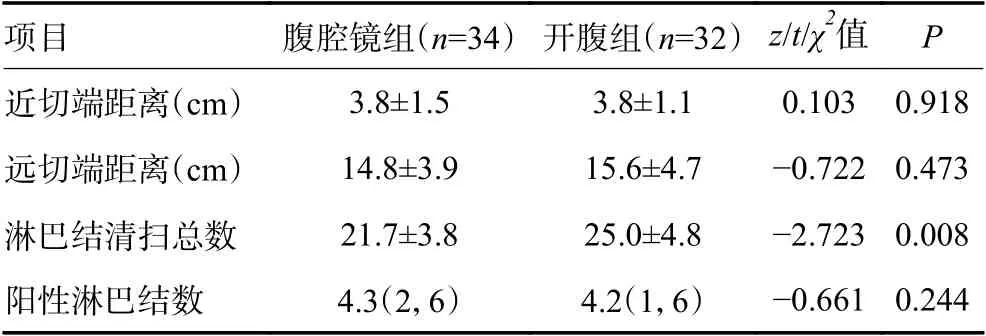
表3 手术根治性比较
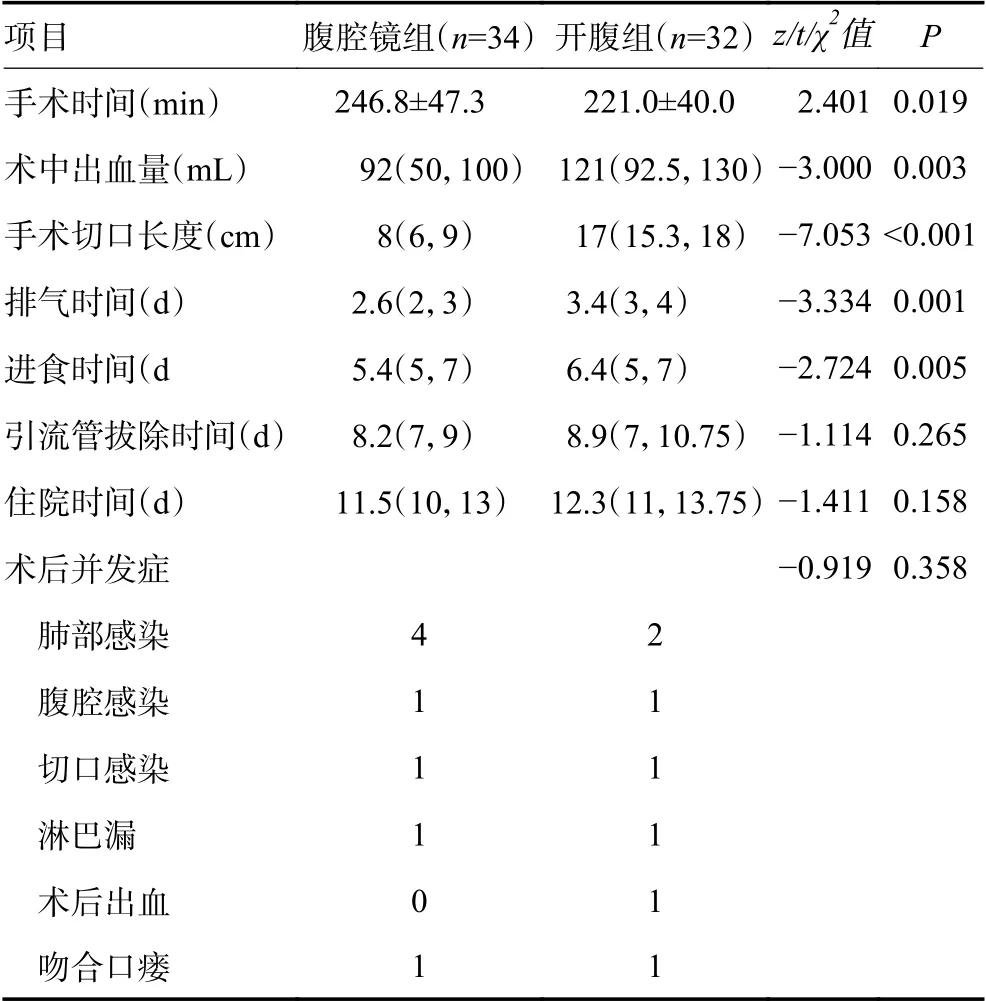
表4 术中及术后观察指标
3 讨论
全球胃癌每年发病率约为1 亿例,其中近一半新发病例发生在中国,国内大部分的胃癌患者确诊时已经是进展期或晚期[7]。进展期胃癌癌症根治性切除率低,复发率高,死亡率高。因此,中国胃癌患者的治疗面临着严峻形势。而随着肿瘤综合治疗的发展,胃癌的治疗不再局限于手术治疗,多学科联合治疗的模式得到推广。
随着近年来胃癌腹腔镜外科领域的发展,在陆续涌现的临床证据支持下,进展期胃癌腹腔镜手术的开展也越来越广泛。CLASS-01 研究(腔镜与开腹胃癌根治术治疗局部进展期远端胃癌的肿瘤学疗效多中心、 随机对照临床研究)显示,腹腔镜组3年无瘤生存率与传统开腹手术组相比差异无统计学意义,证实了腹腔镜手术治疗局部进展期胃癌与传统开腹手术同样安全有效[8],这也奠定了腹腔镜胃癌手术的基础。同时,新辅助化疗作为胃癌临床综合治疗的一部分,已经得到越来越多的临床证据支持及指南推荐。随着国内外研究表明,新辅助化疗能提高手术R0 切除率并减少淋巴结转移[9],同时研究表明,新辅助化疗能降低胃癌死亡率及总复发率,对于围手术期死亡率无明显影响[10-13],腹腔镜胃癌手术前进行新辅助化疗也正在逐渐被中国的临床医师所接受。
在手术策略选择上,对于新辅助化疗后的病例无论是施行腹腔镜或者开腹手术,均需实施D2 标准化淋巴结清扫。然而,随着众多中心展开新辅助后胃癌根治的前瞻性研究,有证据表明进展期胃癌行远端胃癌腹腔镜D2 根治术安全性与传统开腹手术相当,甚至部分研究表明对于接受新辅助化疗的局部进展期胃癌患者,腹腔镜相比开腹似乎具有更好的术后安全性和辅助化疗耐受性[14-15]。而腹腔镜全胃D2 根洽术的手术安全性尚缺乏高级别临床证据支持[16]。因此,对于进展期胃中上部肿瘤,在新辅助化疗后选择是否行腹腔镜手术尤其需要谨慎。
新辅助化疗后的肿瘤组织的病理学变化,不仅是术前化疗疗效判定的依据,也是术后治疗的依据[17]。但是,随着肿瘤组织学的变化会增加术中肿瘤浸润范围和淋巴结转移识别与判定的难度。现在临床应用的抗癌药主要是肿瘤靶向性药物,药物引起的肿瘤组织学变化首先是肿瘤细胞代谢障碍产生的细胞质嗜酸、核膨大、浓缩、细胞坏死、剥离、腺管构造破坏、中性粒细胞等炎性细胞浸润和单核细胞聚集,其后间质纤维化替代肿瘤细胞[18]。由于上述提及的病理学的变化,原发病灶逐渐缩小,转移淋巴结也因为淋巴结纤维化而缩小。因此,术中确定胃的手术切除范围和淋巴结廓清范围较为困难。切缘断端或淋巴结的转移有时要术中病理判定,但术中即便快速病理淋巴结阴性,术后常规病理出现淋巴结阳性的病例也不在少数。所以,鉴于癌的残留度是决定预后的重要因子,术前肿瘤浸润、转移状态和手术范围的精确判定十分重要,故最好应以新辅助化疗前的转移状态作为判定标准,全域安全的廓清非常必要,不能依据新辅助化疗肿瘤退缩后的状态作为手术切除范围和淋巴结廓清范围的标准。
新辅助化疗由于药物对组织的作用会产生胃壁组织的水肿、组织脆性增加、组织间隙不清、剥离易出血、创面模糊和渗出增多,从而增加手术难度,也会延长术后腹腔引流管的留置时间。虽然在新辅助化疗与非新辅助化疗的比较研究中发现对肝脏功能、手术部位感染、吻合口瘘和住院时间上差异无统计学意义[19-20],但化疗药物对组织学的影响及其后续效应增加手术风险的影响不容忽视。
在手术方面,随着新辅助化疗与腹腔镜外科技术发展,这两项技术在近端胃癌上联合使用存在争议,本研究纳入的患者中,腹腔镜组患者手术时间明显更长,这可能与新辅助化疗后,胃周围组织水肿、肿瘤退缩及肿瘤周围组织形成纤维化等变化相关,腔镜视野下,在切开肿瘤周围组织时,产生大量汽化,干扰手术层面及视野,需反复使用纱布擦拭与吸引器吸引,增加手术操作,加大了腹腔镜手术难度。
在根治性方面,开腹组的淋巴结清扫数量更多,但两者在近切端长度,阳性淋巴结数量上无显著差异,此项可能与开腹手术操作更加便利相关,同时本研究中未对所有淋巴结进行分组比较,单从淋巴结清扫数目方面说明两种手术方式的根治术性不够严谨,在国外一项研究中,对于术后标本的淋巴结分组十分细致,提示应对手术后标本进行更加细化的病理检测[21],同时可能在手术方式选择上,存在部分人为偏倚,治疗组可能将新辅助化疗效果更佳患者优先行腹腔镜手术,这也是回顾性研究中难以避免的因素,因此也希望更多有实力中心共同开展前瞻性研究。
在术后恢复方面,腹腔镜组在住院时间、首次肛门排气时间及流质饮食时间上均优于开腹组,这一项可能与腹腔镜手术切口更小,术中胃肠道干扰更小,利于患者早期下床活动有关;两组患者术后并发症发生率的比较,差异无统计学意义,这也说明了腹腔镜手术的安全性与可行性,但是腹腔镜组患者术后肺部感染率更高,这与手术时间与麻醉时间延长相关。
综上所述,新辅助化疗后的近端进展期胃癌,腹腔镜手术在安全性与可行性上与开腹手术无显著性差异。腹腔镜手术具有恢复快,手术切口小、胃肠道恢复快等优点,而在手术时间及淋巴结清扫数目方面,腹腔镜手术劣于开腹手术,目前缺乏多中心、大样本、前瞻性研究,缺乏对于患者的长期随访及评估,来判定其远期疗效;各医疗中心应该依据肿瘤性质、临床病理、生物学特性等情况,及当地医疗条件及腹腔镜水平,合理选择手术方式。

