甜菊糖苷类化合物的质谱行为分析及定量策略初探
罗庆云,印敏
(1.南京农业大学园艺学院,南京 210095;2.江苏省中国科学院植物研究所/南京中山植物园,南京 210014)
0 引言
植物化学形态学研究是对目标器官所含化合物的全面分析,是以特定部位所含化合物为依据,对植物资源加以描述和分类的一门形态学与化学相互渗透的学科。其基于化学组分间的有机联系,探讨化合物的形成、积累、转化机制,为以特定部位所含目标化合物为关注对象的遗传改良和栽培管理提供依据,其主要任务之一就是对特定部位所含各化合物进行相对全面的定性、定量表征。液质联用(LC-MS)技术具有定性范围广、相对定量准确、操作简单、检测快速、使用成本低等特点,广泛应用于化合物定性、定量分析,经发展,可实现对目标器官检出化合物的定性、定量分析,用于构建植物化学形态学研究体系所需数据采集系统[1-4]。
随着体重控制人群的增加,原产于南美洲阿曼山脉的菊科斯特维亚属宿根性多年生草本植物甜叶菊(Stevia rebaudianaBertoni),简称甜菊,因其叶富含一类甜度为蔗糖200~300 倍,但热量仅为蔗糖1/300 的四环二萜类化合物——甜菊糖苷(Steviol glycosides)而被广泛种植、加工[5]。我国是世界最主要的甜菊种植、加工基地,年产甜菊叶近10万吨,开展甜菊品质育种及配套栽培措施研究,提高甜菊叶内甜菊糖苷等化合物含量,可提高甜菊叶加工效益,促进甜菊产业可持续发展[6]。
本研究以甜菊叶所含甜菊糖苷类化合物为例,探讨建立利用LC-MS对植物目标器官所含各组分进行定量的化学计量方法,为作物品质育种亲本选配及栽培管理措施评价提供数据分析方法。
1 材料与方法
1.1 试验材料
1.1.1 供试甜菊
以按常规方法种植于江苏南京汤山的甜菊种质资源圃(E119.0651°、N32.0647°)、实验室自育、叶内各甜菊糖苷组分差异大、编号分别为‘6797’、‘6808’、‘6822’的3个甜叶菊品系的现蕾期叶片为材料。
1.1.2 仪器、试剂样品
分析仪器:液质联用仪Agilent 1260 UPLC-DAD-6530 ESI-QTOF MS。分析耗材:色谱柱ACE Ultracore 2.5 Super C18柱(150 mm×4.6 mm,2.5µm)(广州菲罗门科学仪器有限公司);甲酸(美国如意,LCMS级);乙腈(Tedia company Inc,absolv);去离子纯化水。
1.1.3 甜菊糖苷标准品
甜菊糖苷标准品瑞鲍迪苷A(Rebaudioside A,RA)、瑞鲍迪苷B(Rebaudioside B,RB)、瑞鲍迪苷C(Rebaudioside C,RC)、瑞鲍迪苷D(Rebaudioside D,RD)、瑞鲍迪苷E(Rebaudioside E,RE)、瑞鲍迪苷F(Rebaudioside F,RF)、瑞鲍迪苷G(Rebaudioside G,RG)、瑞鲍迪苷M(Rebaudioside M,RM)、瑞鲍迪苷N(Rebaudioside N,RN)、瑞鲍迪苷O(Rebaudioside O,RO)、双糖苷(Steviolbioside,SB)、甜菊苷(Stevioside,STV)12 个标准品,部分购于ChromaDex、部分由浩天药业有限公司馈赠,用含30%(v/v)乙腈的水溶液溶解。
1.2 方法
1.2.1 甜菊叶材料的处理
80 ℃烘箱中烘干过夜,参照罗庆云等[7]方法准备样品备用。
1.2.2 分析用样品准备及进样方法
将各甜菊叶提取液及混合标准品分别用含50%乙醇的水溶液稀释至原浓度的100%、80%、60%、40%和20%(在图1和表2~表7中分别用浓度梯度“5”~“1”表示,浓度梯度“5”为原浓度的100%,浓度梯度“1”为原浓度的20%),各10µL上机检测。
1.2.3 液质联用条件及方法
采用液质联用方法检测各材料叶片所含化合物,其中,液相分离体系为:以ACE Ultracore 2.5 Super C18柱为固定相,以含0.1%(v/v)甲酸(A)的纯净水和乙腈(B)为流动相,梯度洗脱条件为:0 min 22.0% B、7.0 min 26.5%B、12.0 min 26.5%B、15.0 min 38.0%B、19.0 min 100%B、22.0 min 100%B、22.01 min 22.0%B。
质谱条件为:离子源为电喷雾电离源,负离子扫描模式,雾化气为纯度99.9%氮气,碰撞气为纯度99.999%氮气,雾化气压力为50 psi,干燥气温度为350 ℃,干燥氮气流量为10.0 L/min,毛细管电压为3 000 V,Mass range 100~3 500 m/z,碰裂电压170 V,Mass Hunter B0.05.00工作站。
1.3 数据的采集分析策略
结合保留时间和共分离特征峰分析归属各甜菊糖苷的离子峰种类,并采集质荷比≥M/2 的裂解碎片、单分子、加和离子、双分子聚合物和三分子聚合物等组分及其同位素化合物的定量检出峰面积信息,分析各化合物相关组分的离子峰面积随各甜菊糖苷浓度变化情况,建立利用LC-MS对各甜菊糖苷进行定量的化学计量方法。
2 结果与分析
2.1 各甜菊糖苷类化合物定量分析用特征离子的确定
以材料中某单一化合物含量最高、受周边化合物影响最小的样品为案例,采用“步进”扫描结合共分离法提取考察LC-MS体系中归属各化合物的离子种类,利用“区域全扫描”方法确定甜菊叶内各主要甜菊糖苷类化合物的各组分同位素化合物m/z值分布范围(表1)。
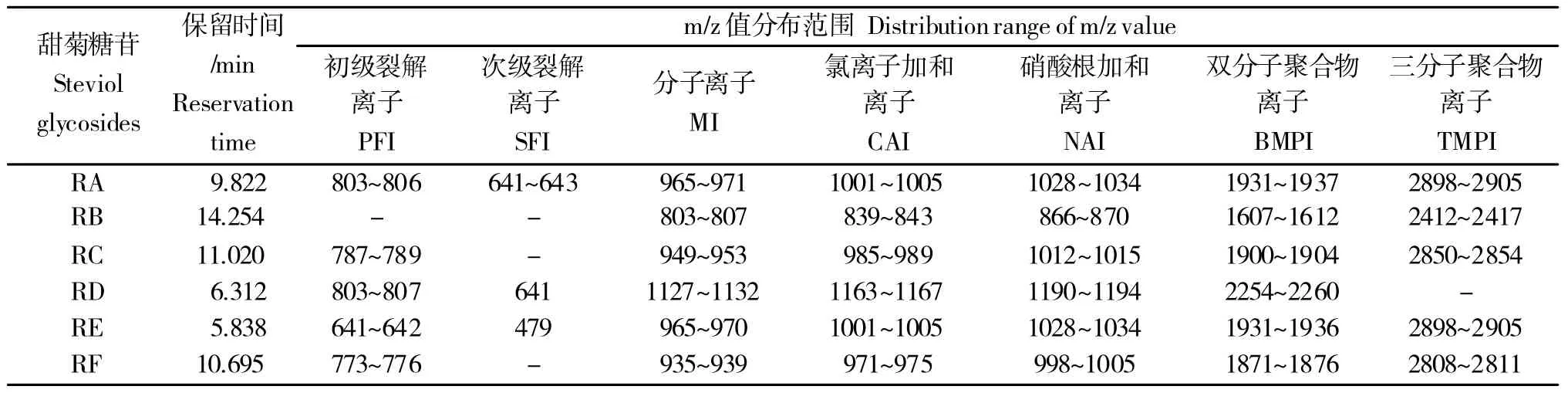
表1 甜菊糖苷类化合物各组分同位素化合物m/z 值分布范围Table 1 The m/z range of each isotopic group of steviol glycosides
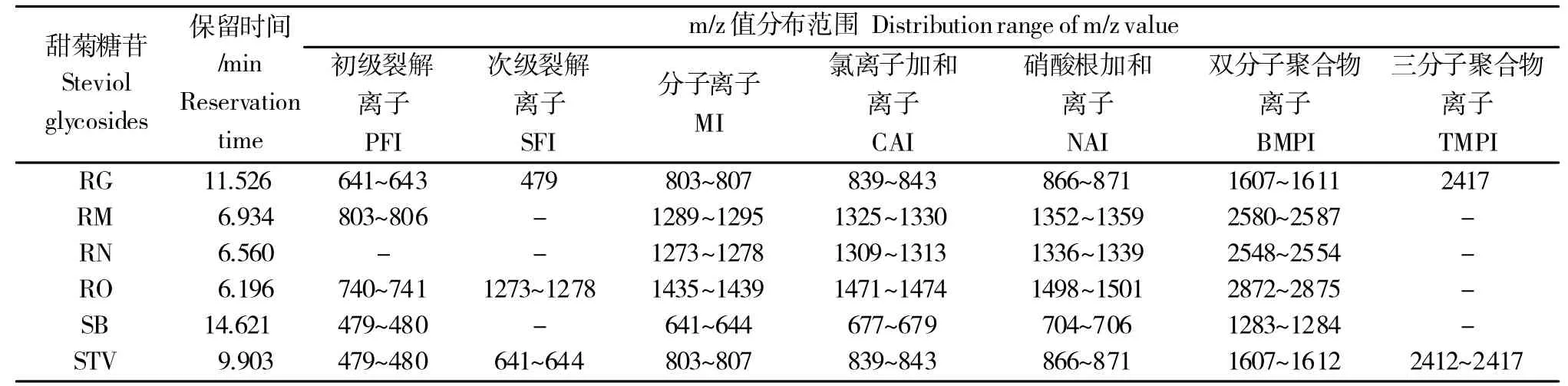
续表1 Conticuned Table 1
2.2 进样浓度对样品所含化合物离子信息检出效率的影响
利用上述特征离子信息,采用非对称提取方法(-0.000 0~+0.999 9),提取归属各组分的离子及其同位素化合物离子的定量检出峰信息。对各样品中定量检出离子种类数的变化情况分析结果显示,各样品定量检出离子种类随样品内所含化合物浓度的增大而呈线性增加(图1)。这一结果表明,由于LC-MS 仪器对化合物离子的定量存在检测限,在利用LC-MS 系统建立植物目标器官化学形态学分析系统时,各组分在样品中的含量高低是影响相关化合物能否被有效定量的关键因素之一。
另,图1 结果还显示,与甜菊叶片提取样品相比较,混合标准品内定量检出离子信息数随进样浓度梯度的增幅明显偏低。这一结果表明,各样品因其所含化合物丰富度不同,随进样浓度的增大,其检出化合物离子种类增幅不一:化合物组成越丰富的样品,其检出化合物离子种类增幅越大;反之,化合物组成越单一的样品,其检出化合物离子种类增幅越小。
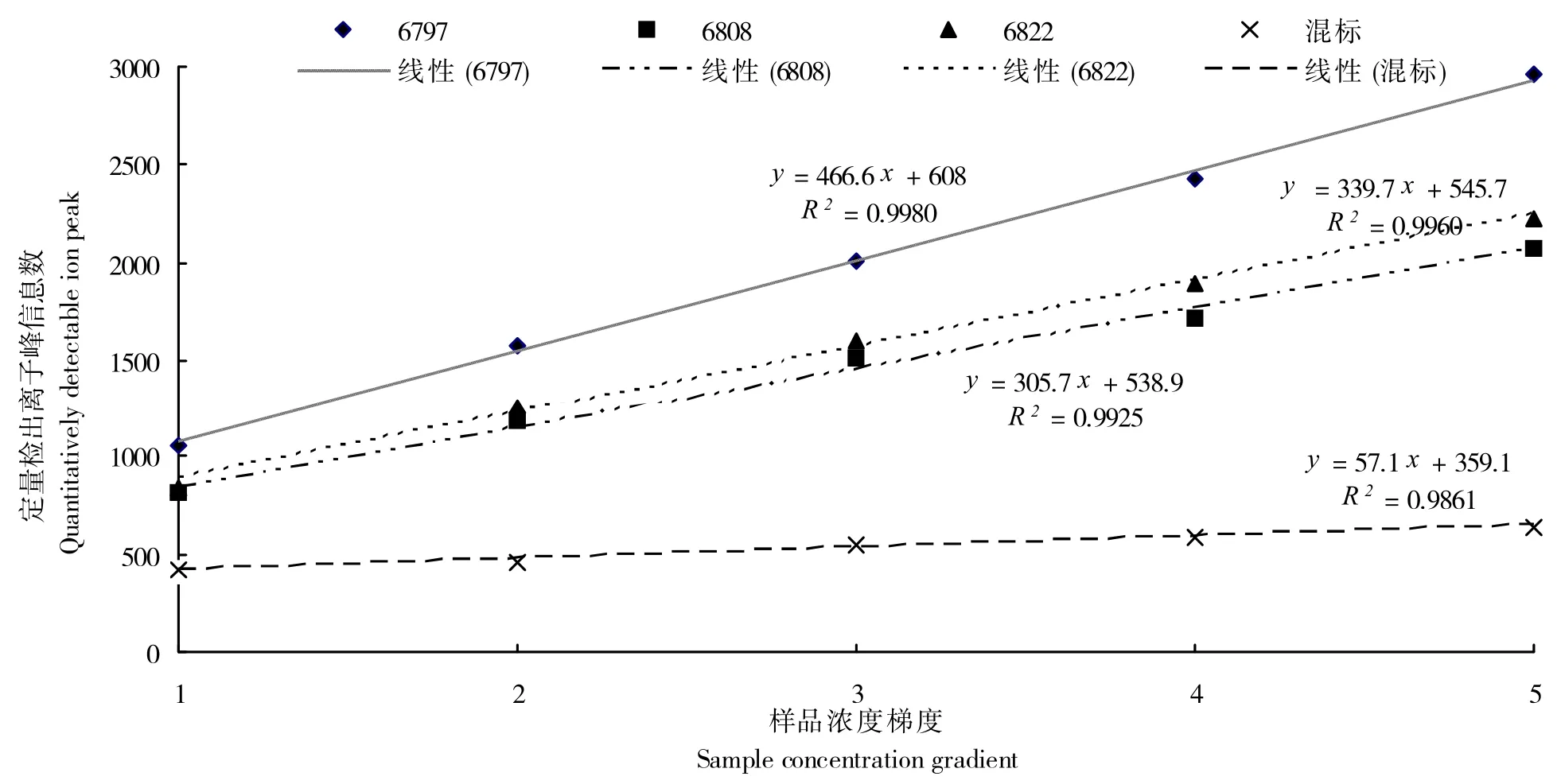
图1 样品所含化合物浓度对定量检出离子信息量的影响Fig.1 Influence of concentration of compounds in sample on items of quantitatively detectable ion
2.3 化合物浓度对归属同一甜菊糖苷类化合物的各类型离子质谱行为的影响
在混合体系中,各化合物的浓度差异大,为探讨建立一种适用于混合体系内各浓度水平的化合物定量策略,本部分以含量高的STV、中等的RE 和低的RO 三种甜菊糖苷化合物为例,探讨化合物浓度对各类型离子质谱行为的影响,在此基础上,再进一步探讨各甜菊糖苷类化合物的定量策略。表2~表7 内各样品排列顺序为相关组分含量由高到低进行排列,对同一样品,按照甜菊糖苷浓度梯度由高(浓度水平“5”)到低(浓度水平“1”)排列。
2.3.1 化合物浓度对归属同一化合物各组分检出效率的影响
表2~表4为分别以归属于STV/RE/RO 的各类型离子检出峰面积的总和为100%,测算各类型离子检出峰面积的绝对占比随STV/RE/RO 浓度梯度的变化情况。结果显示,在各种类型离子峰组中,以分子离子化合物组的检出峰面积占比最高,其次为裂解离子组、加和离子组和多分子聚合离子组;在裂解离子组中以初级裂解离子组的检出峰面积总和占比高于次级裂解离子组,在加和离子组中以硝酸根加和离子组检出峰面积总和占比高于氯离子加和离子,在聚合体组中双分子聚合体检出峰面积总和占比高于三分子聚合体。
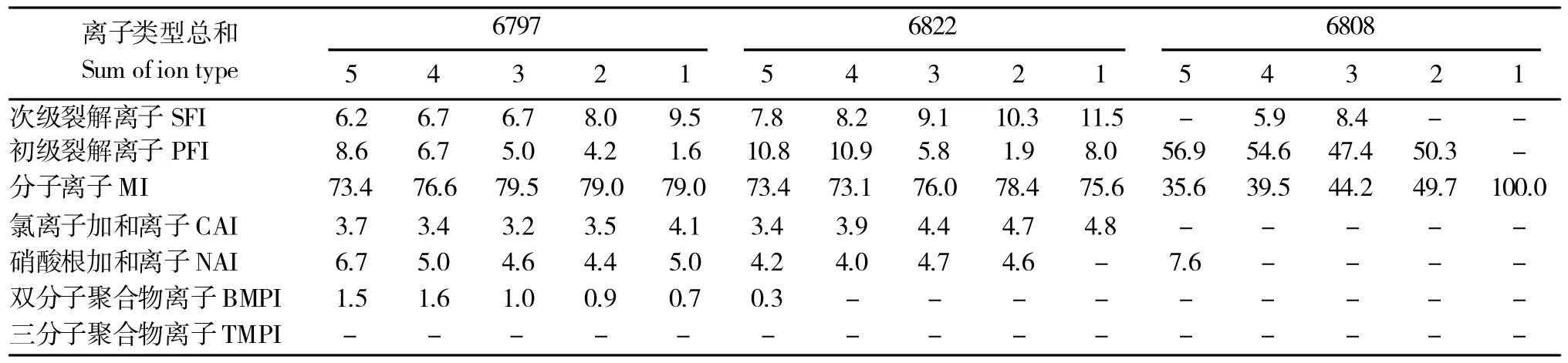
表4 RO 各组分离子检出效率随进样浓度梯度变化情况Table 4 Detection efficiency of component of RO varies with the gradient of concentration in samples
在混合体系中,随着化合物浓度的增加,化合物倾向于形成多分子聚合体,体系中多分子聚合体所占比例也随化合物浓度的增加而增高。但是表2结果显示,随着所进样品中STV 浓度梯度的增加,双分子和三分子聚合体离子检出峰面积的占比逐渐减小。具体原因可能是由于体系中单分子形态存在的STV 浓度过高,在LC-MS 检测时,单分子形态存在的STV 检测信号形成了对聚合体形态存在的STV 检测信号的掩盖,其根本原因是由于LC-MS检测器对化合物质谱信号的响应和提取能力有限。
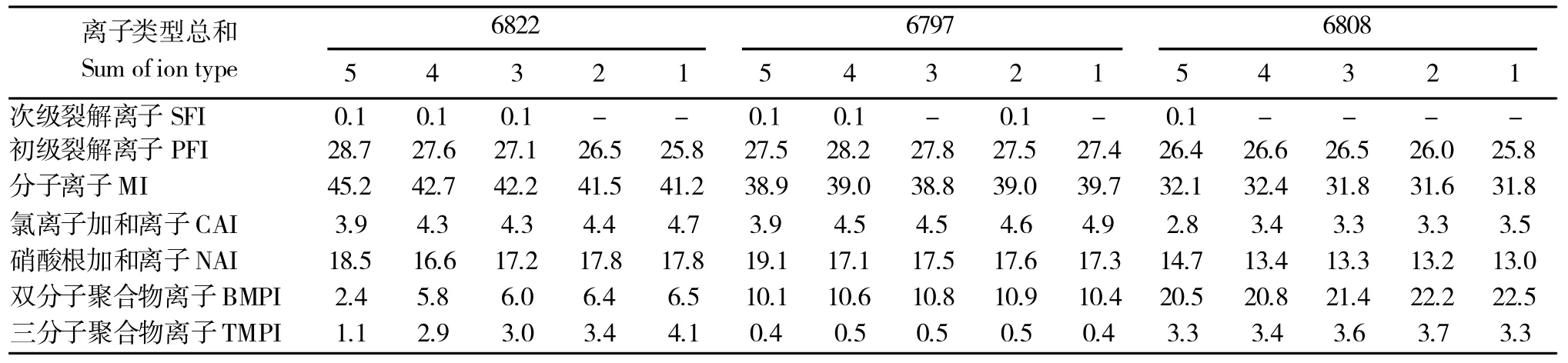
表2 STV 各组分离子检出效率随进样浓度梯度变化情况Table 2 Detection efficiency of component of STV varies with the gradient of concentration in samples
表3 和表4 结果显示,当所进样品中RE 或RO 浓度较低时,随着所进样浓度梯度的增加,其双分子聚合体和三分子聚合体离子检出峰面积在总检出峰面积中的占比逐渐增大,符合前述一般规律。同样地,这可能是由于源于单分子形态的化合物离子信号因化合物浓度较低而不足以掩盖源于双分子/三分子聚合体的离子信号。这一结果揭示,欲准确表征混合体系中各类型离子相对含量,应减小化合物的进样浓度,但由于植物器官中各化合物浓度不一,这对着眼于目标器官所含化合物全面解析的植物化学形态学研究具有一定挑战性。
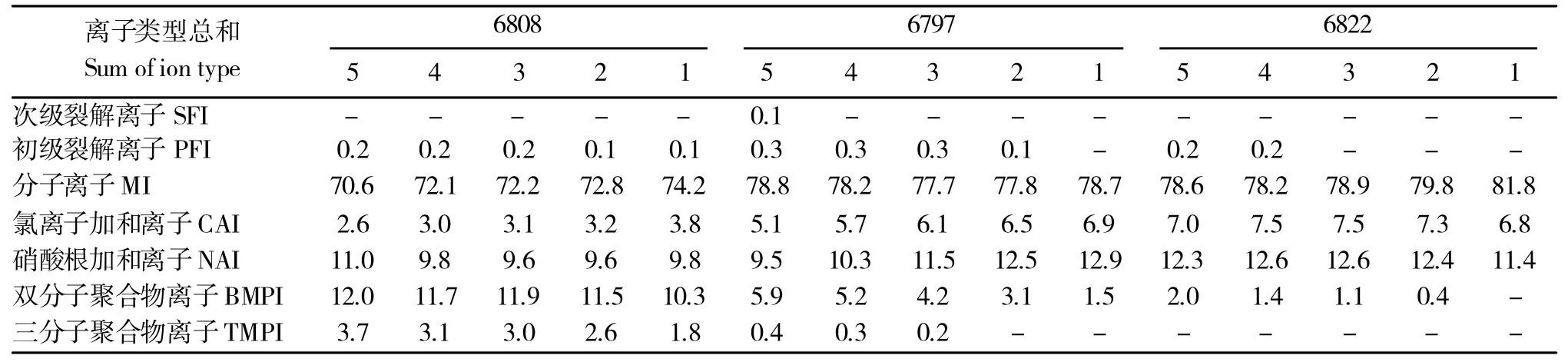
表3 RE 各组分离子检出效率随进样浓度梯度变化情况Table 3 Detection efficiency of component of RE varies with the gradient of concentration in samples
作物器官所含各化合物种类繁多,大多数化合物为绝对含量低于0.1%的微量和痕量化合物,建立对这类化合物进行定量的化学计量方法是植物化学形态学研究的重要任务。本研究以甜菊叶片中含量相对较低的RO 为例,分析其相关组分离子在检测体系中质谱行为。表4结果显示,当化合物浓度较低时,分子离子峰占比增大,随着化合物浓度的进一步降低,大多数化合物以裂解离子的方式被检出,而在痕量浓度下,其他组分的信号低于仪器检测限,只有分子离子的信号能被检出。
2.3.2 化合物浓度对各组分同位素化合物相对检出效率的影响
C、H、O 的同位素元素广泛存在于自然界中,在一定条件下,同位素化合物间的比例是相对稳定的。以各同位素组中检出峰面积最大组分的峰面积为100%,对各同位素化合物检出峰面积相对丰度的分析结果显示,在检测体系中,裂解离子组、分子离子组、加和离子组、双分子和三分子聚合物组中各同位素化合物检出峰面积的相对丰度整体表现为随检测体系中STV浓度梯度的增大而不断提高(表5)。
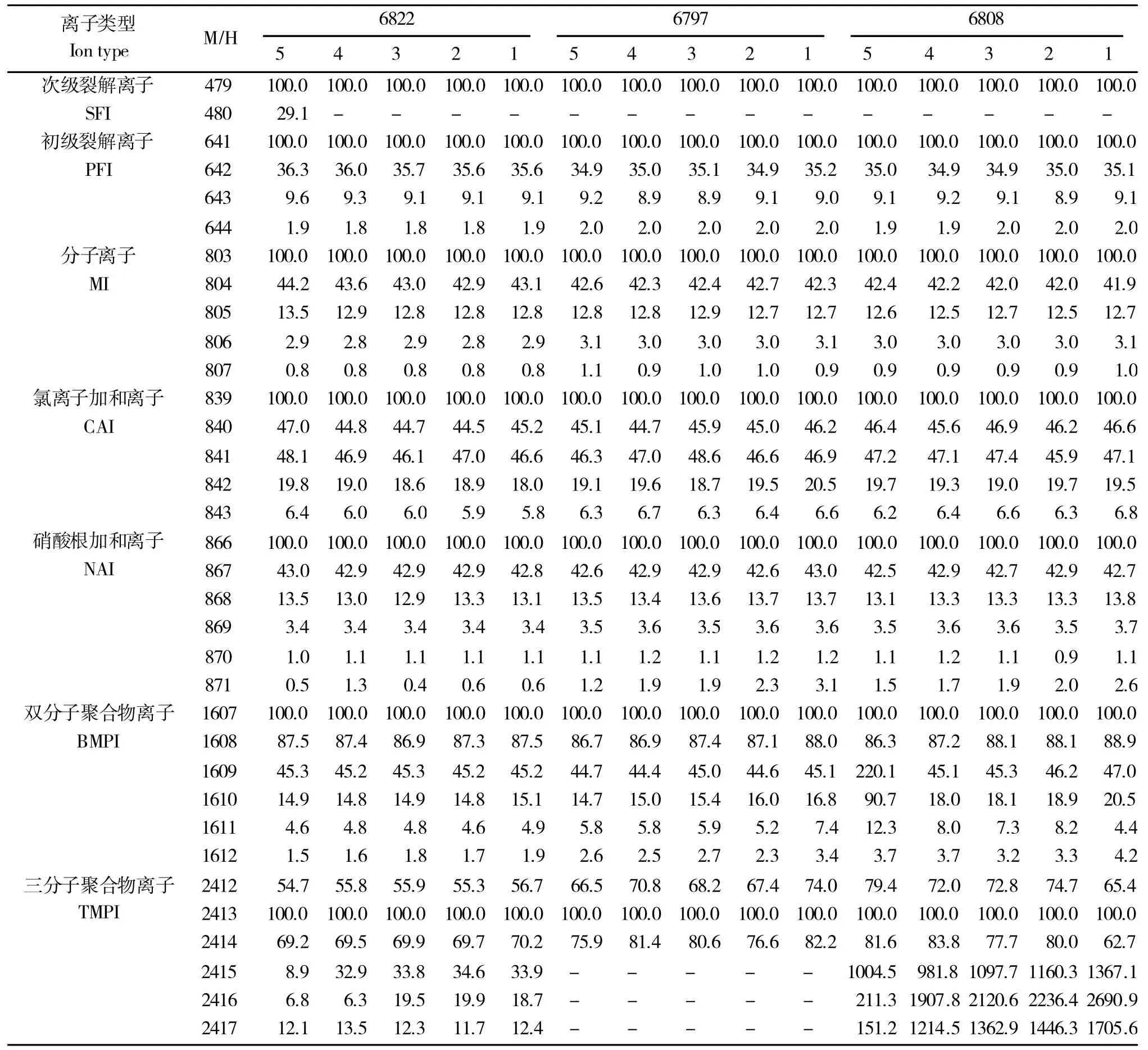
表5 STV 各组分同位素离子检出效率随进样浓度梯度变化情况Table 5 Detection efficiency of isotopiccomponent of STV varies with the gradient of concentration in samples
对于混合体系中浓度较低的化合物RE,随着所检测样品中RE浓度的降低,离子体系中占比较低的裂解离子组、双分子和三分子聚合物组中同位素化合物的检出峰面积的相对丰度波动幅度较大(表6)。
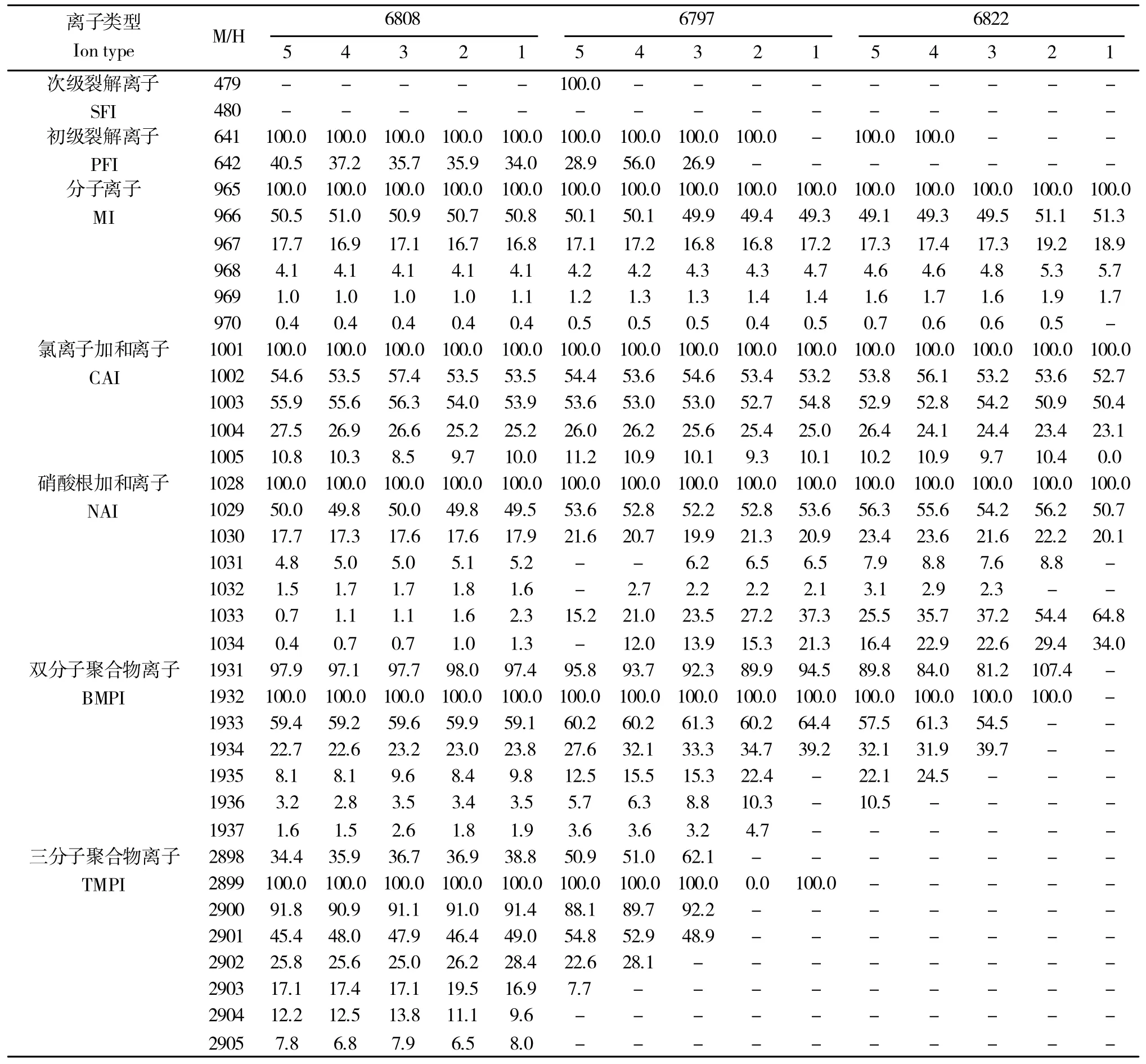
表6 RE 各组分同位素离子检出效率随进样浓度梯度变化情况Table 6 Detection efficiency of isotopic component of RE varies with the gradient of concentration in samples
对于混合体系中处于痕量的化合物RO,随着所进样样品中RO 浓度的降低,在所属化合物离子体系中占比较低的裂解离子组、双分子聚合物组中同位素化合物检出峰面积的相对丰度波动幅度远大于STV和RE者(表7)。

表7 RO 各组分同位素离子检出效率随进样浓度梯度变化情况Table 7 Detection efficiency of isotopic component of RO varies with the gradient of concentration in samples

续表7 Continued Table 7
2.4 甜菊糖苷类化合物的LC-MS定量策略
在植物化学形态学研究中,由于所面临的研究对象为作物收获器官,其所含化合物种类繁多,为更全面地解析化学组分间的有机联系,探讨化合物的形成、积累、转化机制,需要更广泛地采集收获器官所含化合物的定性定量信息。在正常情况下,目标器官内相对含量高于10.0%或1.0%以上的化合物种类较少,绝大多数的化合物含量多低于1.0%及0.1%以下。为更全面地解析化学组分间的有机联系,需要对目标器官所含化合物相对全面地进行定量,即需要建立一种适用于植物化学形态学分析的化合物定量策略,要求所定量的化合物含量分布范围广,相对含量从10.0%以上到0.1%以下。
结合甜叶菊育种和栽培实际,为建立一种甜菊叶源甜菊糖苷类化合物的LC-MS 定量策略,本研究以叶内各甜菊糖苷组分及含量差异大的甜叶菊品系现蕾期叶片为材料,采用梯度稀释、等体积进样方法,采集分析归宿各甜菊糖苷类化合物的质荷≥M/2的裂解碎片、单分子、加和离子、双分子聚合物和三分子聚合物等组分及其同位素化合物的检出峰面积信息随样品进样浓度梯度的线性相关分析,以建立利用LC-MS对各化合物进行定量的化学计量方法。
由于LC-MS具有一定的检测限,当代表某种化合物的离子信号强度低于背景值10 倍以下时,仪器就无法对相关化合物进行定量。从表5~表7可以看出,归属各甜菊糖苷组分可定量检出的离子种类随所检样品中各甜菊糖苷组分浓度的不同而不同。总体表现为,当样品中化合物浓度较高时,除分子离子外,可定量检出的离子种类有各级裂解离子、加和离子和聚合物离子;随着所检样品中化合物浓度的降低,依次消失的离子信号为:三分子聚合物离子、双分子聚合物离子、次级裂解物离子、初级裂解物离子、硝酸根加和离子、氯离子加和离子;当化合物浓度降低至痕量时,直至最后才消失的可定量检出离子信号为分子离子。基于此,为建立一种适用于化合物含量分布范围广的定量策略,宜选用分子离子信号作为定量的主要依据。
表8 的结果表明,三分子聚合物离子、双分子聚合物离子、次级裂解物离子、初级裂解物离子、氯离子加和离子类型的离子峰面积信息在化合物浓度过低时都会出现缺失,即LC-MS系统对这些类型的离子信息只有在化合物浓度足够高时才能定量检出,若以这些类型的离子峰信息作为相关化合物的定量依据,其定量限高,无法满足植物化学形态学研究对植物收获器官中广泛存在的含量较低化合物进行有效定量的要求。
相对地,分子离子组、分子离子同位素组和各类离子类型的总和3种检出峰面积参数为与本研究所涉甜菊叶样品所含12 种甜菊糖苷类化合物浓度梯度密切相关的组分类型,这3 种类型的峰面积信息在各类型样品中都稳定存在,且与化合物的浓度梯度呈线性相关。为此,可以选用这3种离子峰面积信息作为各甜菊糖苷类化合物的定量依据。在此3 种离子峰面积信息中,又多以各检出峰面积的总和与化合物浓度梯度间相关性更强。基于表8所展示的数据,在利用LC-MS 对各化合物进行定量时,宜采用所有类型离子的检出峰面积总和为参数,若因此参数的获取所要求的数据准备和统计工作量较大,可退而求其次地选用分子离子同位素组检出峰面积为参数。
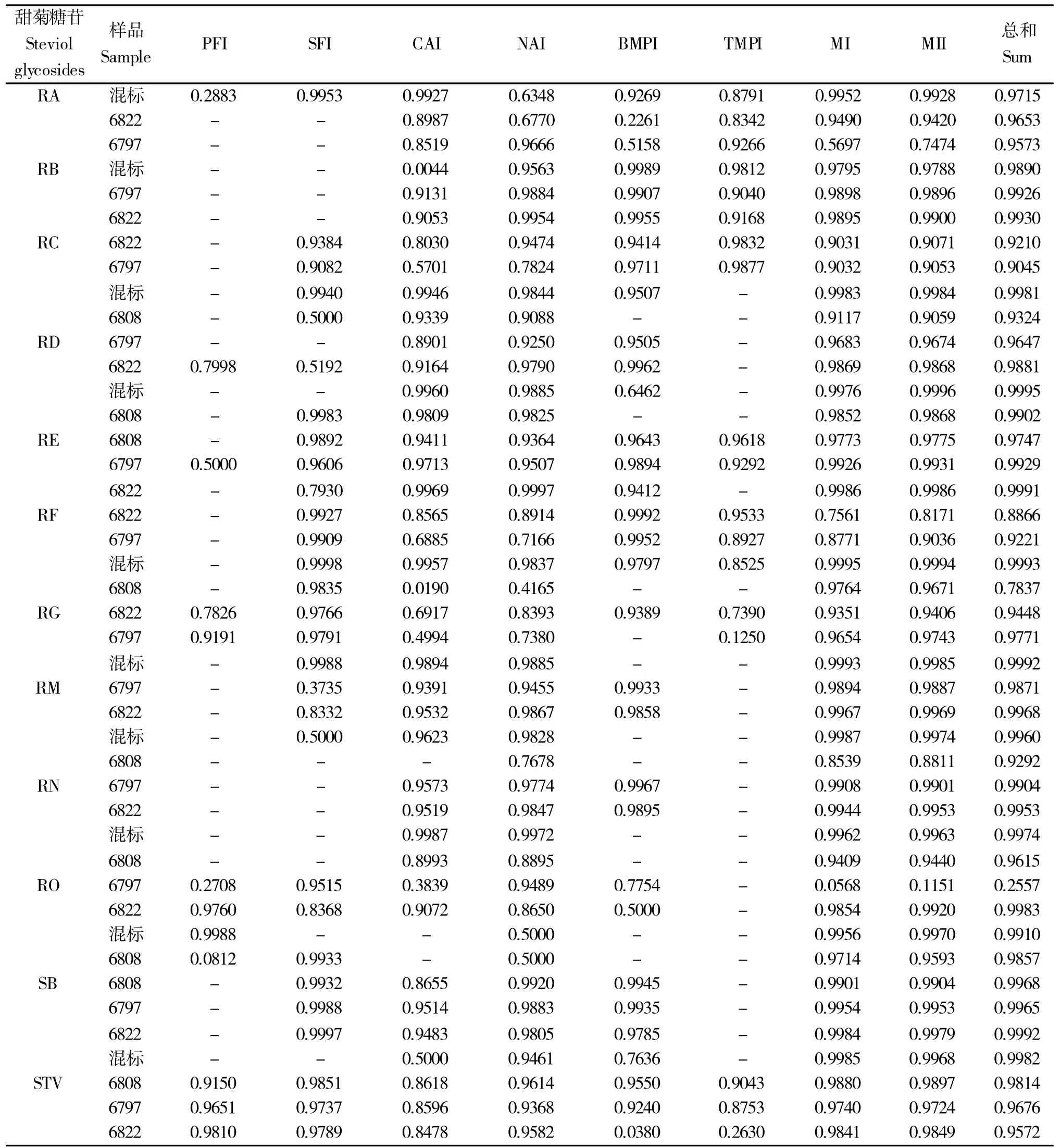
表8 甜菊糖苷类化合物各组分检出峰面积与样品进样浓度梯度的线性相关系数(r2)Table 8 Linear correlation coefficient between peak area of each component of steviol glycosides and the gradient of concentration in samples
另外,由于甜菊叶内甜菊糖苷类化合物种类繁多,目前已知的甜菊糖苷类化合物近50余种,在本研究中我们注意到,在现有分离检测体系下,甜菊糖苷化合物分离峰间(如RA和STV)存在交叉叠加现象,且存在具有相同m/z值的组分峰,这导致相关组分峰在归宿性分析时存在混淆,在此情况下,当化合物浓度较高时(如‘6808’、‘6797’和‘6822’中的STV),可选用与化合物浓度梯度相关性较好的硝酸根加和离子峰面积或双分子离子峰面积等信息建立定量关系式。
3 讨论与结论
本研究结果表明,在混合体系中,化合物除以分子离子的方式存在外,还以加和离子、双分子及三分子聚合物等方式存在。现有LC-MS 定量方法中,多以LC-MS/MS 定量为准,其基本原则是多只依据可以裂解为特定的初级裂解离子或次级裂解离子的分子离子的量作为定量依据[8-10]。仅以分子离子峰或已裂解为特定的初级或次级裂解离子的分子离子峰面积进行的定量分析结果与化合物浓度间相关性差,其余各组分所占比例也依化合物浓度不同存在较大波动,都不宜单独作为相关化合物的定量依据。
为此,本研究的意义体现在,通过对归属各甜菊糖苷化合物各组分离子及其同位素化合物定量检出峰面积信息与化合物浓度梯度间的相关性所进行的较为全面的考察,揭示了归属同一甜菊糖苷化合物的任何单一组分离子及其同位素化合物离子的定量检出峰面积信息都会因化合物浓度不同而存在较大波动,不宜单独作为LC-MS定量依据。在此基础上,进一步提出应以相关化合物的检出各组分离子定量检出峰面积信息的总和作为其LC-MS 定量依据,这样建立的定量体系更适用于对混合体系中含量差异大各化合物的表征,更有利于植物化学形态学研究对作物收获器官所含含量分布范围广的各化合物的全面解析,利于阐明各化学组分间的有机联系,为作物品质育种亲本选配及栽培管理措施评价提供更为可靠的数据分析方法。

