PPAR-α的激活对心力衰竭早期心肌功能的机制研究
王理亚,单艳华,刘永萍,孙丁
能量代谢的改变在心力衰竭(heart failure,HF)的进展中起重要作用[1],在健康人群中,脂肪酸的氧化作用提供了心脏所需ATP 的70%,其余的大部分来自丙酮酸的氧化,而丙酮酸的氧化作用与糖酵解和乳酸的氧化作用大致相等[2-3]。而晚期心力衰竭患者的心脏丧失其代谢灵活性,并且在很大程度上依赖于葡萄糖氧化,而不是依赖于作为优先代谢底物的脂肪酸氧化(FAO)[4]。但是,目前尚不清楚这种代谢重塑是导致HF 发生和发展的适应性机制还是适应不良的过程。
过氧化物酶体增殖物激活受体(PPARs)是配体激活的核受体超家族的成员,并且是控制心肌线粒体FAO 能力的关键转录调节因子[5]。PPAR 包含PPAR-α,PPAR-β/和PPAR-γ的三个成员,其中PPAR-α 在心肌细胞中高表达,并通过该途径中编码关键蛋白的基因的转录激活来调节脂肪酸摄取、酯化和氧化等关键成分的表达[6-7]。已有研究表明,PPAR-α 的缺乏会导致对慢性压力超负荷心衰肥大性生长和心脏功能障碍,这表明PPAR-α 会减轻压力超负荷后的心脏重构[8]。相反,PPAR-α(MHPPAR-α)的过度表达会引起脂质蓄积,尤其是在糖尿病心脏中,进而导致心肌病的发生[9]。有研究表明,压力过载HF后PPAR水平下降[10]。
2018 年1 月至2020 年1 月,我们使用诱导型转基因模型,使用横向主动脉缩窄(TAC)手术造模压力超负荷诱导的心脏肥大和HF 的小鼠模型,研究PPAR-α的表达的对HF进展期的影响及初步机制。
1 材料与方法
1.1 小鼠造模将C57BL/6 雄性小鼠用作野生型,将血凝素标记的小鼠PPAR-α cDNA 亚克隆到pTet-Splice(Invitrogen)的HindⅢ位点,切下DNA 片段并用于原核注射。通过PCR 鉴定为阳性后,将其繁殖到C57BL/6小鼠以产生稳定的Tg系(TRE-PPAR-α),以模拟在心力衰竭早期PPAR-α 的激活。同时准备C57BL/6α-MHC-四环素反式激活因子(tTA)小鼠作为阴性对照。对十周龄的小鼠进行TAC 手术,使用小型动物呼吸器(SN-480-7)对动物进行气管插管和通气,并添加1.0%的异氟烷吸入以维持麻醉状态。于胸部左侧第二肋间处开胸,将一条7-0的丝线穿过无名颈动脉和左颈总动脉之间的横向胸主动脉,并用28号针头在主动脉周围打结。结扎后,迅速拔出针头并闭合皮肤。假手术组行同样操作,但不结扎。将20 只C57BL/6 小鼠按随机数字表法随机分为TAC-DTG 组(行TAC 手术的双转基因小鼠)、TACtTA组(行TAC手术的tTA单转基因阴性对照小鼠)、Sham-DTG组(假手术的双转基因小鼠)、Sham-tTA组(假手术的tTA 单转基因阴性对照小鼠),每组5 只。研究起止时间为2018年1月至2020年1月。
1.2 经胸超声心动图吸入1%异氟烷麻醉后,使用配备18~38 MHz 探头的Visual Sonics Vevo 2100进行超声心动图分析。在胸骨旁短轴视图中评估左心室收缩末期或舒张末期分别定义为左心室面积最小或最大的阶段。从乳头肌以LVM 型描记法测量左心室舒张末期内径(LVDd)、舒张期LV 后壁(LVPWd)及射血分数(EF)。
1.3 RT-PCR使用TRIzol 从心脏中分离总RNA。使用Prime Script RT 试剂盒对总RNA 进行逆转录,使用SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)和Thermal Cycler Dice 实时系统进行定量实时逆转录PCR(RT-PCR)。根据转录起始因子的表达水平将靶基因的表达水平标准化。RT-PCR 的引物序列如表1所示。

表1 RT-PCR中引物序列
1.4 Western blotting 检测使用RIPA 裂解液获得心肌总蛋白,通过BCA 蛋白质浓度测定法确定心肌样品的蛋白质浓度。取40 μg 蛋白与上样缓冲液混合均匀后与沸水中加热5 min,在5%Tris-甘氨酸SDS-聚丙烯酰胺凝胶上,150 V 电泳分离1 h 后,将蛋白转移至PVDF 膜,用5%脱脂奶粉室温封闭1 h后,清洗数次,于4 ℃下与各一抗溶液(1∶1 000)共孵育过夜。以TBST清洗三次,每次5 min,清洗完成后,于室温下同二抗(1∶2 000)共孵育两小时,以TBST 清洗3 次,每次10 min,除去二抗残留液后,使用ECL Western blotting 检测试剂盒检测化学发光并于Image J 进行检测。使用的抗体有PPAR-α,GAPDH及肌动蛋白抗体。
1.5 心肌高能磷酸盐测定将心脏组织用冷冻钳于液氮中预冷。将冷冻样品保存在液氮中并冻干过夜。然后将10 mg 冻干的组织加入0.6 N 冰冷的高氯酸溶液(适量),匀浆,并在4 ℃下以500 g 离心10 min。上清液以氢氧化钾中和至pH 为5.0~7.0。10 min 后将提取物离心以除去高氯酸钾,并将上清液用于检测。磷酸肌酸,肌酸,三磷酸腺苷(ATP),二磷酸腺苷(ADP)和单磷酸腺苷(AMP)采用高效液相色谱法测定,分析柱为STR ODS-M C-18色谱柱。
1.6 离体心脏灌流以1.0%的异氟烷吸入麻醉小鼠,取下心脏并浸入预冷的Krebs-Henseleit 缓冲液中,随后进行主动脉插管。离体的小鼠心脏在Langendorff 模式下于37 ℃在80 mmHg 的恒定灌注压力下进行灌注。灌注液为Krebs-Henseleit 缓冲液,其中含有1 mmol 乳酸、5 mmol 葡萄糖、1.2 mmol 棕榈酸酯、3%的牛血清白蛋白和2.5 mmol 的游离钙离子,以95%氧气和5%二氧化碳(pH 为7.4)平衡。用含有[U-14C]葡萄糖和[9,10-3H]棕榈酸酯的灌注液对心脏灌注20 min。通过分别从[U-14C]葡萄糖和[9,10-3H]棕榈酸中定量收集14CO2和3H2O 来确定葡萄糖的氧化和棕榈酸的氧化。
1.7 统计学方法采用SPSS 17.0进行统计分析。观测资料主要是计量数据,以表示,采用t检验进行两组比较。对单时间点的多组比较采用one-way ANOVA分析,对多个时间点的多组比较进行重复测量ANOVA分析。P<0.05表示差异有统计学意义。
2 结果
2.1 PPAR-a表达对压力超负荷所致HF心脏功能的影响为了确定PPAR-α 是否能够减轻压力超负荷HF中的心脏功能障碍,在10周龄时对tTA单转基因小鼠和PPAR-α DTG小鼠进行TAC手术。在12周龄时,多西环素(DOX)不再添加到饮用水中。我们评估了TAC术后0、4、6和8周时TAC心脏中PPAR-α诱导表达的时间过程。蛋白质印迹分析显示,TAC手术后PPAR-α表达的降低在PPAR-α双转基因(TG)小鼠中显著减弱[术后0、4、6、8周分别为(1.00±0.03)、(0.90±0.08)、(0.66±0.09)、(0.58±0.05)]。TAC手术后8周,DTG小鼠中PPAR-α及其靶基因的mRNA表达显著升高。tTA和DTG小鼠在TAC手术后第8周的收缩压相似(98.7/2.9 mmHg 比95.8/3.0 mmHg)。超声心动图分析显示,与tTA小鼠相比,TAC后8周,DTG小鼠的LV收缩功能得到了显著保留。左室扩张也通过诱导PPAR-α的表达而明显减弱。这些结果表明,在压力超负荷HF期间PPAR-α的激活可改善心脏收缩力并减少LV扩张。表2、表3、图1。
表2 TAC术后8周时TAC组与Sham组小鼠PPAR-α及其靶基因的mRNA表达水平比较/
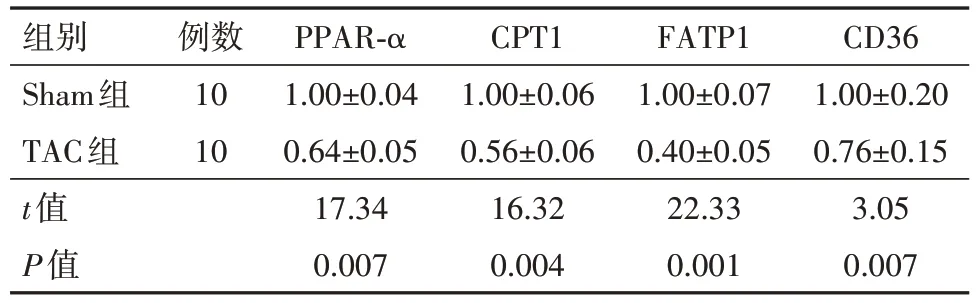
表2 TAC术后8周时TAC组与Sham组小鼠PPAR-α及其靶基因的mRNA表达水平比较/
注:PPAR-α为过氧化物酶体增殖物激活受体-α,CPT1为肉毒碱棕榈酰转移酶1,FATP1为脂肪酸转运蛋白1。
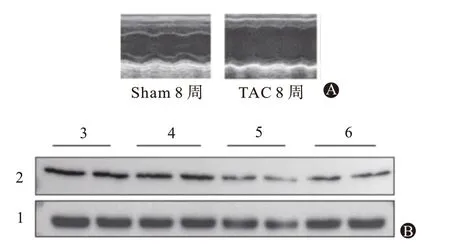
图1 PPAR-α的激活改善压力超负荷心力衰竭中的心脏功能障碍:A为PPAR-α的激活;B为TAC手术后PPAR-α的表达与时间关系
表3 TAC术后8周TAC组与Sham组小鼠LVDd、LVPWd、EF水平比较/
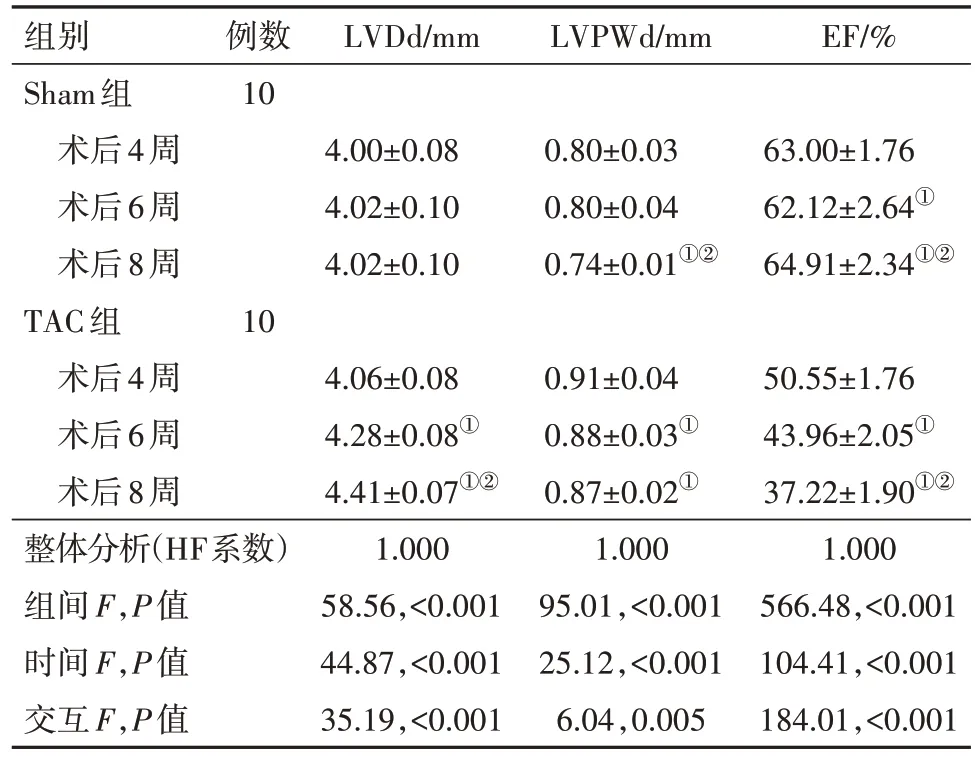
表3 TAC术后8周TAC组与Sham组小鼠LVDd、LVPWd、EF水平比较/
注:LVDd为左心室舒张末期内径,LVPWd为舒张期LV后壁,EF为射血分数。①与术后4 W时比较,P<0.05。②与术后6 W时比较,P<0.05。
2.2 PPAR-α 的表达对压力超负荷HF 心脏重塑的影响TAC 手术后8 周,与tTA 心脏相比,DTG 小鼠的心脏质量与体质量之比和心脏质量与胫骨长度之比的增长趋势减弱。在DTG 心脏中,肺质量与体质量之比的增加也减弱(表4),表明诱导PPAR-α 表达可减轻压力超负荷肥大并改善了压力超负荷HF。通过在DTG 小鼠中TAC 诱导的心肌细胞横截面积增加的减少确定组织肥大的减少(表5、图2A 和2B)。为了测试PPAR-α 表达对心肌纤维化的作用,采用Masson Trichrome 染色,并通过LV 切片的组织学分析表明,在DTG 小鼠中,TAC 诱导的心肌纤维化明显减少(表5、图2C),同时分析纤维化相关基因的mRNA 表达,观察到PPAR-α 的表达显著减弱了TAC 诱导的I 型胶原α1(Col1a1)和Col3a1 mRNA 水平。PPAR-α 的表达也改善了B 型利钠肽和心钠素的增加(表6)。总体而言,这些结果表明压力超负荷HF 期间的PPAR-α 的表达可明显减弱心脏重塑并改善了HF的进展。
表4 TCA术后8周tTA组与DTG组小鼠HB/BW、HW/TL、LW/TL水平比较/
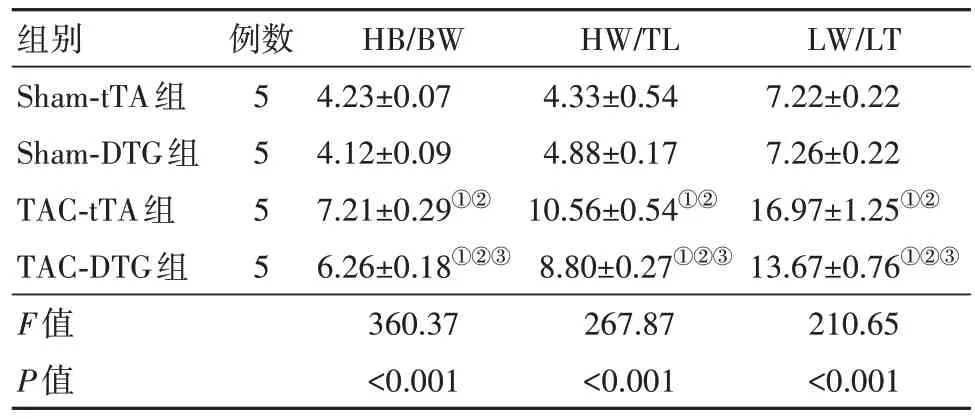
表4 TCA术后8周tTA组与DTG组小鼠HB/BW、HW/TL、LW/TL水平比较/
注:HB/BW 为心脏质量/体质量,HW/TL 为心脏质量/胫骨长度,LW/TL为肺部质量/胫骨长度。①与Sham-tTA 组比较,P<0.05。②与Sham-DTG 组比较,P<0.05。③与TAC-tTA组比较,P<0.05。
表5 TCA术后8周tTA组与DTG组小鼠心肌细胞横截面积、心肌纤维化程度水平比较/

表5 TCA术后8周tTA组与DTG组小鼠心肌细胞横截面积、心肌纤维化程度水平比较/
注:①与Sham-tTA 组比较,P<0.05。②与Sham-DTG 组比较,P<0.05。③与TAC-tTA组比较,P<0.05。
表6 TCA术后8周tTA组与DTG组小鼠BNP、Col1a1、Col3a1 mRNA水平比较/
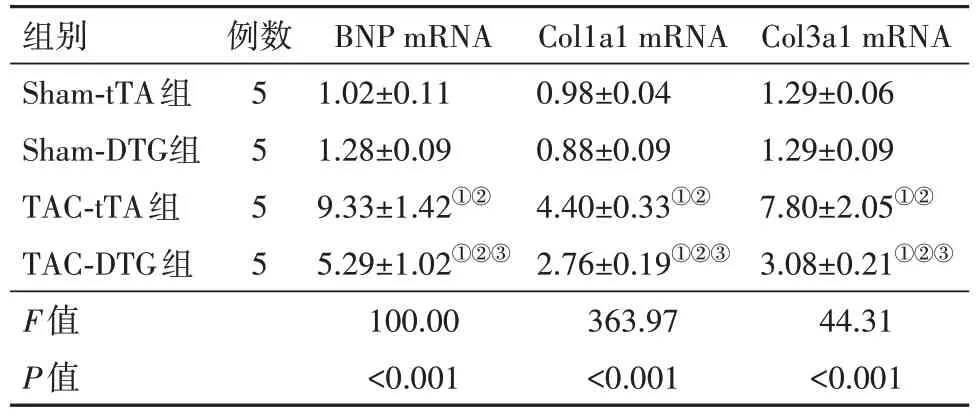
表6 TCA术后8周tTA组与DTG组小鼠BNP、Col1a1、Col3a1 mRNA水平比较/
注:BNP为脑钠肽,Col1a1为Ⅰ型胶原α1,Col3a1为Ⅲ型胶原α1。①与Sham-tTA 组比较,P<0.05。②与Sham-DTG 组比较,P<0.05。③与TAC-tTA组比较,P<0.05。
2.3 PPAR-α 对心脏FAO 及心肌能量的影响进一步考察PPAR-α 表达诱导的底物利用率和心肌能量的变化。TAC 手术后5 周,对心脏组织进行了HPLC 分析,以确定由PPAR-α 表达引起的高能磷酸盐代谢的变化。与tTA 单转基因小鼠相比,具有PPAR-α 诱导作用的DTG 小鼠在TAC 诱导的HF 中,其ATP 浓度和磷酸肌酸与ATP 比率显著提高(表7)。通过离体心脏灌注研究体外TAC 心脏中PPAR-α 表达对底物利用率的影响。在基线时,与tTA 单转基因小鼠相比,DTG 小鼠的FAO 表达量显著增加,同时葡萄糖氧化也相应降低。TAC 手术后8 周,两组的FAO 和葡萄糖氧化均有所降低,但与tTA组相比,DTG组的FAO比率显著保留(表8)。综上所述,HF 期间的PPAR-α 的激活可调节HF 心脏的代谢利用,特别是增强FAO和改善心肌能量。
表7 TCA术后5周tTA组与DTG组小鼠ATP、磷酸肌酸/ATP水平比较/
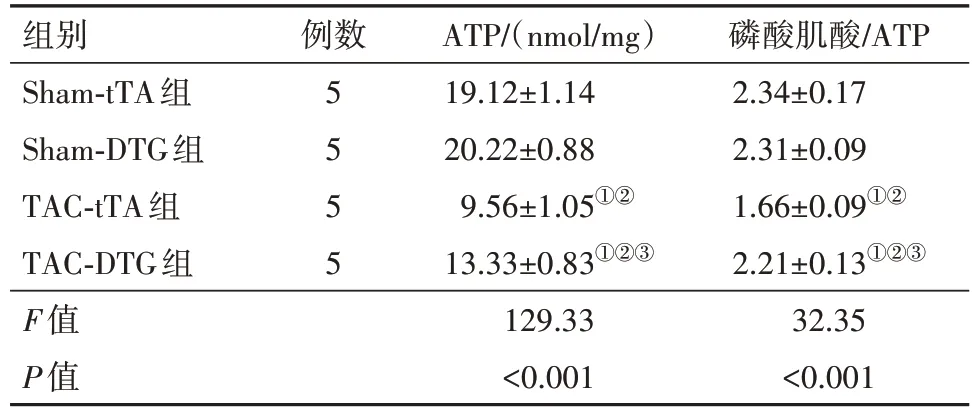
表7 TCA术后5周tTA组与DTG组小鼠ATP、磷酸肌酸/ATP水平比较/
注:ATP为三磷酸腺苷。①与Sham-tTA 组比较,P<0.05。②与Sham-DTG 组比较,P<0.05。③与TAC-tTA组比较,P<0.05。
表8 TCA术后8周tTA组与DTG组小鼠棕榈酸氧化速率、葡萄糖氧化速率水平比较/
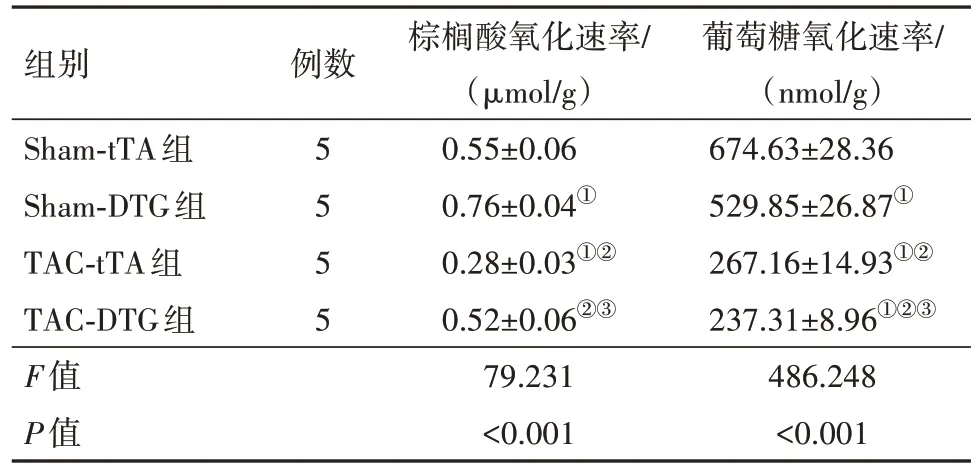
表8 TCA术后8周tTA组与DTG组小鼠棕榈酸氧化速率、葡萄糖氧化速率水平比较/
注:①与Sham-tTA 组比较,P<0.05。②与Sham-DTG 组比较,P<0.05。③与TAC-tTA组比较,P<0.05。
3 讨论
在本研究中我们通过诱导型转基因小鼠模型评估了PPAR-α 过表达在HF 进展期影响,发现HF期间PPAR-α 的激活减弱了心脏功能障碍和HF 进展,导致心脏重塑的减弱,HF 期间PPAR-α 的活化维持了FAO和心肌的能量。
除缺血性心脏病外,高血压或主动脉瓣狭窄引起的压力超负荷仍是心衰的最常见原因[11]。在成年心脏中,FAO 是ATP 产生中大部分碳底物的来源[4]。相反,肥大的心脏比FAO 更依赖于葡萄糖氧化,因为葡萄糖氧化的效率要比FAO 高,对于等量的ATP,所需的氧气要少11%~12%,然而FAO 生产的三磷酸腺苷比葡萄糖氧化产生的三磷酸腺苷要多得多,补偿性肥厚性HF 向无补偿性肥厚性HF 的演变所致对葡萄糖氧化的更大依赖[12]。本研究表明在肥大心脏中调节FAO 可以延迟其发展为无代偿性HF,肥厚性HF 期间由PPAR-α 过表达诱导引起的FAO轻度增强可维持心脏功能和心肌能量。
PPAR-α 是控制参与FAO 的基因表达的核受体,是心脏底物利用的关键调节剂[13-14]。研究表明,在压力过载HF 期间,PPAR-α 表达水平会降低。同时,用PPAR-α 激动剂非诺贝特治疗可显著改善压力超负荷HF 中的左室肥大和心脏功能[15-16],但对PPAR-α 转基因小鼠的研究表明,增强的FAO 对心肌有害[17]。因此,我们假设在晚期心力衰竭(FAO期减少)中诱导PPAR-α 会对心脏产生积极影响。PPAR-α,PPAR-β 和PPAR-γ 这三个PPAR 亚型具有相似的功能,并且彼此存在相互作用。因此,我们使用了四环素诱导表达系统,而不是使用其他方法来仅激活小鼠心脏中的PPAR-α。
使用特定的PPAR-α 激动剂WY-14643 对大鼠压力超负荷的心脏进行的研究表明,肥大心脏中的PPAR-α 激活会严重损害心脏功能[18]。在本研究中,在HF 进展阶段,PPAR-α 的激活有利于维持心肌的FAO 和高能磷酸盐的代谢,从而降低了葡萄糖的氧化,DTG 小鼠中维持的能量能改善心脏收缩力和HF 的进展。这些结果表明,在HF 的进展阶段(能量饥饿阶段)PPAR-α 的慢性活化可以维持心肌的FAO 和能量,从而对肥大HF 的进展具有积极作用。
β 受体阻滞剂被证实可以显著改善HF 患者的左室功能和预后,并且还可能对心脏产生间接代谢作用[19]。调节底物利用率可能是治疗HF 患者的有前途的策略。在临床试验中,PPAR-α 激动剂贝特类药物对冠状动脉粥样硬化有积极作用[20],降低了发生重大心血管事件的风险,但对HF 的风险没有影响[21]。我们在小鼠中的研究结果表明,PPAR-α的轻度激活,特别是在通过诱导PPAR-α 表达,可能对HF有积极作用。
综上所述,本研究发现在心力衰竭期间激活PPAR-α 可以通过调节FAO 维持早期心肌能量,并减轻压力超负荷心力衰竭的心脏重塑,因此在肥厚性HF 患者中,使用心肌闪烁显像或超声心动图确定能量饥饿阶段并在此阶段激活PPAR-α,进而激活FAO可能是治疗HF有效策略。
(本文图2见插图4-2)

图2 PPAR-α的激活对HF心脏重塑的影响:2A为苏木精曙红染色的代表性图像;2B为心肌细胞横截面代表性图像(小麦胚芽凝集素染色×500);2C为Masson Trichrome染色的代表性图像(Masson Trichrome染色×200)

