不同种源多花黄精炮制过程化学成分的变化
梁焕焕,贾全全,朱灵芝,黄丽莉,朱培林,★
(1.江西农业大学·林学院,江西 南昌 330045;2.江西省林业科学院,江西 南昌 330013;3.南昌市中药材种植技术与质量研究重点实验室,江西 南昌 330013)
多花黄精(Polygonatum cyrtnema Hua.)是百合科黄精属多年生草本植物,与黄精(P. sibiricum Red.)、滇黄精(P. kingianum Coll.et Hemsl.)一起收录在中国药典,是传统食药两用的大宗药材[1]。多花黄精广泛分布于长江以南大部分地区,主要分布区有安徽、浙江、江西、湖北、湖南、福建、四川等地,生长于山坡阴处、林下、灌丛中,喜湿、忌积水[2]。
鲜黄精对咽喉有一定的刺激性,传统黄精均对其进行加工炮制后入药或食用,目前黄精的炮制方法多种多样,炮制参数各不相同,炮制前后外观、口感、化学成分和药理活性均有不同程度的变化[3]。历代名医典籍中记载的以九蒸九制炮制法最为常见[4-6]。马佳丽等[7]通过对九蒸九制多花黄精炮制过程变化的研究得出:随着炮制次数增加,多花黄精根茎颜色由浅变深,干重变化为先下降后逐渐趋于平缓,多糖则先增加后下降并逐渐趋于平缓。张洪坤等[8]在研究黄精九蒸九制过程中有效成分含量的变化情况得出:多糖含量明显下降,皂苷含量则呈上升趋势。为了使炮制黄精的药效得到最大利用,可以对多花黄精不同蒸制次数和蒸制时间的化学成分变化进行对比,以此找出不同含量达到最大所需的最佳炮制工艺[9]。
现代研究表明黄精多糖和皂苷类物质是黄精中重要的成分,可明显提高小鼠免疫功能[10-12],黄酮类化合物具有抗肿瘤、抗病毒、防衰老、抗菌消炎、防动脉粥样硬化以及保护心脑血管等功能[13-15],而总酚类物质具有较好的抗氧化性[16]。黄精炮制后化学物质含量会发生相应的变化,同时产生了一些新的物质,炮制后的多花黄精具有减毒增效的作用[17]。以往黄精九蒸九制含量变化的研究主要集中在多糖、皂苷、浸出物以及5-羟甲基糠醛等方面,关于总黄酮及总酚含量变化的研究未见报道。本研究参考传统的蒸制方法,使用高压蒸汽锅进行蒸制,分析九次蒸制后多花黄精的多糖、总皂苷含量变化情况,并且增加了炮制前后总黄酮和总酚含量的变化,以期为建立炮制多花黄精多指标质量评价模式提供理论依据,也为多花黄精的开发利用及优良种源选择提供参考。
1 试验材料
于2020年10 月21 日采自江西省安福县的4 批多花黄精鲜品,经江西省林业科学院朱培林研究员鉴定为百合科黄精属多花黄精根茎。其中安福种源的多花黄精分别有宽叶与窄叶2个类型,生长年限为4 a,安徽九华山和湖南怀化种源的多花黄精为宽叶类型,生长年限为3 a,详细信息见表1。
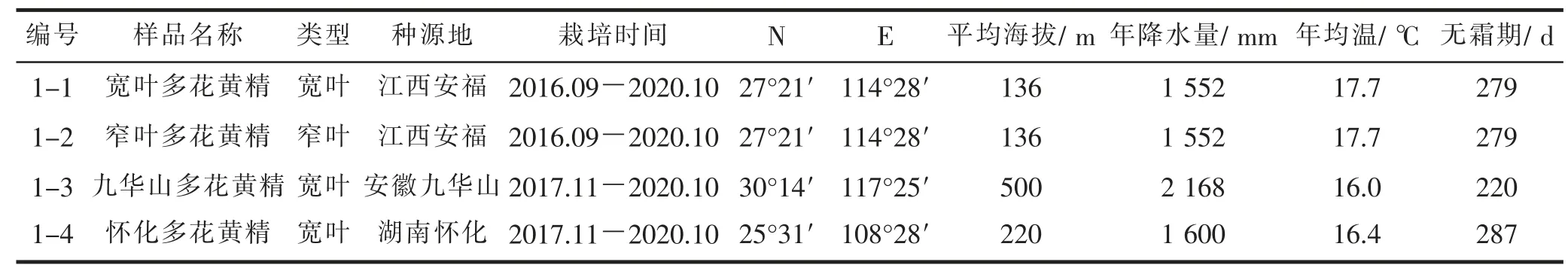
表1 不同种源多花黄精地理气候因子概况Tab. 1 A survey of geographical and climatic factors of P. cyrtnema from different provenances
2 方法
2.1 仪器与试剂
中药粉碎机(永康市金穗机械制造厂);ENXTN 电热恒温鼓风干燥箱 (上海森信实验仪器有限公司);MB35 水分测量仪(OHAUS);MS105DU 电子分析天平(梅特勒-托利多仪器上海有限公司);N-1300 旋转蒸发器(上海爱朗仪器有限公司);SP-752 紫外可见分光光度计(上海光谱仪器有限公司)。
葡萄糖(B21882)、芦丁(B20771)、人参皂苷 Rb1(B21050)、没食子酸(B20851),纯度≥98 %,均购于上海源叶生物科技有限公司;无水乙醇、硫酸、冰醋酸、亚硝酸钠、氢氧化钠、碳酸钠等分析纯均购于西陇科学股份有限公司,蒽酮(AR,Cool chemical science and technology(Beijing) Co. Ltd.),香草醛(AR,上海麦克林生化有限公司),高氯酸(AR,天津政成化学制品有限公司),硝酸铝(AR,上海展云化工有限公司),福林酚(BR,国药集团化学试剂有限公司)。
2.2 取样、炮制
样品洗净并除去须根,待表面水分晾干,称重,取一定量的样品作为0 蒸样品,将剩余鲜品放置高压锅中蒸至透心(约2~3 h),从中取出少量多花黄精1 蒸样品,称重并切片,放置烘箱中60 ℃烘干至恒重,将剩余样品放置烘箱烘至表面微干,取出,继续放置锅中蒸制第2 次;依照此法依次进行2~9 次蒸制并取样,且2~9 次蒸制时间均为2 h,所有样品烘干至恒重后打粉过4 号筛,备用。随蒸制次数的增加多花黄精颜色逐渐变深(图1)。

图1 九蒸九制多花黄精粉末图Fig. 1 Nine steamed nine P. cyrtnema essence powder diagram
2.3 多糖含量测定
黄精多糖含量测定参照2020 版《中国药典》(一部)[1]中的方法,各组重复测定3 次。测得回归方程为y=0.0415x+0.1659,R2=0.9911,在 0.0033~0.0198 mg·mL-1范围内线性关系良好。
2.4 总皂苷含量测定
2.4.1 对照品溶液配置
精密称取人参皂苷Rb1 对照品7.91 mg,置于25 mL 量瓶中,用80 %乙醇溶解并稀释至刻度,摇匀,即得浓度为0.316 mg·mL-1的人参皂苷Rb1 对照品溶液。
2.4.2 标准曲线制备
分别精密量取 0、0.1、0.2、0.3、0.4、0.5 mL 对照品溶液于10 mL 具塞干燥试管中,60℃水浴挥干溶剂,加入5%香草醛-冰醋酸溶液0.2 mL,摇匀,在冰水浴中加入0.8 mL 高氯酸,摇匀,冷却后于60℃水浴加热15 min,放入冰水浴2 min,加入5 mL 冰醋酸,摇匀,静置5 min,于540 nm 处测定吸光度,以80 %乙醇溶液为空白对照,以人参皂苷Rb1 对照品溶液浓度为横坐标,测定的吸光度为纵坐标,得回归方程y=0.0214x-0.0049,R2=0.9994,在 5.27~42.13 μg·mL-1范围内线性关系良好。
2.4.3 样品含量测定
精密量取样品粉末0.5 g,加入80%的乙醇溶液20 mL,60℃超声50 min,提取两次,将两次滤液合并定容至25 mL 量瓶中,用80%乙醇定容,精密量取0.1 mL 样品溶液按标准曲线方法测定,每个样品平行测定3 次,取平均值,计算总皂苷含量。
2.4.4 方法学试验
精密度、重复性、稳定性试验分别取对照品溶液1 mL,一式5 份,按2.4.2 项下制备方法操作,在540 nm 处测定吸光度,计算得出各RSD 值,分别为1.67%、0.84%、2.53%。
回收率试验:取多花黄精药材1 g,一式5 份,分别加入1 mL 对照品溶液,按2.4.2 项下制备方法操作,在540 nm 处测定吸收度,计算总皂苷平均加样回收率为101.96%,RSD 为1.09%。
2.5 总黄酮类含量测定
2.5.1 对照品溶液配置
精密称取芦丁对照品10 mg,置于50 mL 量瓶中,用70%乙醇溶解并稀释至刻度,摇匀,即得浓度为0.2 mg·mL-1的芦丁对照品溶液。
2.5.2 标准曲线制备
分别精密量取 0.5、1、1.5、2、2.5、3 mL 对照品溶液于10 mL 具塞干燥试管中,各加入70%的乙醇溶液5 mL,摇匀,依次加入5%的亚硝酸钠溶液0.3 mL,摇匀,静置6 min,加入10%硝酸铝溶液0.3 mL,摇匀,静置6 min,再加入4%氢氧化钠溶液4 mL,摇匀,放置15 min 后立即于510 nm 处测定吸光度。以芦丁对照品溶液浓度为横坐标,测定的吸光度为纵坐标,得回归方程 y=0.0136x+0.0149,R2=0.9997,在 10~60 μg·mL-1范围内线性关系良好。
2.5.3 样品含量测定
精密称取黄精细粉1 g,置于250 mL 圆底烧瓶中,加入70%的乙醇溶液20 mL,超声 (250 W,40 kHz)提取50 min,过滤,用70%乙醇定容至25 mL 容量瓶中。取5 mL 样品溶液,依2.5.2 项下制备方法测定其吸光度,并计算含量,每个样品平行测定3 次,取平均值。
2.5.4 方法学试验
精密度、重复性、稳定性试验分别取对照品溶液1 mL,一式5 份,按2.5.2 项下制备方法操作,在510 nm 处测定吸光度,计算得出各RSD 值分别为0.91%、2.82%、1.96%。
回收率试验:取多花黄精药材1 g,一式5 份,分别加入1 mL 对照品溶液,按2.5.2 项下制备方法操作,在510 nm 处测定吸收度,计算平均加样回收率为 97.85%,RSD 为 2.42%。
2.6 总酚类含量测定
2.6.1 对照品溶液的配置
精密称取没食子酸对照品5.58 mg,置于50 mL量瓶中,加入10 mL 的80%乙醇溶液。超声使其充分溶解,再用80%乙醇定容至40 mL,所得对照品溶液的浓度为 0.116 mg·mL-1,摇匀备用。
2.6.2 标准曲线制备
分别精密吸取对照品溶液 0.5、1、1.5、2.0、2.5、3.0 mL 置于10 mL 棕色容量瓶中,依次加入5.0 mL 离子水,摇匀,加入福林酚显色剂0.5 mL,充分振荡后静置5 min,加入15%碳酸钠溶液1.0 mL。摇匀,用去离子水定容至刻度,在室温下避光放置反应2 h。765 nm波长处测定吸光度,以没食子酸对照品溶液浓度为横坐标,测定的吸光度为纵坐标,得回归方程y=0.0905x+0.0065,R2=0.9991,在 1.1~9.9 μg·mL-1范围内线性关系良好。
2.6.3 样品含量测定
精密称取黄精样品1 g,加入80%乙醇10 mL,超声20 min,离心,提取2 次,取上清液定容至50 mL 容量瓶中备用。取2 mL 溶液,按照2.6.2 项下制备方法测定其含量。每个样品平行测定3 次,取平均值。
2.6.4 方法学试验
精密度、重复性、稳定性试验,分别取对照品溶液1 mL,一式5 份,按2.6.2 项下制备方法操作,在765 nm 处测定吸光度,计算得出各RSD 分别为0.84%、0.35%、0.80%。
回收率试验:精密称取多花黄精药材1 g,一式6份,分别加入1 mL 没食子酸对照品溶液,按2.6.2 项下制备方法操作,测定总酚含量,计算回收率,平均加样回收率为98.91%,RSD 为0.66%。
3 结果与分析
3.1 炮制多糖含量变化
炮制过程中多糖含量变化总体呈下降趋势,鲜样品多糖含量从高到低分别是江西安福的宽叶多花黄精13.54%>窄叶多花黄精9.48%>怀化多花黄精8.29%>九华山多花黄精7.38%。1 蒸后多糖含量显著降低,4个样品多糖含量分别下降了82.84%、73.92%、63.08%、61.94%。2 蒸之后多花黄精多糖含量变化平缓,基本稳定在2.60%~2.96%,且4个样品变化趋势一致(图2A)。

图2 不同种源多花黄精的各化学成分含量随蒸制次数变化Fig. 2 The contents of chemical components of P. cyrtnema from different provenances varied with steaming times
3.2 炮制总皂苷含量变化
炮制过程中总皂苷含量变化总体呈先上升后下降的趋势,九华山多花黄精1 蒸后含量有较明显的上升且达到最大值13.8%,江西安福的宽叶多花黄精、窄叶多花黄精、怀化多花黄精均在4 蒸后含量最高,最大值分别为13.1%、16.3%、13.5%(图2B)。
3.3 炮制总黄酮含量变化
炮制过程中总黄酮含量整体呈上升趋势,其中0~2 蒸缓慢上升,2~4 蒸黄酮含量变化较大,之后趋于平缓(图2C)。九华山多花黄精含量变化幅度最大为0.74%,而怀化多花黄精变化幅度最小为0.62%,除窄叶黄精在7 蒸后含量达到最高0.71%外,宽叶多花黄精、九华山多花黄精、怀化多花黄精均在6 蒸后含量最高,分别为0.69%、0.82%、0.71%。
3.4 炮制总酚含量变化
炮制过程中总酚含量整体呈上升趋势,其中0~2蒸缓慢上升,3 蒸含量明显升高,4 蒸之后含量变化略有起伏且逐渐趋于稳定(图2D)。九华山多花黄精含量变化幅度最大为2.73 %,而江西安福窄叶多花黄精变化幅度最小为1.94%,各总酚含量的最大值分别是2.21%、2.12%、2.89%、2.23%。
4 结论与讨论
本文通过分析同一种源地不同类型和不同种源地间多花黄精9 次炮制过程各化学成分含量的变化,结果初步揭示了同一种源地不同类型和不同种源地的多花黄精炮制过程化学成分变化规律具有一致性。但多花黄精的种源地及样品数量较少,不能涵盖多花黄精所有分布地区,需要扩大研究范围。此外多花黄精炮制后药材的外观、色泽及口感对食品开发也有较大的影响,因此可以对炮制后药材化学成分及外观等进行综合评价,以期为多花黄精的开发利用提供参考。
4种化学成分含量的变化达到稳定所需时间和蒸制次数均不相同,从多糖含量变化的情况得出,多花黄精炮制的最好方法为1 蒸;总皂苷含量在4 蒸后不再增加,炮制次数以4 次最佳;总黄酮含量4 蒸后变化逐渐变缓,6 蒸后趋于平稳,炮制次数以6 次最佳;总酚含量3 蒸之后逐渐趋于稳定,炮制最好方法为3 蒸。为了使多花黄精药材发挥更好的药效,可以针对不同化学成分需求来选择炮制的次数和时间。
本文采用高压蒸汽锅蒸制的多花黄精多糖含量在1 蒸后就不再有大幅度变化,说明高压蒸制1 次后对多糖含量而言已达到稳定,而许多古代典籍中常常记载的“九蒸九制”为常压蒸制,认为蒸制次数越多、时间越长品质越好。高压蒸制多花黄精,可以用更短的时间、更少的蒸制次数达到《食疗本草》《本草图经》等典籍中记载的性状特征[18-19]。王永禄等[20]研究的高压蒸制酒黄精与常压蒸制酒黄精的外观色泽、质地、气味、口感等性状无明显差异;另外,本文研究的高压蒸制可以使各化学成分含量在更短时间内达到稳定的状态,便于规模化生产。综合评价本研究几种化学成分含量变化情况,结合实际生产成本,3~6 蒸后各含量趋于稳定,因此3~6 蒸多花黄精最适宜。另有研究表明高压蒸制的多花黄精多糖含量高于常压蒸制的[21],而高压蒸制与传统炮制对黄精皂苷、黄酮和总酚类成分的变化情况是否有差异还不清楚,因此高压蒸制与常压蒸制对多花黄精多个指标成分的转化机理有待进一步研究。

