血清铁在脓毒症诊断及预后评估中的临床价值
李福兴,王黎,樊玉娟,谢可心,程明璟,张玉琳,赵卫东*
1大理大学临床医学院,云南大理 671000;2大理大学第一附属医院检验科,云南大理 671013
脓毒症为机体对感染的反应失调而导致的危及生命的器官功能障碍[1]。脓毒症患者一般早期即合并贫血,其症状随住院时间延长而加重,且脓毒症相关性贫血的发病机制相对复杂,使得治疗更为棘手,病死率更高[2-4]。随着研究的深入,人们对脓毒症发病机制中微量元素代谢紊乱的认识也日益加深[5]。铁是机体必需的微量元素,参与DNA合成、能量生产及免疫功能等生物过程[6]。众多研究表明,铁可能是一种有用的生物标志物,可用于评估脓毒症的严重程度,并能预测疾病的结局[7-11]。
脓毒症相关性贫血往往合并铁代谢紊乱[12],但铁代谢指标变化与脓毒症预后之间的关系尚不明确,已有研究表明铁代谢指标可作为脓毒症预后的预测因素[13-14]。通常,血浆铁蛋白(储存铁)在缺铁性贫血时降低,但在脓毒症急性期升高[15]。但也有研究发现,血清铁蛋白既不能预测小儿脓毒症患者的器官功能障碍,也不能预测其病死率[16]。此外,炎症与铁代谢之间的相互作用可能会干扰脓毒症患者其他炎症性贫血的相关参数,并使铁代谢变化更为复杂。目前关于脓毒症患者早期铁代谢的变化趋势、缺铁对机体的进一步影响及其与脓毒症患者预后的关系研究相对较少,补充铁剂对脓毒症患者炎症性贫血的治疗效果如何仍存在争议。本研究探讨了血清铁在脓毒症患者诊断及预后评估中的临床价值。
1 资料与方法
1.1 研究对象及分组 回顾性分析2018年9月-2019年9月大理大学第一附属医院重症监护室(ICU)收治的85例脓毒症患者的临床资料,所有患者均符合脓毒症新指南Sepsis 3.0中的诊断标准[17]。另纳入同期入住我院ICU且性别、年龄均匹配的非脓毒症患者50例作为对照组。根据28 d生存情况将脓毒症患者分为死亡组(n=34)与生存组(n=51)。排除标准:(1)患者年龄<18岁或>80岁;(2)合并急性心脑血管事件、各系统恶性肿瘤及严重血液病;(3)孕妇及哺乳期妇女;(4)既往病史不明确,影响序贯器官衰竭评分(SOFA)的准确评估;(5)伴有人类免疫缺陷病毒(HIV)感染及自身免疫性疾病,使用免疫抑制药物及细胞毒性药物等;(6)伴有影响血清铁蛋白浓度的基础疾病,如各种原因导致的失血、消化性溃疡、钩虫病及混合痔等。本研究经医院伦理委员会批准(批号DFY20180625)。
1.2 临床资料收集 利用医院信息系统(Hospital Information System,HIS)查阅并收集两组患者的临床病历资料,记录两组的一般资料[年龄、性别及体重指数(BMI)等]、临床表现(生命体征、感染途径、并发症及住院天数等),并计算入院时的SOFA评分。
1.3 实验室指标检测 收集研究对象入住ICU 24 h内的外周静脉血,保存于含有肝素或乙二胺四乙酸的采血管中,以3500 r/min离心10 min,将血清分装于-80 ℃冰箱冻存备检。采用流式细胞术[BD FACSCalibur流式细胞仪(美国BD Bioscience公司)]检测白细胞介素-1β(IL-1β)水平;采用XN-9000自动血细胞分析仪(日本Sysmex公司)测量白细胞(WBC)、中性粒细胞、淋巴细胞、单核细胞、红细胞(RBC)、血红蛋白(Hb)、血细胞比容(HCT)及血小板(PLT)水平;采用Burgess Hill全自动免疫分析仪(英国Roche Diagnostic公司)检测降钙素原(PCT)水平;采用全自动蛋白分析仪(德国DIASYS公司)检测C反应蛋白(CRP)水平;采用7600 Series自动生化分析仪(日本HITACHI公司)检测总胆红素(TBI)、肌酐(Cr)、尿素氮(BUN)、铁蛋白、血清铁、转铁蛋白(TRF)、总铁结合力(TIBC)及转铁蛋白饱和度(Tfs)水平。
1.4 血清铁对脓毒症诊断效能及预后判断的评估价值 采用受试者工作特征(ROC)曲线评估血清铁对脓毒症的诊断效能以及各指标对脓毒症预后的判断价值;采用Spearman相关分析判断血清铁与各变量间的相关性;采用Cox风险模型分析脓毒症患者的预后危险因素。根据约登指数选取血清铁对脓毒症患者28 d病死率的最佳预测阈(cut-off)值,以血清铁水平的截断值(2.5 μmol/L)为界,将85例脓毒症患者分为两组,其中≥2.5 μmol/L组65例,<2.5 μmol/L组20例,采用Kaplan-Meier生存分析比较两组28 d病死率,并用log-rank法比较生存曲线的差异。
1.5 统计学处理 采用SPSS 20.0软件进行统计分析。计数资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法;符合正态分布的计量资料以±s表示,两组比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,两组比较采用Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组一般资料比较 85例脓毒症患者中,革兰阴性菌感染37例,革兰阳性菌感染48例;发生脓毒症休克者20例,未发生脓毒症休克者65例。与对照组比较,脓毒症组收缩压、血氧饱和度明显降低,差异有统计学意义(P<0.05);两组年龄、性别、BMI、体温、呼吸、心率、舒张压差异无统计学意义(P>0.05)(表1)。
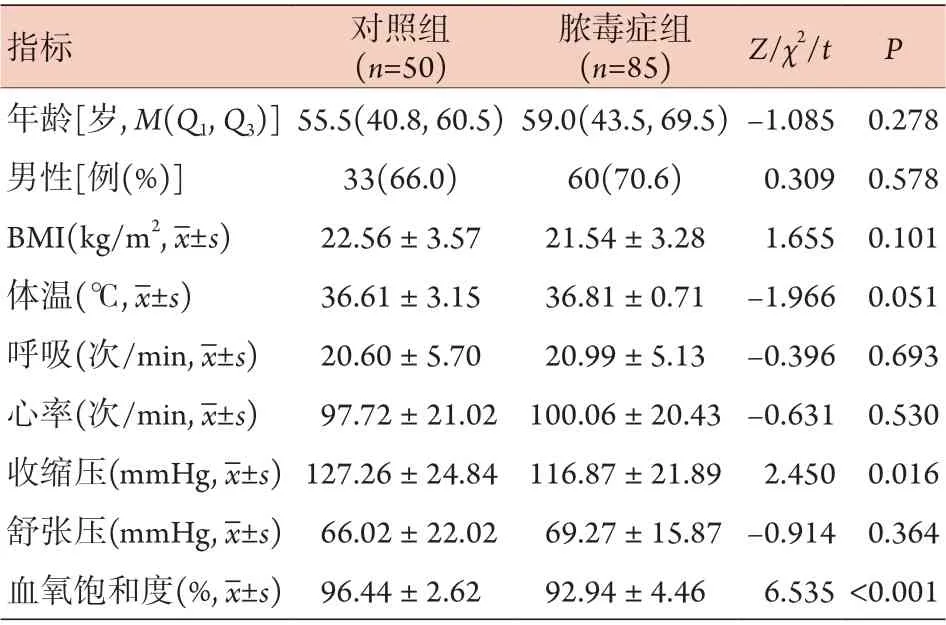
表1 对照组与脓毒症组一般资料比较Tab.1 Comparison of the general information between control group and sepsis group
2.2 两组临床指标比较 与对照组比较,脓毒症组红细胞计数、血红蛋白、血小板、血清铁、转铁蛋白饱和度、入住ICU时间等指标均降低,总胆红素、肌酐、降钙素原水平及SOFA评分均升高,差异有统计学意义(P<0.05);两组其余实验室指标差异无统计学意义(P>0.05)(表2)。
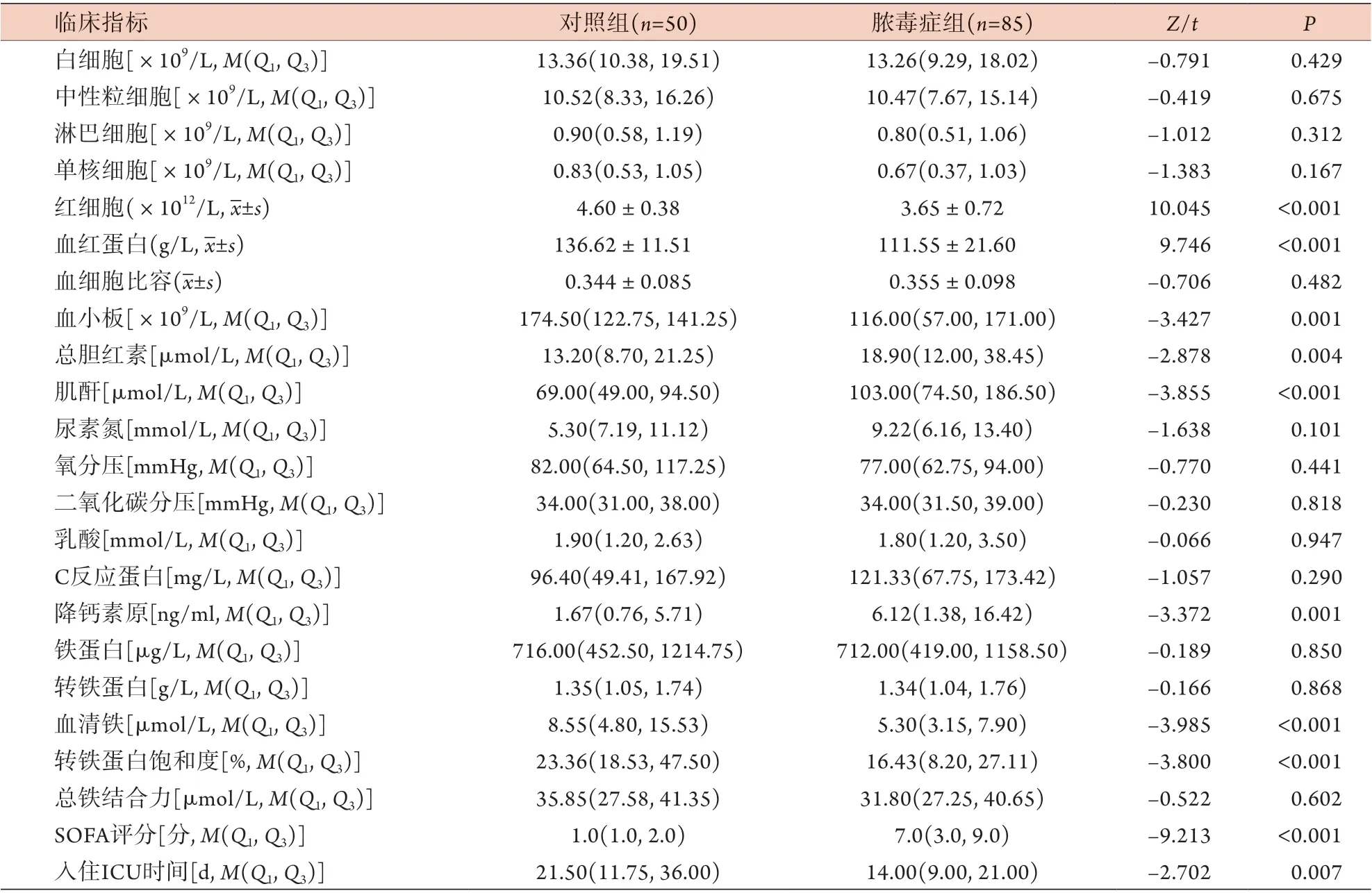
表2 对照组与脓毒症组临床指标比较Tab.2 Comparison of the clinical indicators between control group and sepsis group
2.3 血清铁对脓毒症的诊断效能评估 血清铁诊断脓毒症的ROC曲线下面积(AUC)为0.71(95%CI
0.62~0.79),诊断敏感度为34.1%,特异度为100.0%(图1)。
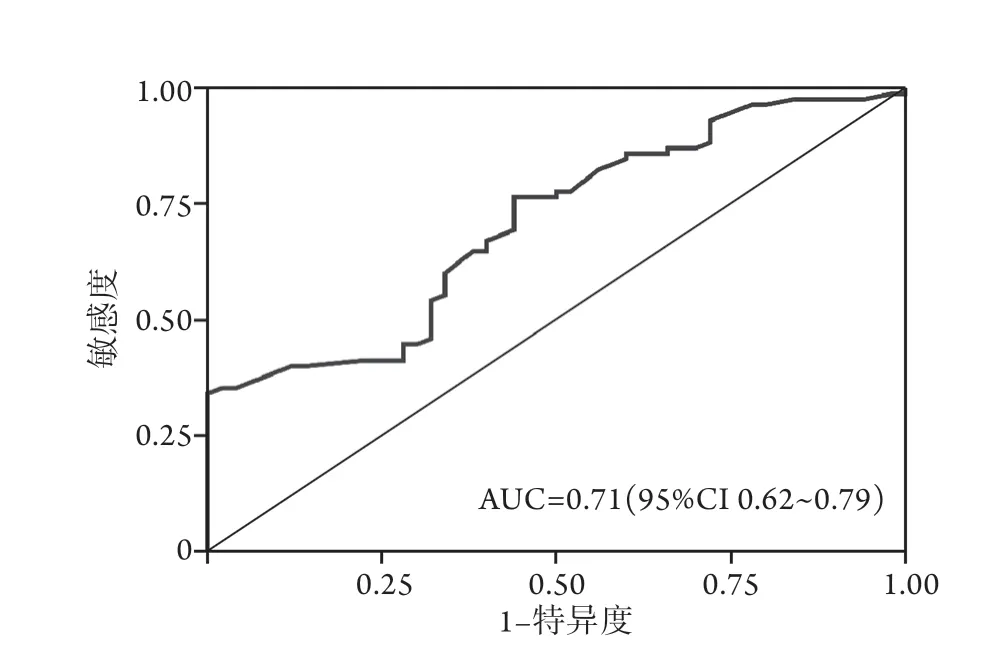
图1 血清铁对脓毒症诊断效能评估的ROC曲线Fig.1 Receiver operating characteristic curves of serum iron diagnosed for sepsis
2.4 血清铁对脓毒症预后的评估价值
2.4.1 生存组与死亡组一般资料比较 两组合并糖尿病患者比例、BMI、舒张压、血氧饱和度等差异有统计学意义(P<0.05);年龄、性别、生命体征(体温、呼吸、心率、收缩压)、病因、并发症(高血压、慢性阻塞性肺疾病)等差异无统计学意义(P>0.05)(表3)。
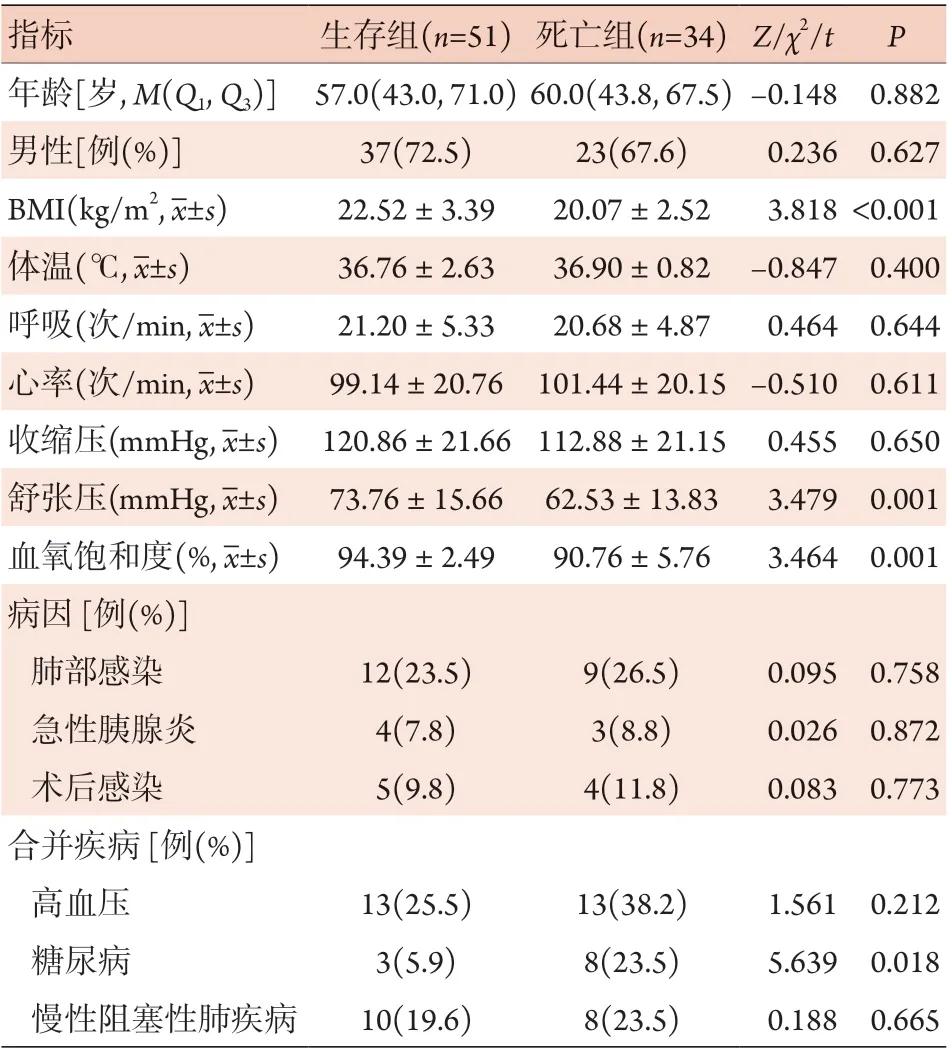
表3 脓毒症生存与死亡患者一般资料比较Tab.3 Comparison of the general information between survival group and non-survival group
2.4.2 生存组与死亡组临床指标比较 与生存组相比,死亡组C反应蛋白、降钙素原、SOFA评分、IL-1β均升高,红细胞计数、血红蛋白、血清铁、转铁蛋白饱和度均降低,差异有统计学意义(P<0.05)。其余实验室指标及入住ICU天数等差异无统计学意义(P>0.05,表4)。
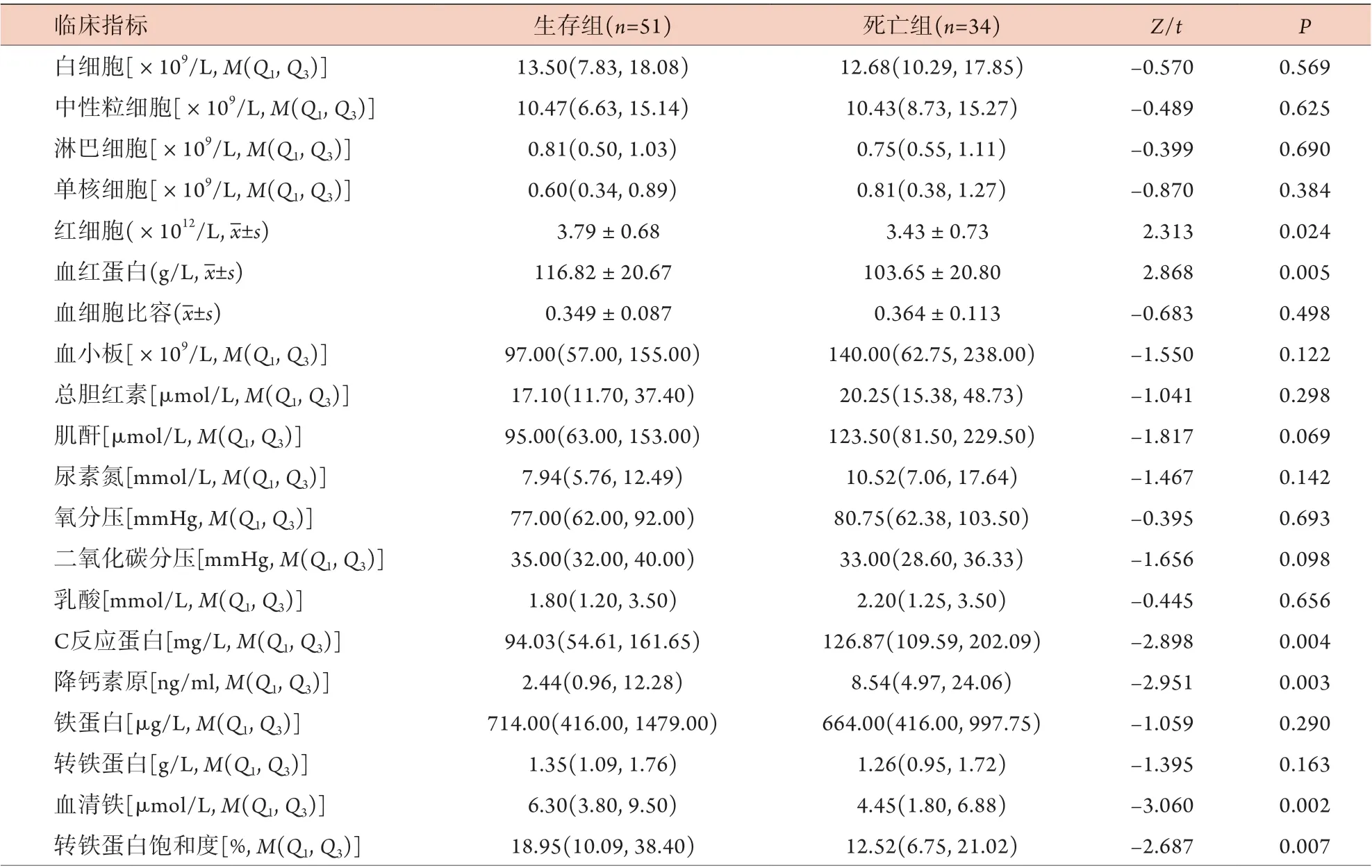
表4 脓毒症生存与死亡患者临床指标比较Tab.4 Comparison of the clinical indicators between survival group and non-survival group
2.4.3 脓毒症预后相关危险因素的Cox回归分析 Spear man相关分析表明,血清铁与I L-1β呈负相关(r=-0.51,P<0.001),与红细胞计数(r=-0.0 1,P=0.8 9 9)、血红蛋白(r=-0.0 7,P=0.5 4 8)、C R P(r=-0.1 4,P=0.1 9 1)、PCT(r=-0.09,P=0.413)、SOFA评分(r=-0.03,P=0.795)等无明显相关性。单因素Cox回归分析结果显示,糖尿病、SOFA评分高、CRP、PCT及IL-1β等是脓毒症预后的危险因素,BMI、舒张压、血氧饱和度、血清铁、转铁蛋白饱和度等是脓毒症预后的保护因素;进一步行多因素Cox回归分析发现,体温、SOFA评分、CRP、PCT、IL-1β是脓毒症预后的独立危险因素,BMI、血氧饱和度是脓毒症预后的保护因素(表5)。
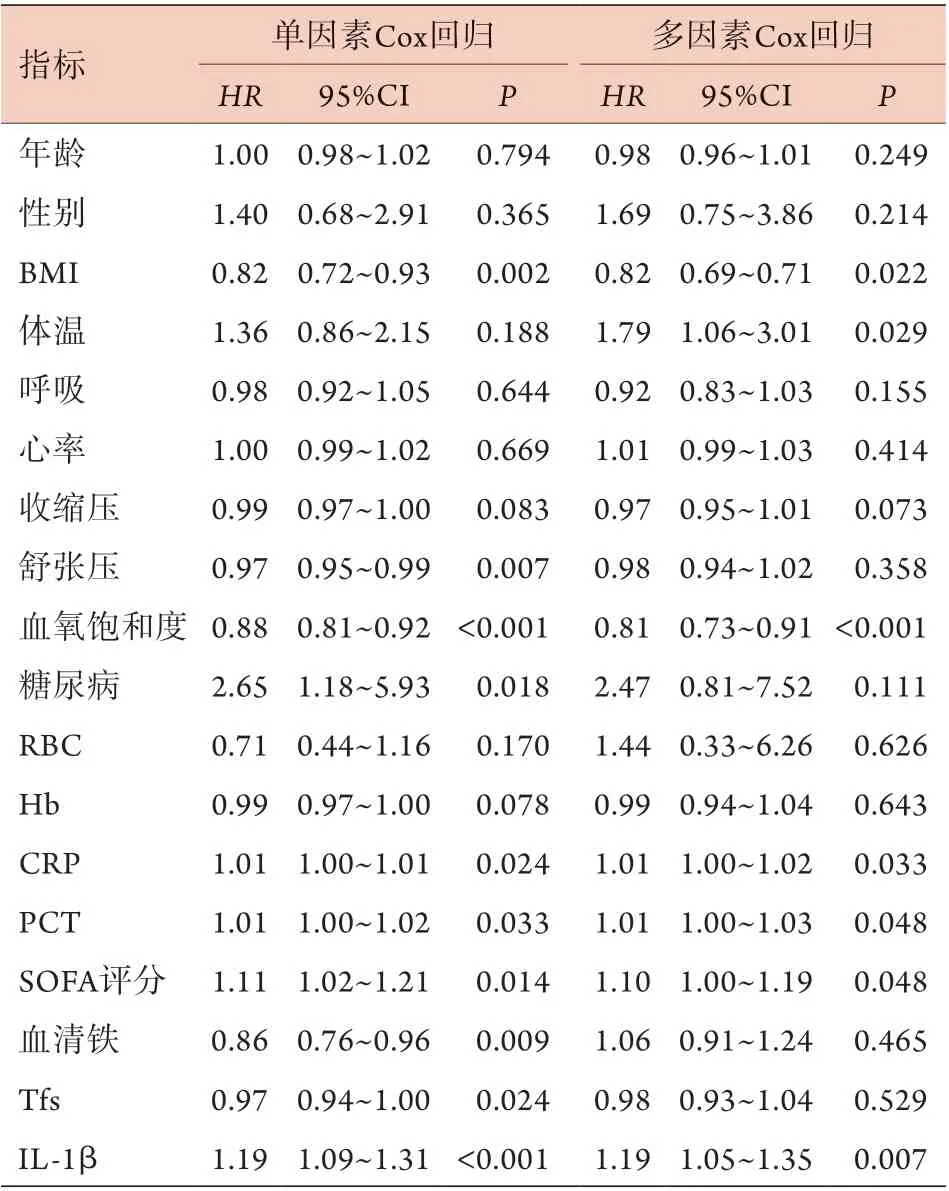
表5 脓毒症预后相关危险因素的Cox回归分析Tab.5 Cox regression analysis for risk factors of sepsis prognosis
2.4.4 ROC曲线分析各指标判断脓毒症预后的价值
ROC曲线分析结果显示,IL-1β判断脓毒症预后的价值最高,AUC最大,诊断敏感度为64.7%,特异度为68.6%;其次为SOFA评分和血清铁(表6)。
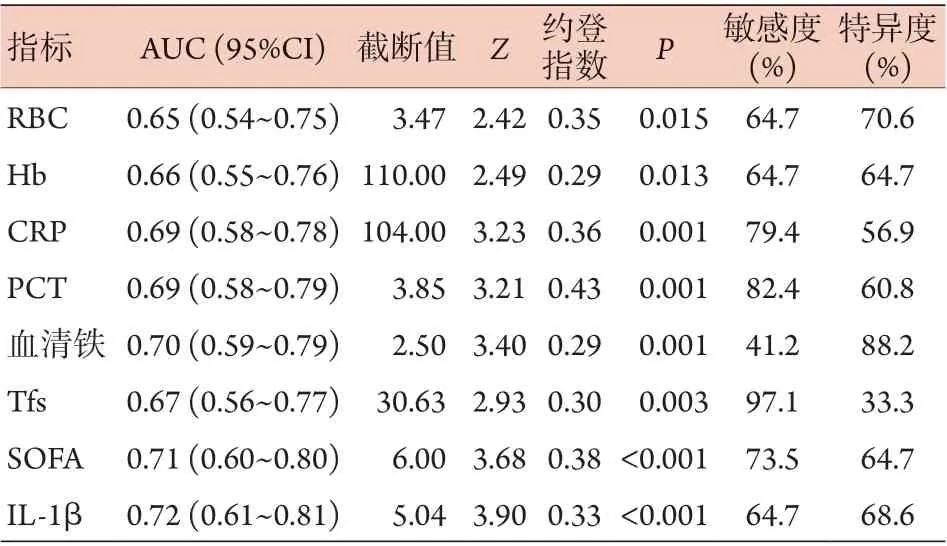
表6 各指标判断脓毒症患者预后的ROC曲线分析结果Tab.6 Receiver operating characteristic analysis for laboratory indexes of sepsis prognosis
2.4.5 生存曲线分析 生存分析结果显示,血清铁<2.5 μmol/L的脓毒症患者的28 d病死率高于血清铁≥2.5 μmol/L的患者,差异有统计学意义(P=0.003,图2)。
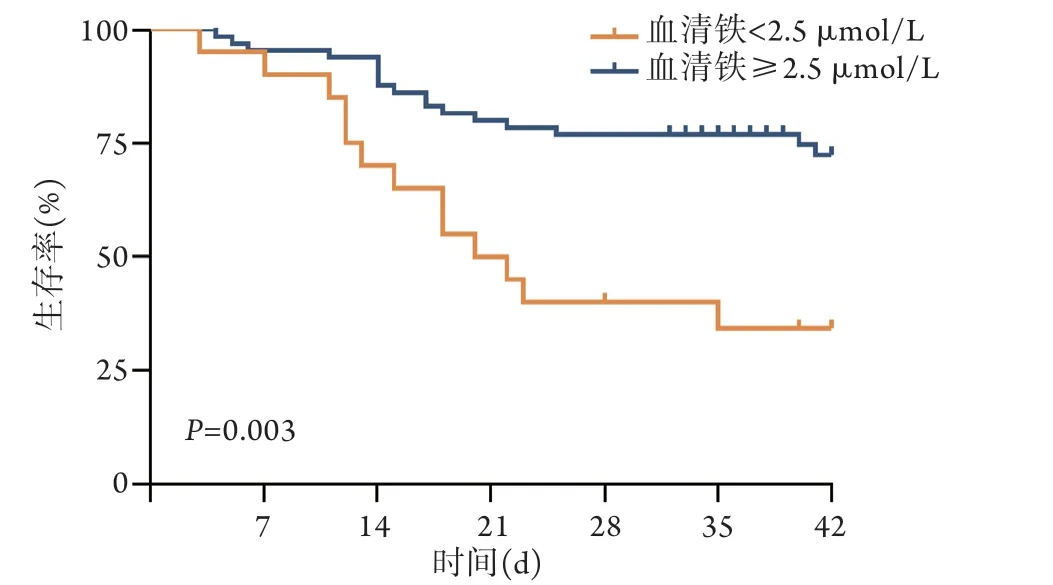
图2 不同血清铁水平患者生存曲线比较Fig.2 Comparison of Kaplan-Meier survival curves of patients with different serum iron levels
3 讨 论
铁是参与微生物生长过程的一种重要元素,大多数微生物的致病作用依赖于铁,一些细菌(如大肠埃希菌、肺炎克雷伯菌)已经进化出从宿主铁结合蛋白(如转铁蛋白)中清除铁的能力[7-8]。生理情况下,铁稳态受铁调素的严格调控,在脓毒症期间,铁代谢会发生改变,包括增加细胞内铁的运输及吸收,减少铁的输出,这是机体对抗病原体的一种保守策略。虽然细胞内铁过载已被证实具有一定保护作用,但随着病情的发展,其可能会导致机体发生氧化损伤及细胞死亡(例如细胞焦亡、铁死亡)[9-11]。
目前关于铁代谢紊乱与脓毒症之间的关系研究仍较少,血清铁在脓毒症中的作用尚存在争议。本研究发现,脓毒症患者血清铁水平明显低于非脓毒症患者,且脓毒症死亡组RBC、Hb及血清铁水平显著低于生存组,提示脓毒症患者早期即存在因血清铁下降导致的贫血及铁代谢紊乱[18],而低铁环境可能是机体限制细菌生长、减少感染所做出的防御性反应[7]。但也有研究表明机体严重缺铁会增加血流感染的风险[19]。Jiang等[15]发现,入住ICU后的第1、3、7天,死亡组的血清铁水平均低于存活组,与本研究结果一致。本研究还发现,血清铁水平<2.5 μmol/L的脓毒症患者28 d病死率高于血清铁≥2.5 μmol/L的患者,原因可能是血清铁水平降低使缺铁性贫血的发生风险增加,治疗更为棘手,故预后更差。有研究报道,脓毒症合并嗜血细胞综合征(hemophagocytic syndrome,HPS)患者的血清铁及铁蛋白水平升高,血清铁蛋白最高可达10 000 ng/ml[20]。HPS相对罕见且危及生命,主要特征为极端免疫激活导致高细胞因子血症及多器官系统损伤[21],当脓毒症患者检测到较高的血清铁及铁蛋白水平时,应根据其他HPS标准进行评估,一旦合并HPS,患者预后往往很差,更应及早进行干预及治疗。
血清铁在脓毒症中的作用机制尚未明确。有研究表明,脓毒症中多器官功能衰竭可能是由于早期的高炎症“细胞因子风暴”所致[22],其中,促炎因子IL-1β可促进炎症级联反应,进一步诱导多种炎性因子的表达,参与脓毒症的发病[23]。在本研究中,脓毒症死亡组的IL-1β表达水平明显升高。Mera等[24]也发现,脓毒症死亡患者血浆IL-1β浓度高于存活患者,并呈持续上升趋势,提示死亡组具有更高的炎症水平。另外,IL-1β通过上调铁调素的表达在炎症性贫血中发挥重要作用,机体发生感染后,IL-6可通过激活GP130/STAT3信号通路上调铁调素的表达水平,进而降低血清铁水平[25],而IL-1β可诱导IL-6的上调[26],同时IL-1β可通过刺激转录因子CCAAT增强子结合蛋白(C/EBP)δ的表达,结合铁调素启动子上的C/EBP结合位点,导致铁调素的转录激活,进一步下调血清铁水平[27],这为IL-1β与血清铁水平呈负相关提供了合理解释,故血清铁水平下降与IL-1β、IL-6等炎性因子刺激有关,死亡组患者的IL-1β水平更高,细胞因子风暴更为剧烈,同时IL-1β可促进铁调素的表达,导致更低的血清铁水平,进一步为低血清铁水平是脓毒症28 d病死率的独立危险因素提供了证据。
本研究也存在一些局限性:(1)为单中心回顾性研究,样本量有限,无法排除选择偏倚的影响;(2)非脓毒症患者基础疾病为多发伤、脑外伤、烧伤等,此类患者往往情况危急,入院即送往ICU进行救治,且仅分析对照组入住ICU 24 h内的检测指标,机体应激反应有可能延迟,故导致非脓毒症的并发症及基础病与脓毒症患者差距较大,结果可信度欠佳;(3)仅记录了入院24 h内的铁代谢指标,未对铁代谢中枢调控因子铁调素进行研究,而动态检测铁代谢指标的变化可能更有意义;(4)只对28 d病死率进行分析,时间较短,应进行更长时间的随访,从而对预后进行更充分地评估。
综上所述,本研究结果表明,血清铁在脓毒症死亡组中下降更明显,与脓毒症患者28 d病死率有一定联系,且与IL-1β呈明显负相关,血清铁<2.5 μmol/L时,患者更容易死亡。

