HBV相关性慢加急性肝衰竭患者短期预后模型的建立与评估
巴志伟,詹步同,刘传苗 (蚌埠医学院第一附属医院,安徽蚌埠 233000)
肝衰竭是一组临床常见的症候群,多种因素造成严重肝损害,致使肝脏合成、解毒、代谢以及生物转化功能严重受损,继而出现黄疸、凝血功能失代偿、腹水、肝性脑病、肝肾综合征等临床表现。慢加急性肝衰竭(ACLF)是肝衰竭中最常见的类型,在我国引起ACLF的主要病因是乙肝病毒(HBV)感染。目前尚无针对ACLF 的特殊治疗方法,晚期ACLF 患者因多系统器官衰竭,病死率高达76%[1-2]。本研究通过收集分析HBV-ACLF 患者临床数据,旨在构建一种依托总胆红素(TBil)、血清胱抑素C(CYSC)、血乳酸(LA)及D-二聚体(D-Dimer)为基础的新型短期预后预测模型,为临床诊治提供快速且准确的帮助。
1 资料和方法
1.1 病例与分组
选取2017 年11 月至2020 年11 月在我院就诊入院的72 例HBV-ACLF 患者的临床资料,依据确诊后90 d 内预后随访情况将其分为死亡组(39 例)和生存组(33 例)。纳入的72 例患者参照《肝衰竭诊治指南(2018 年版)》有关ACLF 诊断标准[1],并排除合并其他病毒(HAV、HCV、HEV、EB、CMV)感染、肝细胞癌等恶性肿瘤、自身免疫系统疾病、酒精性或药物性肝损害、妊娠及其他严重系统疾病等。本研究经医院伦理委员会批准。
1.2 研究方法
收集患者一般临床资料,如年龄、性别等,并记录患者入院24 h 内外周血检验结果,包括中性粒/淋巴比值(NLR)、红细胞分布宽度(RDW-CV)、血小板(PLT)、谷丙转氨酶(ALT)、总胆红素(TBil)、空腹血糖(GLU)、血乳酸(LA)、血清钠(Na+)、肌酐(Cr)、C 反应蛋白(CRP)、白蛋白(ALB)、C反应蛋白/白蛋白(CAR)、血清胱抑素C(CYSC)、凝血酶原活动度(PTA)、国际标准化比值(INR)、D-二聚体(D-Dimer)、甲胎蛋白(AFP)、乙肝表面抗原(HBsAg)。终末期肝病模型(MELD)评分公式:R=3.8ln[总胆红素(mg/dl)]+11.2ln(INR)+9.6ln[肌酐(mg/dl)]+6.4(病因:胆汁性或酒精性0,其他1)[3]。
1.3 统计学处理
采用SPSS 25.0 进行数据分析,正态分布的计量资料以表示,组间采用独立样本t检验比较;不符合正态分布的两组计量资料使用[M(p25~p75)]表示,运用曼-惠特尼U 检验比较;计数资料采用例数及百分数(%)表示,两组间采用卡方检验。运用logistic 回归模型进行多因素分析,并建立新型预后预测模型,应用ROC 曲线对TBil、D-Dimer、LA、CYSC、MELD评分及TCLD 模型比较各自ROC 曲线下面积(AUC),P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
72 例HBV-ACLF 患者中男55 例,女17 例;平均年龄(49.6±14.3)岁。死亡组患者年龄以及NLR、ALT、TBil、LA、CRP、CAR、CYSC、D-Dimer 水平均高于生存组;Na+、PTA 均低于生存组,其余指标差异无统计学意义。死亡组患者的MELD 评分显著高于生存组(P<0.01)。见表1。

表1 生存组与死亡组间各指标的比较
2.2 预后分析
将单因素有差异的11个观察指标引入二元logistic回归模型,上述指标作为自变量,不同预后作为因变量,回归结果示,TBil、CYSC、LA、D-Dimer 与不良预后呈正相关(P<0.05),是发生不良预后的独立危险因素(表2)。将上述4 种指标再次纳入多因素logistic 回归分析并构建TCLD 模型,TCLD=-10.213+0.008×TBil+0.779×LA+2.533×CYSC+0.569×D-Dmier(表3)。
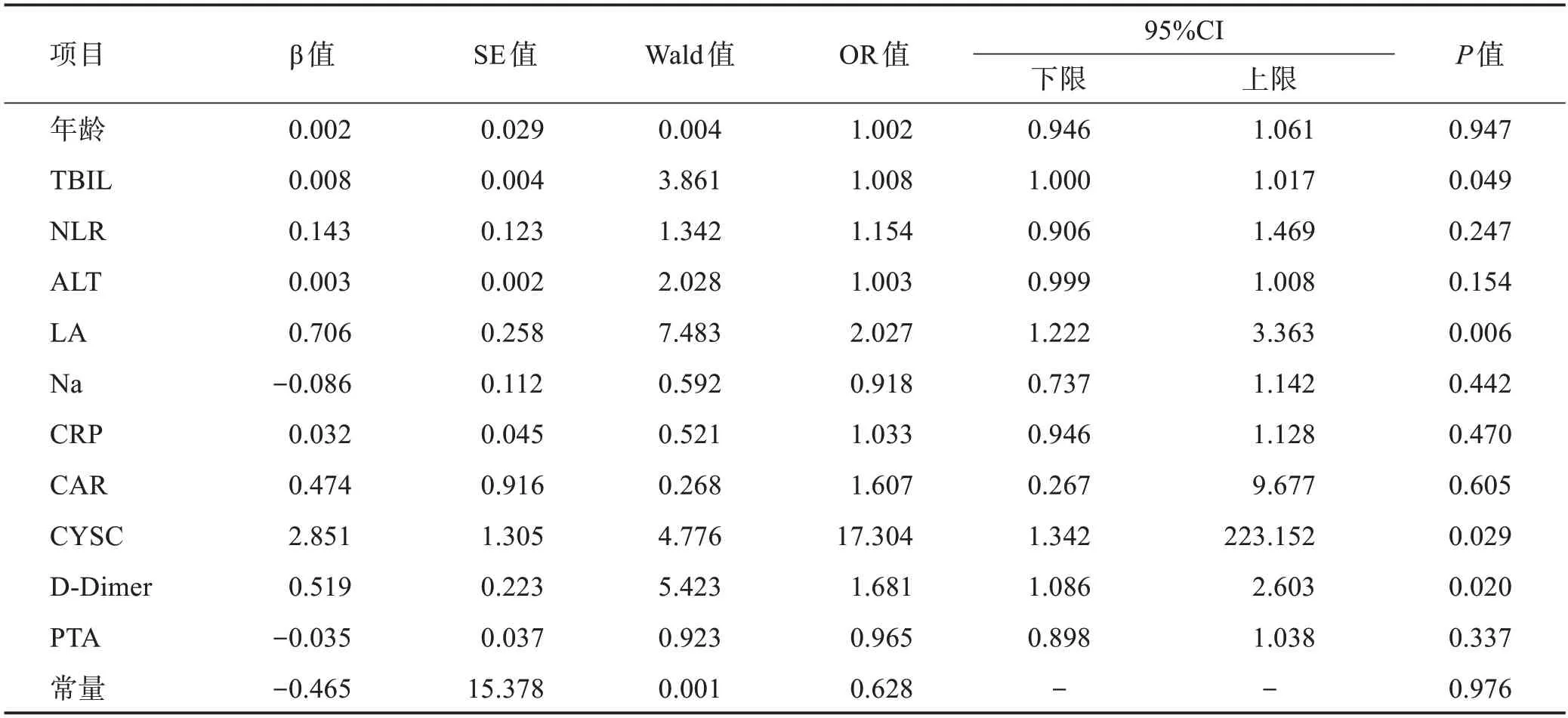
表2 影响患者预后的单因素分析

表3 影响患者预后的多因素logistic回归分析
2.3 TBil、CYSC、LA、D-Dimer、MELD 评分及TCLD模型对预后评估的比较
较之于MELD 评分,TCLD 模型评估HBV-ACLF患者短期预后的AUC、敏感度、特异度、约登指数更高,且TCLD 模型AUC>0.75,提示该模型区分能力较好,见表4和图1。
3 讨论
ACLF 作为一组临床复杂严重的综合征,病死率高,预后极差,未行肝移植的ACLF 患者其28、90 d 短期病死率高达32.8%和51.2%[4]。对于临床医护人员而言,利用血清学指标构建预后预测模型能够准确、快速地评估患者病情变化和预后情况十分重要。本研究旨在通过探讨影响HBV-ACLF 患者预后的独立危险因素,构建评估患者病情及预后的预测模型。
本研究发现AKI 发生率22.2%,与相关报道的22.8%ACLF 患者在入院时存在急性肾损伤(AKI)数据相近[5]。肾脏作为ACLF 患者常见受累器官,若能及早诊断并治疗AKI,对改善预后意义重大。我们发现CYSC在两组间差异有统计学意义,而Cr值却无显著差异,并大多处于正常水平,CYSC 作为一种蛋白酶抑制剂,相对分子质量小,其分布容积仅是Cr的1/3,可经肾脏自由滤过并被重吸收,不随尿液排出,CYSC较Cr对AKI的早期预警更有意义[6],已被证明是窒息新生儿早期诊断AKI 的可靠指标[7]。本文数据印证上述观点,并且发现CYSC是HBV-ACLF患者预后的独立危险因素,这与胡辉等[8]观点相同。HBV-ACLF患者因肝细胞大量坏死,肝小叶重建,胆管梗阻导致胆红素排泄障碍,从而升高体内TBil 水平[9]。本文结果显示两组TBil 数值均远高于正常,患者TBil 越高,表明肝损伤程度越重,预后不佳[10],且死亡组该指标数值明显大于生存组(P<0.05),进一步研究表明TBil是不良预后的独立危险因素。
肝脏是乳酸清除的主要器官,HBV-ACLF患者严重肝功能不全,其乳酸清除功能将会受损,而HBVACLF 相关并发症,如细菌感染也可能提高乳酸水平,乳酸水平越高,往往预示预后越差[11]。本文中死亡组患者的乳酸水平明显高于生存组(P<0.05),多因素logistic 回归分析提示乳酸是影响预后的独立危险因素(OR>1),具体为乳酸每增加一个单位,该患者死亡风险则增加1.027 倍(OR=2.027)。Drolz 等[12]曾首次报道乳酸是ACLF 患者预后不良的危险因素,而我们的结果也与Gao 等[13]一项多中心研究结果相一致,并且Gao 等[13]指出24 h 乳酸清除率每增加10%,在院ACLF患者死亡风险降低18%,短期(90 d)全因死亡率则降低7%。
另外近年有研究强调了ACLF患者出凝血功能的紊乱[14]。D-Dimer 作为最简单的纤维蛋白降解产物,从交联纤维蛋白中释放而来[15],其水平升高提示体内存在高凝状态或继发性纤溶亢进,还可能预示严重的系统性炎症。我们研究发现死亡组患者的D-Dimer水平明显高于生存组(P<0.05),D-Dimer水平越高,患者短期死亡风险越高。Qi 等[16]的回顾性研究也证实了D-Dimer与ACLF患者短期预后有关,入院时D-Dimer高水平患者具有更高的短期(28 d)病死率。
我们将TBil、CYSC、LA 以及D-Dimer 4 种指标再次纳入多因素logistic回归分析并建立TCLD模型,结果显示TCLD 模型的敏感度、特异度、约登指数均大于MELD 评分,曲线下AUC 面积为0.876,高于单一指标及MELD 评分,其明显高于0.75,证明TCLD模型区分能力较好,并且经Hosmer-Lemeshow检验(P<0.05),提示该模型有较好校准能力。
综上,TBil、CYSC、LA 以 及D-Dimer是影响ACLF 患者不良预后的独立危险因素,较之MELD 评分及单一指标,TCLD 模型诊断效能更佳。该病进展迅速,患者诊治配合较差,TCLD 模型利用常见实验室指标,能较为准确对患者进行短期预后评估值。但本研究仅纳入我院过去3 年相关病例,样本量较少,代表性可能不足,仍需扩大样本数进一步验证该模型价值。

