藏猪和大约克猪FBXO32基因多态性及表达差异分析
王宇 徐士军 孙雪倩 叶幼荣 张健 商鹏


摘要:为明确FBXO32基因在高原藏猪与大约克猪肌肉中的表达差异性,选取这2个猪种作为试验动物,采用双脱氧测序技术对藏猪(33头)、大约克猪(32头)FBXO32基因的5′UTR启动子区进行单核苷酸多态性(SNPs)筛选,利用实时荧光定量聚合酶链式反应(RT-qPCR)技术检测FBXO32基因在藏猪、大约克猪腿肌及背最长肌组织中mRNA的相对表达量。研究结果表明,在FBXO32基因的5′UTR启动子区筛选到了G-257A和A-556G这2个SNPs位点,且SNPs位点在2个猪种群体间的基因型频率有着显著性差异(P<0.05);通过转录因子预测,发现这2个SNPs位点与肌细胞的更新、分化和增殖相关,推测FBXO32基因的SNPs位点是调控肌肉生长的关键位点;藏猪腿肌、背最长肌组织中FBXO32基因的mRNA相对表达量都显著高于大约克猪(P<0.05),由此推测FBXO32基因可以负向调控肌肉生长,这可能是导致高原藏猪生长速度慢的主要原因之一。本研究结果为进一步探究FBXO32基因在猪肌肉生长相关的调控机制提供了必要的理论依据。
关键词:藏猪;FBXO32基因;肌肉生长;多态性位点;相对表达量
中图分类号:S828.2 文献标志码: A
文章编号:1002-1302(2022)05-0146-05
收稿日期:2021-10-08
基金项目:西藏自治区重大科技专项(编号:XZ202101ZD0005N);四川省区域创新合作项目(编号:2020YFQ0029);西藏自治区林芝市巴宜区科技重点研发计划(编号:2021-GX-SY-01)。
作者简介:王 宇(1995—),男,江苏宿迁人,硕士,主要从事动物遗传育种与繁殖研究。E-mail:wangyu2512@163.com。
通信作者:商 鹏,博士,副教授,主要从事高原动物遗传资源保护与功能基因组研究。E-mail:nemoshpmh@126.com。
骨骼肌是动物躯体重要的组成部分,占动物体质量约40%,对调节动物运动、新陈代谢等活动具有重要作用[1]。在家畜生产过程中,骨骼肌的生长发育可以影响家畜肌肉的产量,动物机体肌肉的生长速度及产量是评价动物生产性能的主要指标[2]。
FBXO32又称肌肉萎缩盒F蛋白32(muscle atrophy F-box32,简称FBXO32),是一种E3泛素连接酶,在泛素-蛋白酶体途径(ubiquitin-proteasome parthway,简称UPP)中具有非常重要的作用[3],而UPP是真核生物细胞内一种高效的蛋白质降解途径,该途径也是降解肌蛋白的主要途径之一[4],目前,已被证明该途径能夠加速肌蛋白的降解从而引起动物机体肌肉量降低或肌肉萎缩情况的发生[5]。动物肌肉的生长发育实际是肌蛋白等分解与合成平衡累积的结果[6]。作为一种E3泛素连接酶,FBXO32可以靶向几种蛋白进行调控,在动物骨骼肌相关研究中,有关肌蛋白转录翻译形成的过程中,起到主要作用的有起始因子eIF3-f和肌源性调节因子MyoD[7-8],eIF3-f和MyoD对肌细胞分化和蛋白质合成与代谢以及与其他与肌肉生长相关特异基因的转录调控过程中起着关键的作用[9]。同时有研究表明FBXO32基因参与肌细胞的凋亡,除了靶向介导肌肉发育过程中的功能蛋白外,还靶向磷酸酶-1(MKP-1)进行蛋白酶降解过程[10]。Cheveland等在对虹鳟鱼的禁食试验中发现,禁喂饲料会导致虹鳟鱼白色、红色肌肉量减少,并在此过程中对FBXO32基因进行了定量检测,得出了FBXO32基因的表达量增加会导致机体内肌肉量随之减少的结论[11]。
藏猪是我国特有的高原、高寒放牧猪种[12],具有很强的高原适应性,并且耐粗饲、肉嫩味美[13]。笔者所在研究团队前期通过不同品种猪背最长肌组织转录组学分析,筛选出FBXO32为猪生长发育关键差异表达基因,为进一步验证转录组数据的有效性,并探讨FBXO32基因在猪骨骼肌组织中的相对表达量,本研究拟运用同样在高原环境下饲养的藏猪、大约克猪的腿肌和背最长肌组织作为研究对象,利用第一代测序技术对FBXO32基因起始密码子上游3 kb区域进行了多态性分析,并利用 RT-qPCR 技术分析FBXO32基因在藏猪和大约克猪腿肌及背最长肌组织中的表达差异情况,为进一步开展藏猪生长发育性能研究奠定理论基础。
1 材料与方法
1.1 试验材料
试验于2020年10—12月在西藏农牧学院动物遗传育种与繁殖实验室内进行。采集180日龄西藏林芝本地的藏猪(n=33)、大约克猪(n=32)耳组织进行DNA提取。挑选以不限饲方式饲养至180日龄、生长情况相近的藏猪和大约克猪各10头进行屠宰,取其腿肌和背最长肌组织,加入RNA保存液,迅速放入液氮,转置于-80 ℃存放,用于RNA提取。
1.2 cDNA的合成及DNA、RNA的提取
本试验采用苯酚-氯仿抽提法提取DNA。采用Trizol法提取组织总RNA;cDNA制备根据快速反转录试剂盒(KR180123)说明书进行,-20 ℃保存备用。用NanoDrop 2000检测DNA、RNA的纯度和浓度;1%琼脂糖凝胶电泳检测DNA、RNA的完整性。
1.3 DNA引物设计与合成
登录GenBank下载猪FBXO32基因(登录号:NC_010446.5)启动子区域的DNA序列,利用Primer 5.0设计引物(引物信息见表1),由生工生物工程(上海)有限公司合成。
1.4 荧光定量PCR引物设计与合成
在NCBI(htttp://www.ncbi.nlm.nih.gov/)下载FBXO32基因(登录号NM_001044588)mRNA序列,选用β-actin作为内参基因,利用软件Primer 50设计引物(引物信息见表2),由生工生物工程(上海)有限公司进行合成。
1.5 基因型频率、基因频率与转录因子预测
首先对FBXO32基因起始密码子上游3 kb区域的DNA序列进行PCR扩增,藏猪和大约克猪各10头,每个个体抽取5 μL产物混合,混池测序分析基因的单核苷酸多态性。筛选出SNPs位点后,再根据筛选出的突变位点扩大个体进行测序。由测序结果统计各个SNPs位点的基因型频率和等位基因频率。用JASPAR在线网站(htttp://jaspar.binf.ku.dk/)进行SNPs位点突变前后的转录因子预测。
1.6 实时荧光定量PCR
选取检验合格的cDNA为模板,每个个体设置3个重复。采用20 μL的反应体系对FBXO32和β-actin进行RT-qPCR检测。用Livak法计算FBXO32基因在组织中的表达量。
1.7 统计分析
使用IBM SPSS Statisties 26.0软件测定FBXO32基因表达量的差异显著性,测定结果以P值表示。对FBXO32基因的基因型频率和基因频率进行显著性检验。
2 结果与分析
2.1 电泳检测
提取的腿肌与背最长肌组织总RNA电泳结果见图1。RNA样本均能跑出28S、18S以及5S条带,证明能满足进一步试验需求。
2.2 SNPs筛选
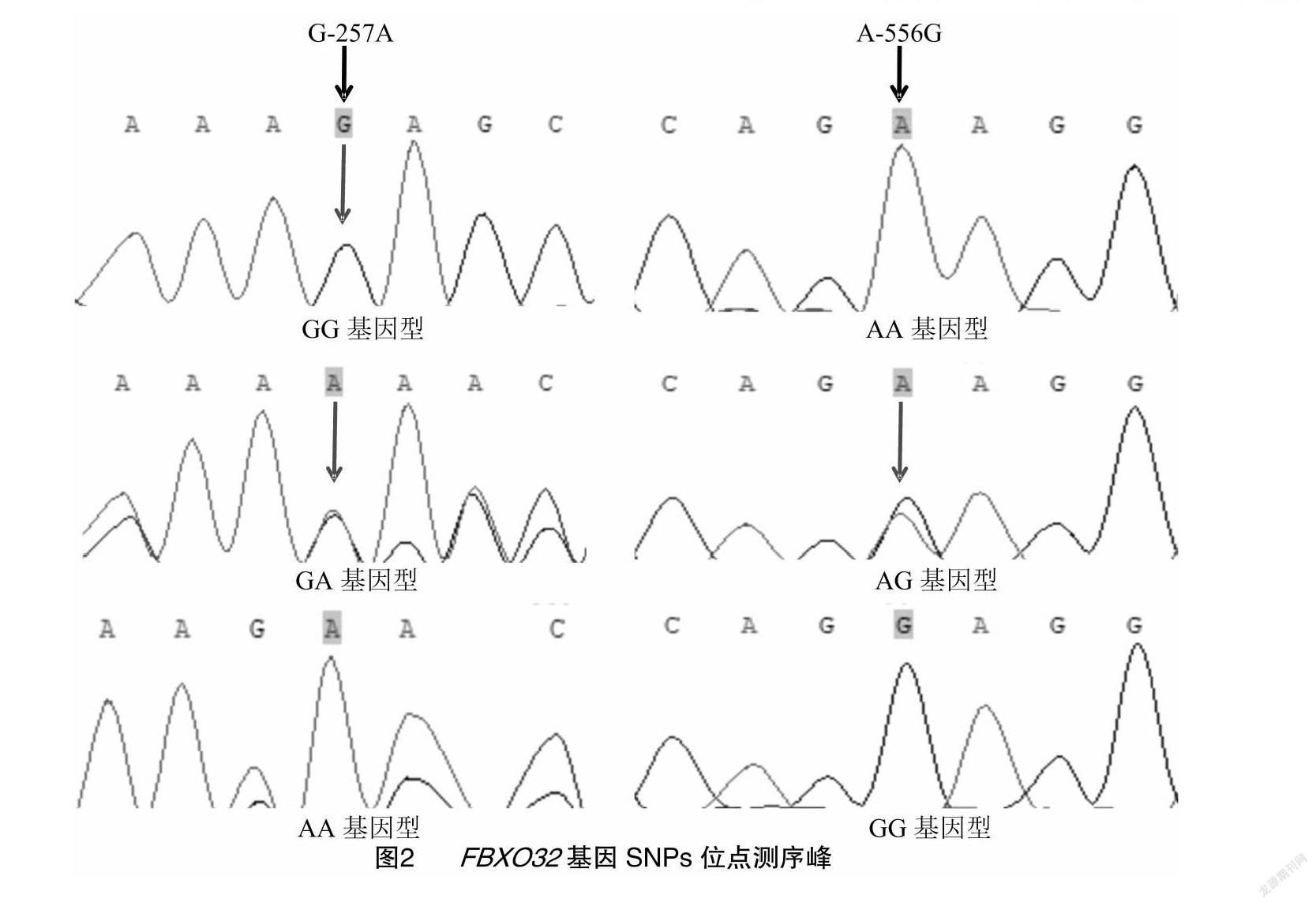
利用Chormas分析在起始密码子上游3 kb区域的SNPs位点,通过测序比对, 发现FBXO32基因共有2个突变位点,分别为在-257 bp处有G/A突变,基因型为GG、GA和AA,记为G-257A;在 -556 bp 处有A/G突变,基因型为AG、AA和GG,记为A-556G(图2)。
2.3 基因频率和基因型频率
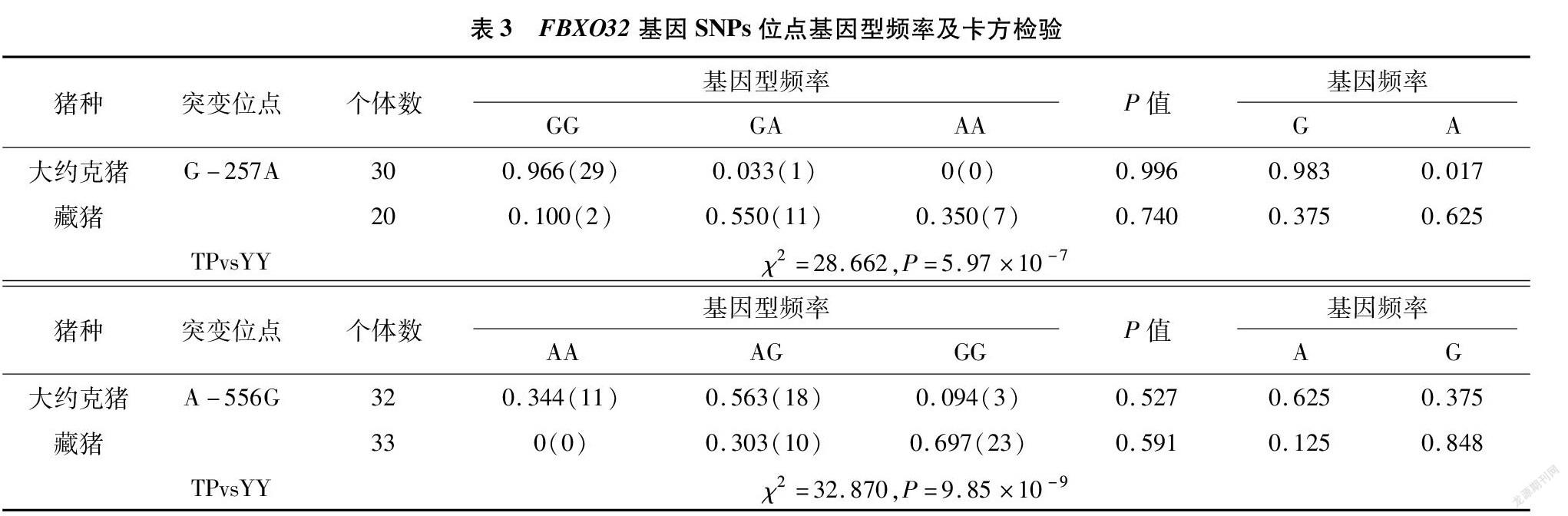
从表3可以看出,FBXO32基因的突变位点在2个猪种内都与哈迪-温伯格平衡定律相符合(P>0.05)。在藏猪与大约克猪品种间,FBXO32基因2个突变位点的基因型频率有着显著性的差异(P<0.05)。
2.4 转录因子预测
对5′UTR启动子区域的2个SNPs位点的转录因子通过在线网站进行预测,其中G-257A突变导致FOXP3转录因子消失并出现了新的转录因子OTX2;A-556G突变导致HAND2转录因子消失并出现了新的转录因子Etv4。
2.5 FBXO32基因在猪腿肌和背最长肌中的mRNA表达
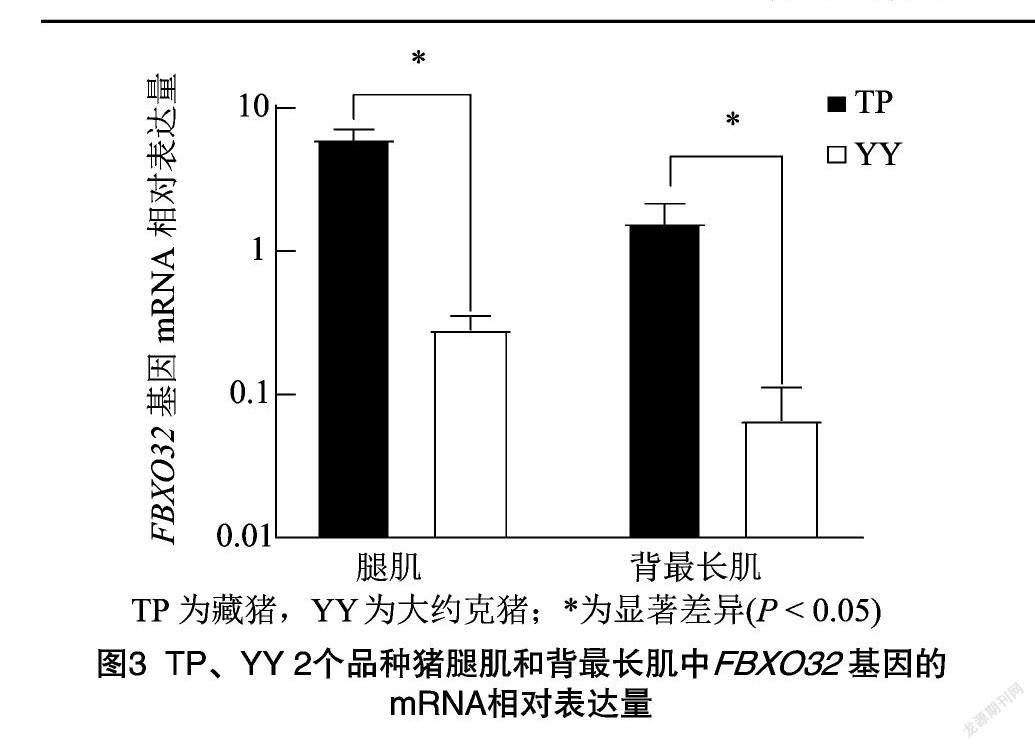
利用RT-qPCR技术对FBXO32基因在藏猪、大约克猪腿肌和背最长肌组织中的表达水平进行检测(图3)。从图3可以看出,在腿肌和背最长肌组织中藏猪FBXO32基因的mRNA相对表达量与大约克猪都存在着显著差异(P<0.05)。
3 讨论与结论
肌肉萎缩盒F蛋白32参与泛素化降解蛋白质的过程,主要在哺乳动物的肌肉和心脏组织中表达[14],是促进肌蛋白降解的特异蛋白,进而影响动物机体的肌肉生长[6,15]。
本研究在FBXO32基因的5′侧翼区域发现2个SNPs位点(A-556G和G-257A),通过转录因子预测分析了FBXO32基因的SNPs位点突变前后转录因子的功能特性:(1)在G-257A位点,当G突变为A后,转录因子FOXP3消失,研究表明FOXP3(叉头框蛋白P3)的表达有助于缓解相关病毒造成的肌肉萎缩,一旦FOXP3基因表达量下降或调控作用消失,肌蛋白降解增加,肌管萎缩[16]。Gong等在对小鼠的研究中发现,FOXP3的表达可以通过与Smad2/3/4的相互作用间接抑制c-Myc的活性[17]。c-Myc基因可以负调控很多与肌肉分化正相关的miRNAs进而抑制肌肉分化[18];当G突变为A后,在该位点结合产生新的转录因子OTX2,又称同源异形框基因2(orthodenticle homeobox,OTX2),属OTX家族,是影响多巴胺能神经元产生并控制运动与饮食的一个关键基因[19]。Wang等通过研究证明通过降低转录因子OTX2的表达可以保持猪的多能干细胞(iPSCs)自我更新和进一步诱导分化成为肌肉细胞[20]。OTX2对肌肉的生长发育可能起到负调控的作用[21]。在本研究中,等位基因A在藏猪上为优势等位基因,突变率较高,导致促进细胞生长的FOXP3消失和抑制肌细胞生长OTX2的生成,对肌肉生长起到负调控作用。(2)在A-556G位点当A突变为G后,转录因子HAND2消失,该基因能通过参与多种信号通路,在生长发育过程有着十分重要的作用[22-23]。罗文在试验中发现,敲除转录因子HAND2后会下调ERK信号通路的活性[24]。而ERK信号通路会促进成肌细胞增殖[25];在A-556G位点当A突变为G,结合产生新的转录因子ETV4(ETS variant 4),ETV4能参与调控多种生理功能,通过黏着斑相关蛋白(focal adhesion associated protein,FAAP)启动子结合元件来调节FAAP的表达[26],而FAAP与生长发育相关联,对肌肉的功能起到积极的調控作用[27],同时ETV4还可能参与抑制胚胎干细胞(ES)的增殖[28],而ES细胞可以被诱导分化为肌肉细胞促进肌肉的生长[29],因此ETV4基因的表达可间接抑制肌细胞的生长,进而影响肌肉的发育。在本研究中,等位基因G在藏猪上为优势等位基因,突变率较高,突变后能导致促进肌肉生长的FOXP3消失和抑制肌肉生长的OTX2生成,对肌肉生长起到负调控作用。
陈晓琳等通过观察电针对大鼠腓肠肌中FBXO32基因表达的影响发现当FBXO32过度激活,会导致肌肉蛋白降解加速,最终引起肌肉质量减轻[30]。Gomes等对小鼠进行禁食处理,检测到小鼠骨骼肌中FBXO32基因的mRNA表达量增长超过9倍,会导致小鼠的肌肉量减少[31]。本试验对藏猪和大约克猪这2猪种的腿肌、背最长肌组织进行RT-qPCR检测发现,在腿肌和背最长肌组织上藏猪FBXO32基因的mRNA相对表达量都显著高于大约克猪(P<0.05),该基因在生长相对缓慢的藏猪中呈高表达趋势,而藏猪是青藏高原特有的高原小型猪种,生长慢,大约克猪生长相对较快,2个猪种具有明显不同的生长趋势。在其他动物骨骼肌研究和本研究中关于FBXO32基因均能得到其在骨骼肌中的表达量与肌肉生长趋势呈现相反的结果。因此,FBXO32基因可能与猪肌肉的生长发育相关,并且对猪肌肉生长呈负调控作用。
本研究对藏猪和大约克猪FBXO32基因5′侧翼区的序列进行SNPs筛选,发现了FBXO32基因2个突变位点G-257A和A-556G,经转录因子预测,发现这2个位点突变前后均与肌肉发育相关,利用RT-qPCR对FBXO32基因在2猪种腿肌和背最长肌组织中的相对表达量进行检测,结果发现,FBXO32基因在腿肌和背最长肌组织上藏猪的表达量都显著高于大约克猪的表达量(P<0.05),推测这2个位点可能是参与肌肉生长发育的重要调控位点。通过RT-qPCR技术并联合基因频率分布情况及转录因子预测结果推测,FBXO32基因影响着猪肌肉的生长发育,并且对猪肌肉生长呈现负调控作用。因此,FBXO32基因可能是调控肌肉生长的关键功能候选基因,本研究结果可为后续研究FBXO32基因在猪生长发育中的分子作用机制与分子标记辅助育种提供新思路和理论依据。
参考文献:
[1]王雷杰. 金华猪与长白猪生长和肌肉发育差异的机理研究[D]. 杭州:浙江大学,2009:33-35.
[2]赵拴平,贾玉堂,徐 磊,等. 肉牛骨骼肌生长发育分子遗传调控研究进展[J]. 中国牛业科学,2016,42(6):57-60.
[3]于 晶. 猪FBXO32与其转录因子家族的基因克隆、定位、SNP检测及与生产性状的关联分析[D]. 武汉:华中农业大学,2006.
[4]Xie P,Guo S B,Fan Y N,et al. Atrogin-1/MAFbx enhances simulated ischemia/reperfusion-induced apoptosis in cardiomyocytes through degradation of MAPK phosphatase-1 and sustained JNK activation[J]. Journal of Biological Chemistry,2009,284(9):5488-5496.
[5]周建嫦. 骨骼肌蛋白质分解机制的研究进展[J]. 国外医学(临床生物化学与检验学分册),1998,19(5):228-231.
[6]Yin H,Zhang S,Gilbert E R,et al. Expression profiles of muscle genes in postnatal skeletal muscle in lines of chickens divergently selected for high and low body weight[J]. Poultry Science,2014,93(1):147-154.
[7]Lagirand-Cantaloube J,Offner N,Csibi A,et al. The initiation factor eIF3-f is a major target for Atrogin1/MAFbx function in skeletal muscle atrophy[J]. The EMBO Journal,2008,27(8):1266-1276.
[8]Tintignac L A,Lagirand J,Batonnet S,et al. Degradation of MyoD mediated by the SCF (MAFbx) ubiquitin ligase[J]. Journal of Biological Chemistry,2005,280(4):2847-2856.
[9]Csibi A,Leibovitch M P,Cornille K,et al. MAFbx/atrogin-1 controls the activity of the initiation factor eIF3-f in skeletal muscle atrophy by targeting multiple C-terminal lysines[J]. Journal of Biological Chemistry,2009,284(7):4413-4421.
[10]Chen F M,Chang H W,Yang S F,et al. The mitogen-activated protein kinase phosphatase-1 (MKP-1) gene is a potential methylation biomarker for malignancy of breast cancer[J]. Experimental & Molecular Medicine,2012,44(5):356-362.
[11]Cleveland B M,Evenhuis J P.Molecular characterization of atrogin-1/F-box protein-32 (FBXO32) and F-box protein-25 (FBXO25) in rainbow trout (Oncorhynchus mykiss):Expression across tissues in response to feed deprivation[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2010,157(3):248-257.
[12]強巴央宗,张 浩,纪素玲,等. 藏猪屠宰性能和肉质测定与分析[J]. 中国畜牧杂志,2008,44(21):10-11,48.
[13]商 鹏,强巴央宗,张 博,等. 藏猪选育群屠宰性能和肉质测定分析[J]. 黑龙江畜牧兽医,2015(2):30-32.
[14]王爱兰. F-box基因在动物中的进化和群体遗传学研究[D]. 杨凌:西北农林科技大学,2015:23-25.
[15]Choi J,Costa M L,Mermelstein C S,et al. MyoD converts primary dermal fibroblasts,chondroblasts,smooth muscle,and retinal pigmented epithelial cells into striated mononucleated myoblasts and multinucleated myotubes[J]. Proceedings of the National Academy of Sciences of the United States of America,1990,87(20):7988-7992.
[16]Nagai Y,Lam L,Greene M I,et al. FOXP3 and its cofactors as targets of immunotherapies[J]. Engineering,2019,5(1):115-121.
[17]Gong Z Q,Jia H,Yu J Q,et al. Nuclear FOXP3 inhibits tumor growth and induced apoptosis in hepatocellular carcinoma by targeting c-Myc[J]. Oncogenesis,2020,9:97.
[18]Bui T V,Mendell J T.Myc:maestro of microRNAs[J]. Genes & Cancer,2010,1(6):568-575.
[19]周笑莉,刘忆思,陈东风,等. 龟板提取物调控Otx2基因促进神经干细胞向多巴胺神经元分化的研究[J]. 中药新药与临床药理,2017,28(2):171-176.
[20]Wang N,Wang S L,Wang Y X,et al. SALL4 maintains self-renewal of porcine pluripotent stem cells through downregulation of OTX2[J]. Frontiers of Agricultural Science and Engineering,2019,6(1):81.
[21]郭 濤,刘 通,陈江炜,等. 生长分化因子-11促进小鼠诱导性多能干细胞向心肌细胞定向分化的研究[J]. 心脏杂志,2016,28(3):279-284.
[22]Tsuchihashi T,Maeda J,Shin C H,et al. Hand2 function in second heart field progenitors is essential for cardiogenesis[J]. Developmental Biology,2011,351(1):62-69.
[23]Holler K L,Hendershot T J,Troy S E,et al. Targeted deletion of Hand2 in cardiac neural crest-derived cells influences cardiac gene expression and outflow tract development[J]. Developmental Biology,2010,341(1):291-304.
[24]罗 文. Hand2及Pten在第二心场增殖和发育中的功能研究[D]. 南京:南京大学,2015.
[25]徐海侠. 低频脉冲电磁场通过MAPK/ERK信号传导通路促进C2C12成肌细胞增殖[D]. 广州:南方医科大学,2018.
[26]刘红艳. PEA3对FAAP基因的调控[D]. 济南:山东师范大学,2015.
[27]张 旭,马 红,刘 娣,等. 小鼠黏着斑相关蛋白在不同组织中的表达分析[J]. 畜牧与兽医,2013,45(6):59-61.
[28]Akagi T,Kuure S,Uranishi K,et al. ETS-related transcription factors ETV4 and ETV5 are involved in proliferation and induction of differentiation-associated genes in embryonic stem (ES) cells[J]. Journal of Biological Chemistry,2015,290(37):22460-22473.
[29]蒋芳萍,张晓刚,丘 彦,等. 成熟心肌细胞诱导胚胎干细胞定向分化为心肌样细胞[J]. 中国病理生理杂志,2009,25(5):1030-1033,1037.
[30]陈晓琳,吴宗辉,范 蕊,等. 电针对糖尿病大鼠腓肠肌中肌球蛋白重链降解的影响[J]. 针刺研究,2019,44(9):653-658.
[31]Gomes M D,Lecker S H,Jagoe R T,et al. Atrogin-1,a muscle-specific F-box protein highly expressed during muscle atrophy[J]. Proceedings of the National Academy of Sciences of the United States of America,2001,98(25):14440-14445.

